一株产壳聚糖酶芽孢杆菌的分离及鉴定
虞凤慧,徐泽平,2 *,谢海涛
(1.黄河三角洲京博化工研究院有限公司,山东 滨州 256500;2.滨州市环境微生物技术工程研究中心,山东 滨州 256500)
壳聚糖是由N-乙酰葡糖胺(GlcNAc)和葡糖胺(GlcN)通过β-(1-4)-糖苷键相连接的多糖[1-3],它是甲壳素脱乙酰基的产物[4-6]。壳聚糖酶(chitosanase,EC3.2.1.99)是一种可专一性降解壳聚糖的糖苷水解酶[7],可以选择性地、特异性地切断壳聚糖的β-(1-4)-糖苷键,得到特异分子量范围的壳寡糖[8]。壳寡糖是目前仅知的唯一的碱性寡糖[9],具有独特的生物活性[10-12],在医药、饲料、农业、环保、食品等领域具有广泛的应用[13-16]。随着壳寡糖的酶法制备工艺的深入研究,壳聚糖酶的生产及应用研究引起了国内外学者的广泛关注,成为目前的研究热点之一。
壳聚糖酶主要分布于细菌[17]、真菌[18]、病毒等微生物中。目前已报道有多种来源的菌株具有产生壳聚糖酶的能力,但已分离出的壳聚糖酶酶活力不高,使用效率较低,进而使其制备壳寡糖的工业化生产成本一直居高不下。因此,开发高活力、高产的壳聚糖酶工业化生产菌株资源意义重大。本研究拟从黄河三角洲地区的腐败落叶中分离出一株高产壳聚糖酶的芽孢杆菌菌株,通过形态学特征、生理生化特征及16S rDNA序列分析对该菌株进行分离、鉴定,以期为壳聚糖酶生产和应用奠定基础。
1 材料与方法
1.1 材料与试剂
腐败落叶:取自黄河三角洲地区;水溶性壳聚糖(脱乙酰度>90%):浙江金壳制品有限公司;其余试剂均为国产分析纯。
初筛培养基:水溶性壳聚糖1.5%,硫酸铵0.5%,酵母浸粉0.5%,磷酸二氢钾0.03%,磷酸氢二钾0.07%,七水硫酸镁0.005%,琼脂粉1.6%,pH 7.0。
种子培养基:蛋白胨1%,牛肉膏0.3%,氯化钠0.5%,葡萄糖1%,pH 7.0。
液体发酵(复筛)培养基:水溶性壳聚糖1.5%,硫酸铵0.5%,酵母浸粉0.5%,磷酸二氢钾0.03%,磷酸氢二钾0.07%,七水硫酸镁0.005%,氯化钠0.5%,葡萄糖0.2%,pH 7.0。
1.2 仪器与设备
DL-5型低速大容量离心机:上海安亭科学仪器厂;VORTEX-5旋涡混和器:海门市其林贝尔仪器制造有限公司;HZQ-Q全温振荡培养箱:哈尔滨市东联电子技术开发有限公司;SW-CJ-ID型单人净化工作台:苏州净化设备有限公司;FA2004型电子天平:上海仪电科学仪器股份有限公司。
1.3 方法
1.3.1 壳聚糖酶产生菌的筛选
(1)壳聚糖酶产生菌的初筛
称取粉碎的腐败落叶10 g,加入90 mL 无菌水中,振荡30 min,使样品与水充分混合,取混合液依次稀释成10-4、10-5、10-6、10-7等不同的稀释度,将稀释液涂布于初筛培养基上,33 ℃培养2~5 d,观察初筛培养基上菌落周围有无透明圈出现。以透明圈直径与菌落直径比值的大小作为筛选产壳聚糖酶菌株的指标,并进行分离纯化。
(2)壳聚糖酶产生菌的分离纯化
将分离的菌株接入种子培养基中,33 ℃、150 r/min振荡培养2 d后,用接种环取少量菌液接入营养琼脂培养基,采用平板划线分离法对菌株进行纯化,33 ℃培养2 d后,取单菌落接入斜面培养基中进行纯培养,备用。
(3)壳聚糖酶产生菌的复筛
种子培养:无菌条件下,取新鲜的斜面保藏菌种1~3环于种子培养基中,在33 ℃、150 r/min条件下摇瓶培养12~18 h,即为种子液。
液体发酵培养:无菌条件下,按5%的接种量,将种子液转接至液体发酵培养基中,33 ℃、150 r/min条件下摇瓶培养2 d,发酵液经4 000 r/min离心10 min,收集上清液,即为壳聚糖酶粗酶液,4 ℃保存备用。
(4)壳聚糖酶活性测定
采用DNS法[19]。
酶活定义:50 ℃条件下,1 mL液体酶每分钟催化产生1 μmol还原糖所需的酶量,即为一个酶活力单位,U/mL。
1.3.2 菌种鉴定
菌体形态观察:将分离纯化的产壳聚糖酶菌种接种于营养琼脂平板上,33 ℃培养24 h,观察菌体形态及菌落特征;接种于种子培养基中,33 ℃、150 r/min摇瓶培养12 h,进行革兰氏染色[20]。
生理生化试验:糖类发酵试验、V.P.试验、甲基红(methyl red,MR)试验、过氧化氢酶定性试验、生长温度的测定、酪氨酸水解试验、淀粉水解试验、吲哚试验参照《伯杰氏细菌鉴定手册》[21]方法进行。
16SrDNA序列分析:提取菌种的总DNA,进行16S rDNA的PCR扩增及序列测定,将16S rDNA测序结果在GenBank的核酸数据中进行同源性比对、分析。由中美泰和生物技术(北京)有限公司完成。
2 结果与分析
2.1 壳聚糖酶产生菌的筛选及酶活测定
通过菌种初筛,从黄河三角洲地区的腐败落叶中分离出9株产壳聚糖酶菌株,再经分离纯化和复筛,获得了1株产壳聚糖酶酶活最高的菌株,命名为XHT-0903,该菌株液体发酵酶活力达20 U/mL。
2.2 菌种鉴定
2.2.1 菌落及形态特征
菌株XHT-0903该菌株在营养琼脂平板上菌落呈圆形凸起,表面粗糙有蜡光,不透明,无色素,白色,似毛玻璃(如图1所示)。菌落直径约6 mm。
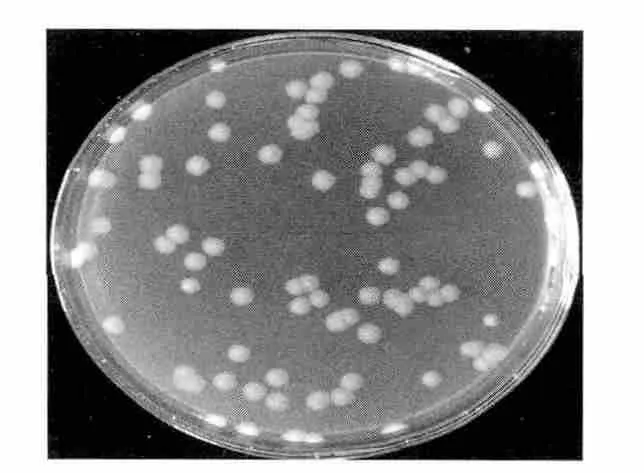
图1 XHT-0903菌株的菌落形态Fig.1 Colonial morphology of strain XHT-0903
革兰氏染色时菌体被均匀的染成蓝紫色,为革兰氏阳性菌。菌体形状为杆状,两端钝圆,且呈短链杆状排列,菌体大(如图2所示)。培养6 h后可形成芽孢,芽孢圆形,小于菌体。参考《伯杰氏细菌鉴定手册》,初步确定该菌株属于芽孢杆菌属(Bacillus)。
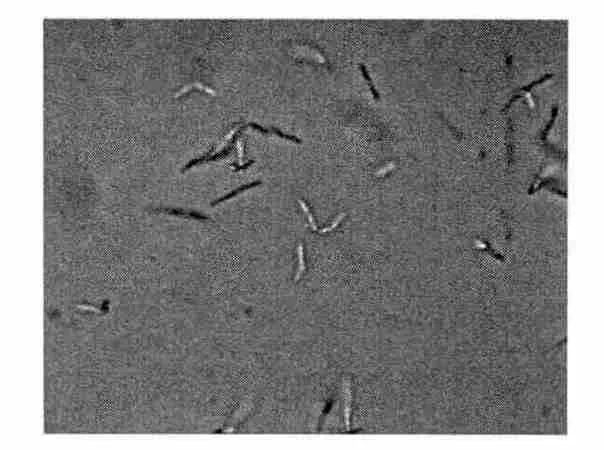
图2 XHT-0903菌株的光学显微镜图Fig.2 Optical micrograph of strain XHT-0903
2.2.2 生理生化特征
生理生化鉴别试验结果见表1。由表1可知,菌株XHT-0903能利用葡萄糖和乳糖;能水解酪氨酸和淀粉,其中在含有L-酪氨酸的培养基上培养至14 d时,酪氨酸结晶已经完全被水解而变为透明;V.P.试验、甲基红(MR)试验、过氧化氢酶试验和吲哚试验均呈阳性;生长温度试验显示,XHT-0903生长温度范围为15~45 ℃,最适温度为30~45 ℃。
根据上述形态学及生理生化特性研究,将菌株XHT-0903初步鉴定为蜡样芽孢杆菌(Bacillus cereus)。
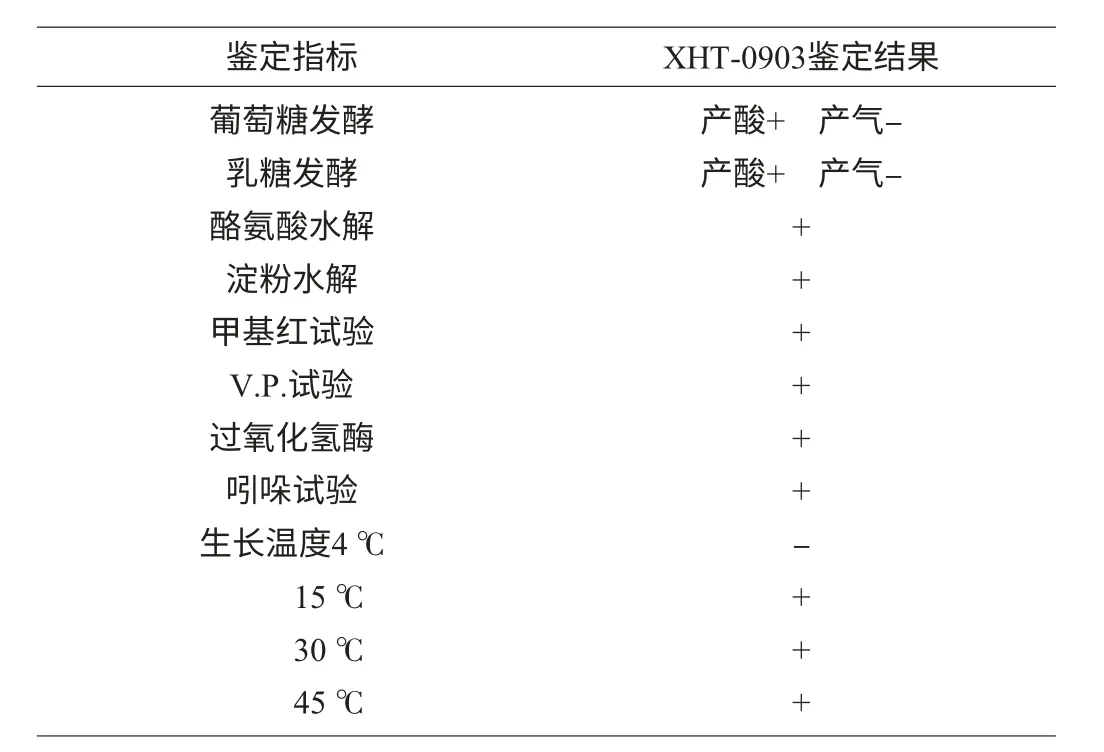
表1 XHT-0903菌株的生理生化特征Table 1 Physiological and biochemical characterizations of strain XHT-0903
2.2.3 16S rDNA序列分析结果
PCR产物测序结果表明,测序片断长1 402 bp。将该序列登录到GenBank,登录号为HM358155。采用NCBI中的Blast软件,将测得的16S rDNA序列与GenBank数据库中的核酸数据进行同源性比对。结果表明,该序列与数据库中的Bacillus属的不同菌株的核苷酸序列有大于99%的同源性,与其中5株蜡样芽孢杆菌(Bacillus cereus)菌株有100%的同源性。采用MEGA 4.0软件构建系统进化树,如图3所示。结合形态学特征及生理生化特性,进一步确定XHT-0903菌株为蜡样芽孢杆菌。该菌株已保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC No.4032。

图3 XHT-0903菌株的系统进化树Fig.3 Phylogenetic tree of strain XHT-0903
3 结论
本研究分离出一株壳聚糖酶高产菌株XHT-0903,通过形态学、生理生化特性及16S rDNA序列分析,确定为蜡样芽胞杆菌(Bacillus cereus)。相比已报道的产壳聚糖酶菌株,菌株XHT-0903具有产酶酶活高的优点,为高活力、高产的壳聚糖酶工业化生产菌株资源的开发奠定了基础。本研究下一步将进行XHT-0903的固体发酵、产酶条件的优化、壳聚糖酶解工艺等研究,以期为壳聚糖酶的工业化生产及应用提供参考。
[1]王艳君,卓少玲,陈 盛,等.产壳聚糖酶菌株的筛选、鉴定及酶学特性分析[J].微生物学通报,2012,39(12):1734-1745.
[2]SHAHIDI F,ARACHCHI A K V,JEON Y J.Food applications of chitin and chitosans[J].Trends Food Sci Tech,1999,10(2):37-51.
[3]程仕伟,张 盈,倪培拙,等.产壳聚糖酶的肠杆菌分离鉴定及其培养特性研究[J].鲁东大学学报:自然科学版,2014,30(1):43-47.
[4]涂绍勇,杨爱华,陈 燕,等.产壳聚糖酶菌株发酵条件的优化及酶解条件的研究[J].食品科技,2010,35(6):21-22.
[5]陈小娥,夏文水,余晓斌.微生物壳聚糖酶研究进展[J].海洋科学,2004,28(3):72-76.
[6]涂绍勇,杨爱华,梅双喜,等.酶法降解壳聚糖工艺研究[J].化学与生物工程,2009,26(12):63-65.
[7]季更生,陈爱春.微生物壳聚糖酶的研究进展[J].食品科学,2010,31(3):297-301.
[8]SOMASHEKAR D,JOSEPH R.Chitosanases-properties and applications:a review[J].Bioresource Technol,1996,55(1):35-45.
[9]黄惠莉,朱利平.壳聚糖酶的研究进展[J].食品工业科技,2012,33(6):439-443.
[10]SIMUNEK J,KOPPOVA I,FILIP L,et al.The antimicrobial action of low-molar-mass chitosan,chitosan derivatives and chitooligosaccharides on bifidobacteria[J].Folia Microbiol,2010,55(4):379-382.
[11]ZHANG J L,XIA W S,LIU P,et al.Chitosan modification and pharmaceutical/biomedical applications[J].Mar Drug,2010,8(7):1962-1987.
[12]刘 萍,刘 靖,祁兴普,等.绿色木霉产内切壳聚糖酶的鉴定及酶学性质的研究[J].食品工业科技,2011,32(12):254-255.
[13]屠 洁,张荣华.壳聚糖酶的研究进展与应用现状[J].江苏农业科学,2009(3):403-406.
[14]李剑峰,刘必谦,洪松柏,等.高产壳聚糖酶菌株的筛选及其产酶条件的优化[J].水生态学杂志,2010,3(3):127-130.
[15]YOL J J,SHANIDI F,KIM S K.Preparation of chitin and chitosan chito-oligosacchrides and their applications in physiological functional foods[J].Food Rev Int,2000,16(2):159-176.
[16]KHAN W,PRITHIVIRAJ B,SMITH D L,et al.Chitosan and chitinoligomers increase phenylalanine ammonia-lyase and tyrosine ammonialyase activities in soybean leaves[J].Plant Physiol,2003,160(8):859-863.
[17]石会会,高艳艳,王秀英,等.产壳聚糖酶菌株的筛选、鉴定及发酵条件优化[J].食品工业,2014,35(2):54-57.
[18]贾艳萍,张兰河,韩 利.产壳聚糖酶菌株的发酵条件优化[J].生物技术,2010,20(2):62-64.
[19]王艳君,陈 盛,杨 谦,等.产壳聚糖酶菌株的分离、鉴定及发酵条件优化[J].生物学杂志,2012,29(6):39-43.
[20]沈 萍,范秀容,李广武.微生物学实验[M].北京:高等教育出版社,1996.
[21]R.E.布坎南,N.E.吉本斯.伯杰细菌鉴定手册[M].北京:科学出版社,1984.

