血小板功能检测与P2Y12受体拮抗剂个体化抗血小板治疗的研究进展
刘 佳,尹 彤
血小板功能检测与P2Y12受体拮抗剂个体化抗血小板治疗的研究进展
刘 佳,尹 彤*
(解放军总医院心内科,北京 100853)
P2Y12受体拮抗剂广泛应用于急性冠脉综合征(ACS)及经皮冠状动脉介入治疗(PCI)后血栓事件的预防。由于抗血小板治疗反应多样性的存在,经典的P2Y12受体拮抗剂氯吡格雷的治疗期间高血小板反应性(HTPR)被证实与患者不良心血管事件的发生密切相关。尽管新药普拉格雷和替格瑞洛的抗栓疗效优于氯吡格雷,但是由于治疗期间低血小板反应性(LTPR)的存在,出血风险明显增加。如何权衡血栓和出血风险,实现个体化抗血小板治疗,已经成为临床的重要挑战。研究证实,血小板反应性(PR)与缺血和出血事件的发生密切有关,基于血小板功能检测(PFT)的治疗窗将有助于个体化抗血小板治疗。本文就PFT与P2Y12受体拮抗剂个体化抗血小板治疗的研究进展作一综述。
P2Y12受体拮抗剂;血小板功能检测;抗栓治疗;个体化
P2Y12受体拮抗剂广泛应用于急性冠脉综合征(acute coronary syndrome,ACS)及经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)后缺血事件的预防。其中经典的P2Y12受体拮抗剂氯吡格雷因其抗栓疗效的局限性引起广泛关注,氯吡格雷引起的治疗期间高血小板反应性(high on-treatment platelet reactivity,HTPR)与患者不良心血管事件的发生密切相关。尽管新型P2Y12受体拮抗剂普拉格雷和替格瑞洛能够提供比氯吡格雷更加快速、持久、有效的血小板抑制作用,但由于治疗期间低血小板反应性(low on-treatment platelet reactivity,LTPR)的发生,新药降低缺血风险的同时增加了出血风险。因此,如何权衡血栓事件和出血风险,实现个体化抗血小板治疗,已经成为临床的重要挑战[1]。2014年更新的专家共识[2]将血小板功能检测(platelet function test,PFT)作为PCI术后高风险患者抗栓药物选择的依据,但不作为常规推荐。新近基于PFT治疗窗的“ADP诱导的HTPR与缺血出血事件相关共识”的提出将有助于个体化抗血小板治疗[3]。
1 P2Y12受体拮抗剂抗血小板反应的多样性和临床转归
大量研究表明,氯吡格雷引起的血小板抑制水平在不同患者之间存在显著差异,约30%采用氯吡格雷治疗的患者发生HTPR。导致HTPR的主要影响因素包括:临床因素(如糖尿病、ACS、高体质量指数、肾功能衰竭、心力衰竭、炎症、高龄、吸烟等)、其他药物与氯吡格雷的交互作用(如钙通道阻滞剂、质子泵抑制剂、酮康唑等)以及药物代谢基因多态性(如CYP2C19的功能缺失性等位基因)的影响等[4]。在此基础上,大量观察性研究证实,HTPR和心血管缺血事件之间有明显相关性,尤其是与近期急性或亚急性支架内血栓形成(stent thrombosis,ST)之间的相关性最强[5]。
2 PFT的常用方法及治疗窗
PFT的目的在于获得不同抗栓药物的血小板抑制水平,及其与缺血和出血事件的关系。目前国内常用的PFT检测方法包括:光密度比浊法(light transmission aggregometry,LTA)、VerifyNow分析、血管舒张刺激磷蛋白磷酸化分析(vasodilator-stimulated phosphoprotein phosphorylation,VASP phosphorylation)和血栓弹力图法(thrombelastography,TEG)。每种检测方法的优缺点归纳见表1[5]。
一系列研究证实,血小板反应性(platelet reactivity,PR)在一定范围内与缺血或出血事件的发生相关,依据上述范围提出了PR治疗窗的概念[6]。ADAPT-DES试验研究结果提示,P2Y12反应单元(P2Y12reaction unit,PRU)>208时HTPR与主要出血事件呈负相关(HR:0.73,95%CI:0.61~0.89,=0.02)[7]。这一结果也被GRAVITAS试验证实,其结果表明,当PRU>208时能显著改善患者的临床预后[8]。另一项基于TEG检测的研究证实,ADP引起的最大凝血幅值(ADP-induced maximal amplitude,MAADP)>47mm时对PCI术后3年双联抗血小板治疗患者血栓事件的发生具有很高的预测价值,并且MAADP<31mm时能够很好预测出血事件的发生[9]。一项针对PCI术后接受普拉格雷治疗患者的多中心研究发现,血小板反应性指数(platelet reactivity index,PRI)>53.5%的患者中,血栓事件发生率明显升高(22.4%2.9%,<0.001)。而PRI<16%的患者相比PRI>16%的患者出血事件发生率亦明显升高(15.6%3.3%,<0.001)[10]。因此,能够预防治疗期间缺血事件和出血事件发生的血小板反应治疗窗也已相应出现。这个治疗窗有助于后续的试验研究减少P2Y12受体阻滞剂治疗期间的血栓事件和出血事件的发生。不同检测方法与临床缺血和出血事件相关的血小板反应性阈值见表2。
3 PCI术后患者基于PFT的个体化抗血小板治疗
Price等[11]的研究结果提示,PFT满足用于预测不良事件的标准,尤其是HTPR与血栓风险相关。ADAPT-DES研究结果明确了HTPR与ST的独立相关性[7]。在这项研究中,PRU>208的患者30d内发生ST的风险明显增加(HR:3.0,95%CI:1.39~6.49,=0.005)。此外PRU>208还是1年内发生ST的独立预测指标(HR:2.49,95%CI:1.43~4.31,=0.001)。值得注意的是,尽管很多HTPR患者在1年随访期内死亡,但是遗憾的是在调整了大量混杂因素以后,HTPR仍不能作为独立的预测死亡率的指标(HR:1.20,95%CI:0.85~1.70,=0.30)。另外与稳定性冠心病患者相比,HTPR对ACS患者的影响更大[7]。在一项涉及1 220名PCI术后患者的研究发现,HTPR(PRU>272)与心血管事件发生率的相关性仅见于急性心肌梗死患者中,而在非急性心肌梗死患者中未见上述相关性[12]。同样,Park等[13]的研究也证实,在东亚行PCI的ACS患者中,HTPR(PRU>272)与包括死亡、心肌梗死、ST和脑卒中在内的联合终点事件有关,但上述发现未见于稳定性冠心病患者中。
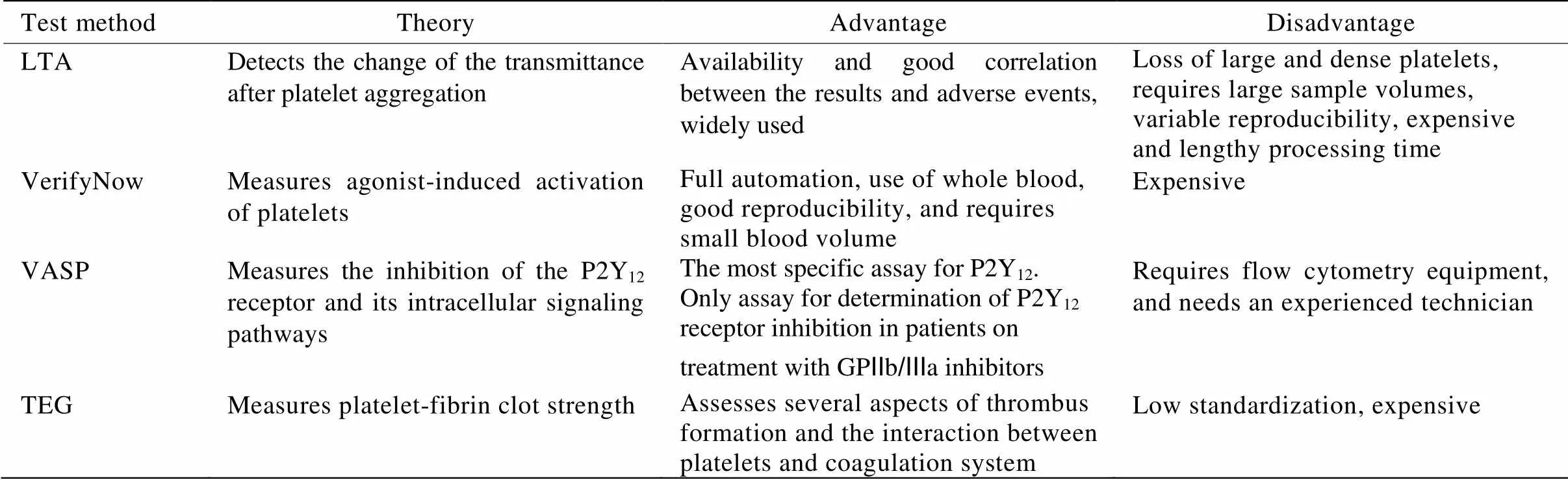
表1 常用的血小板功能检测方法
LTA: light transmission aggregometry; VASP phosphorylation: vasodilator-stimulated phosphoprotein phosphorylation; TEG: thrombelastography

表2 与临床缺血和出血事件相关的血小板反应性阈值
PRU: P2Y12reaction unit, determined by VerifyNow; MAADP: ADP-induced maximal amplitude, determined by thrombelastography; PRI: platelet reactivity index, determined by vasodilator-stimulated phosphoprotein phosphorylation
4 药物治疗患者基于PFT的个体化抗血小板治疗
尽管HTPR对于PCI术后患者不良事件的发生具有很强的预测作用,但是HTPR与ACS患者和接受药物治疗的稳定性冠心病患者的相关性并不强。对于使用阿司匹林或氯吡格雷有症状的稳定动脉粥样硬化患者,多项临床研究都未能证实PR对不良事件的预测价值[14]。TRILOGY-ACS试验血小板功能亚组的研究发现,HTPR并不能独立预测冠心病患者的不良心血管事件[15]。但是该试验本身具有一定的局限性,包括研究对象不是进行随机化选择,而且PFT并非在血栓形成风险最高时进行。在GRAVITAS试验中,高剂量氯吡格雷治疗(首次600mg负荷剂量,随后150mg/d高剂量)被证实不能降低6个月内缺血事件的发生率,但是由于这项试验检验效能低,因此结论效力不足[11]。
尽管以上大型临床研究结果均为阴性,但是一些小规模研究仍提示,基于PFT指导下的抗血小板治疗有效[17−20]。一项包含9个随机对照试验的meta分析发现,HTPR的患者在给予强化抗血小板治疗后,其心源性死亡和ST事件的发生率明显降低,且在高风险患者中相关性最强[21]。
5 PFT与出血并发症的关系
虽然HTPR和心血管缺血事件之间的关联性已被公认,但是LTPR和出血事件之间的相关性仍不清楚。对PCI术后患者的观察性研究(包括GRAVITAS[11]和ARCTIC[16])试验提出,LTPR可能与出血事件有关。一项针对非ST段抬高性心肌梗死(non-ST-elevation myocardial infarction,NSTEMI)PCI术后患者的队列研究(=597)发现,当ADP诱导的血小板聚集率<40%时,出血风险明显增加[22]。大规模的前瞻性队列研究(=2 533)进一步证实,和非冠状动脉搭桥术相关的PCI术后出血与血小板反应性具有相关性[23]。另外,有研究发现,PCI术后经普拉格雷治疗的LTPR患者更容易发生出血[24]。非冠状动脉搭桥术相关的大出血和普拉格雷治疗期间LTPR之间的关系也证实了PFT的潜在价值[10]。但是,大规模临床研究如POPULAR[25]、GRAVITAS[11]和ARCTIC[16]研究并没有发现血小板反应性和出血事件之间有意义的联系。出现上述研究结果差异的可能原因包括:研究总体出血事件的发生率较低;出血标准的定义不同;将操作相关出血纳入到主要终点事件中。随后,在纳入了8 538名患者的ADAPT-DES研究[7]中,经过倾向性校正分析后发现,使用氯吡格雷患者发生HTPR(PRU>208)不仅与ST(HR:2.49,95%CI:1.43~4.31,=0.001)和心肌梗死(HR:1.42,95%CI:1.09~1.86,=0.01)的发生率有关,并且与主要出血事件呈负相关(HR:0.73,95%CI:0.61~0.89,=0.002)。
6 PFT与新型P2Y12受体拮抗剂的个体化治疗
近期的研究证实,HTPR也存在于新型P2Y12抑制剂的抗栓治疗中,并且比氯吡格雷更容易造成LTPR,因此使用PFT预测普拉格雷和替格瑞洛治疗过程中的出血事件更为重要。在对PCI术后ST段抬高性心肌梗死(ST-elevated myocardial infarction,STEMI)患者随机应用普拉格雷或替格瑞洛的前瞻性研究发现,两种药物2h后HTPR(PRU>208)发生率分别达到34.6%和46.2%,随后显著降低,5d后两种药的检测结果无明显差异[26]。这提示在使用普拉格雷或替格瑞洛的起始阶段应格外关注HTPR的发生。
7 结 论
HTPR被证实是PCI术后ST和心肌梗死发生的一个主要危险因素,通过PFT有助于识别高风险患者,尤其对于有左心室功能不全、冠状动脉病变复杂、高体质量指数和糖尿病等高风险的患者。尽管如此,多数临床随机对照试验仍不能确定PFT是否可以降低患者不良心血管事件的发生率,并且大剂量氯吡格雷对于抑制HTPR和提高临床效果并非最优策略。因此,有必要通过大规模临床试验来评价PFT对于P2Y12受体拮抗剂个体化治疗的实用价值。另外,PR与ACS康复期患者的临床转归之间的关系尚不明确。最新研究数据证实LTPR与出血风险的关联性,并提出新型P2Y12受体拮抗剂治疗与出血风险的增加有关。鉴于此,根据PFT治疗窗进行的个体化抗血小板治疗有望改善抗栓治疗的有效性和安全性之间的平衡。
[1] Society of Cardiology of Chinese Medical Association, Editorial Committee of Chinese Journal of Cardiology. Expert consensus of antiplatelet therapy in cardiovascular disease[J]. Chin J Cardiol, 2013, 41(3): 183−194. [中华医学会心血管病分会, 中华心血管病杂志编辑委员会. 抗血小板治疗中国专家共识[J]. 中华心血管病杂志, 2013, 41(3): 183−194.]
[2] Dehmer GJ, Blankenship JC, Cilingiroglu M,. SCAI/ACC/AHA Expert Consensus Document: 2014 update on percutaneous coronary intervention without on-site surgical backup[J]. J Am Coll Cardiol, 2014, 63(23): 2624−2641.
[3] Tantry US, Bonello L, Aradi D,. Consensus and update on the definition of on-treatment platelet reactivity to adenosine diphosphate associated with ischemia and bleeding[J]. J Am Coll Cardiol, 2013, 62(24): 2261−2273.
[4] Cayla G, Hulot JS, O’Connor SA,Clinical, angiographic, and genetic factors associated with early coronary stent thrombosis[J]. JAMA, 2011, 306(16): 1765−1774.
[5] Siller-Matula JM, Trenk D, Schror K,. Response variability to P2Y12receptor inhibitors: expectations and reality[J]. JACC Cardiovasc Interv, 2013, 6(11): 1111−1128.
[6] Gurbel PA, Becker RC, Mann KG,. Platelet function monitoring in patients with coronary artery disease[J]. J Am Coll Cardiol, 2007, 50(19): 1822−1834.
[7] Stone GW, Witzenbichler B, Weisz G,. Platelet reactivity and clinical outcomes after coronary artery implantation of drug-eluting stents (ADAPT-DES): a prospective multicentre registry study[J]. Lancet, 2013, 382(9892): 614−623.
[8] Price MJ, Angiolillo DJ, Teirstein PS,. Platelet reactivity and cardiovascular outcomes after percutaneous coronary intervention: a time-dependent analysis of the Gauging Responsiveness with a VerifyNow P2Y12assay: Impact on Thrombosis and Safety (GRAVITAS) trial[J]. Circulation, 2011, 124(10): 1132−1137.
[9] Gurbel PA, Bliden KP, Navickas IA,. Adenosine diphosphate-induced platelet-fibrin clot strength: a new thrombelastographic indicator of long-term poststenting ischemic events[J]. Am Heart J, 2010, 160(2): 346−354.
[10] Bonello L, Mancini J, Pansieri M,. Relationship between post-treatment platelet reactivity and ischemic and bleeding events at 1-year follow-up in patients receiving prasugrel[J]. J Thromb Haemost, 2012, 10(10): 1999−2005.
[11] Price MJ, Berger PB, Teirstein PS,. Standard-high-dose clopidogrel based on platelet function testing after percutaneous coronary intervention: the GRAVITAS randomized trial[J]. JAMA, 2011, 305(11): 1097−1105.
[12] Ahn SG, Lee SH, Yoon JH,. Different prognostic significance of high on-treatment platelet reactivity as assessed by the VerifyNow P2Y12assay after coronary stenting in patients with and without acute myocardial infarction[J]. JACC Cardiovasc Interv, 2012, 5(3): 259−567.
[13] Park DW, Ahn JM, Song HG,Differential prognostic impact of high on-treatment platelet reactivity among patients with acute coronary syndromesstable coronary artery disease undergoing percutaneous coronary intervention[J]. Am Heart J, 2013, 165(1): 34−42.
[14] Reny JL, Berdagué P, Poncet A,. Antiplatelet drug response status does not predict recurrent ischemic events in stable cardiovascular patients: results of the Antiplatelet Drug Resistances and Ischemic Events study[J]. Circulation, 2012, 125(25): 3201−3210.
[15] Gurbel PA, Erlinge D, Ohman EM,. Platelet function during extended prasugrel and clopidogrel therapy for patients with ACS treated without revascularization: the TRILOGY ACS platelet function substudy[J]. JAMA, 2012, 308(17): 1785−1794.
[16] Collet JP, Cuisset T, Range G,. Bedside monitoring to adjust antiplatelet therapy for coronary stenting[J]. N Engl J Med, 2012, 367(22): 2100−2109.
[17] Campo G, Fileti L, de Cesare N,. Long-term clinical outcome based on aspirin and clopidogrel responsiveness status after elective percutaneous coronary intervention: a 3T/2R (tailoring treatment with tirofiban in patients showing resistance to aspirin and/or resistance to clopidogrel) trial substudy[J]. J Am Coll Cardiol, 2010, 56(18): 1447−1455.
[18] Cuisset T, Frere C, Quilici J,. Adjusting clopidogrel loading doses according to vasodilator-stimulated phosphoprotein index: on time, too early, or too late[J]? J Am Coll Cardiol, 2008, 52(9): 790−791.
[19] Cuisset T, Frere C, Quilici J,GlycoproteinⅡb/Ⅲa inhibitors improve outcome after coronary stenting in clopidogrel nonresponders: a prospective, randomized study[J]. JACC Cardiovasc Interv, 2008, 1(6): 649−653.
[20] Gurbel PA, Tantry US. An initial experiment with personalized antiplatelet therapy: the GRAVITAS trial[J]. JAMA, 2011, 305(11): 1136−1137.
[21] Aradi D, Komócsi A, Price MJ,. Efficacy and safety of intensified antiplatelet therapy on the basis of platelet reactivity testing in patients after percutaneous coronary intervention: systematic review and meta-analysis[J]. Int J Cardiol, 2013, 167(5): 2140−2148.
[22] Cuisset T, Cayla G, Frere C,. Predictive value of post-treatment platelet reactivity for occurrence of post-discharge bleeding after non-ST elevation acute coronary syndrome. Shifting from antiplatelet resistance to bleeding risk assessment[J]? EuroIntervention, 2009, 5(3): 325−329.
[23] Sibbing D, Schulz S, Braun S,. Antiplatelet effects of clopidogrel and bleeding in patients undergoing coronary stent placement[J]. J Thromb Haemost, 2010, 8(2): 250−256.
[24] Parodi G, Bellandi B, Venditti F,. Residual platelet reactivity, bleedings, and adherence to treatment in patients having coronary stent implantation treated with prasugrel[J]. Am J Cardiol, 2012, 109(2): 214−218.
[25] Breet NJ, van Werkum JW, Bouman HJ,Comparison of platelet function tests in predicting clinical outcome in patients undergoing coronary stent implantation[J]. JAMA, 2010, 303(8): 754−762.
[26] Alexopoulos D, Xanthopoulou I, Gkizas V,Randomized assessment of ticagrelorprasugrel antiplatelet effects in patients with ST-segment-elevation myocardial infarction[J]. Circ Cardiovasc Interv, 2012, 5(6): 797−804.
(编辑: 刘子琪)
Platelet function test and individualized antiplatelet therapy with P2Y12receptor antagonist: research progress
LIU Jia, YIN Tong*
(Department of Cardiology, Chinese PLA General Hospital, Beijing 100853, China)
P2Y12receptor antagonists are widely used to prevent thrombotic events in acute coronary syndromes (ACS) patients after undergoing percutaneous coronary intervention (PCI). Due to the variability of antiplatelet responsiveness, high on-treatment platelet reactivity (HTPR) has been observed to be related to cardiovascular adverse events in the patients treated with a classical P2Y12receptor antagonist, clopidogrel. New P2Y12receptor antagonists, such as prasugrel and ticagrelor, exert better antithrombotic effect than clopidogrel; however, higher efficacy, which is reflected by low on-treatment platelet reactivity (LTPR), increases the risk of bleeding events. How to balance the risk of thrombosis and bleeding to achieve individualized antiplatelet therapy has become an important clinical challenge. Evidence has shown that platelet reactivitcy (PR) is associated with ischemia and hemorrhage events. Therapeutic windows based on the platelet function test (PFT) will contribute to individualized antiplatelet therapy. The present review focused on the advance of PFT in individualized antiplatelet therapy with P2Y12receptor antagonists.
P2Y12receptor antagonists; platelet function test; antithrombotic therapy; individualization
(7152129) and(2012FC-TSYS-3043).
R558
A
10.11915/j.issn.1671-5403.2015.10.182
2015−04−23;
2015−05−25
北京市自然科学基金面上项目(7152129);解放军总医院临床扶持基金(No.2012FC-TSYS-3043)
尹 彤, E-mail: yintong2000@yahoo.com

