骨桥蛋白和E-钙粘素与宫颈癌放疗抵抗的相关性*
钱玉洁,黄昕琼,申良方
(中南大学湘雅医院 肿瘤科,湖南 长沙410008)
宫颈癌是世界范围内女性第三常见的恶性肿瘤[1],放射治疗在宫颈癌的治疗中占有重要地位,宫颈癌各期均可行放射治疗,包括根治性放疗和姑息性放疗[2]。然而,放射治疗中存在放疗抵抗是治疗失败的原因之一。上皮间质转化(epithelial-mesenchymal transition,EMT)是哺乳动物胚胎发育过程中的正常生理现象,但是在成熟组织中发生不恰当的EMT则与肿瘤的浸润和转移密切相关。目前的研究表明肿瘤细胞的EMT过程与肿瘤放疗抵抗也有相关性。早期研究表明丢失E-钙粘素(E-cadherin)表达是EMT的显著特点[3],近来新证据表明骨桥蛋白(Osteopontin,OPN)可能参与了EMT过程[4]。目前,尚无研究表明与EMT相关的E-cadherin和Osteopontin蛋白在局部进展期宫颈鳞癌(locally advanced cervical squamous cell carcinoma,LACSCC)中的表达是否与放疗敏感性相关。
1 资料与方法
1.1 临床病例及样本资料
本回顾性队列研究共入组132名患者,所有患者均在2005年1月-2012年3月于中南大学湘雅医院肿瘤放射治疗科和湖南省肿瘤医院接受放射治疗。入选标准:①病理学证实为宫颈鳞癌;②诊断时没有远处转移证据(FIGO分期为IB-IVA);③组织切块可用于本研究;④放射治疗前未接受其他抗肿瘤治疗措施且放疗后未实施手术者。本研究经过伦理研究委员会批准。随访时间至2012年5月,中位随访时间为45.0(2.0~85.5)个月。中位无进展生存期(progression free survival,PFS)为43.5(0.0~85.5)个月。中位年龄为51(28~80)岁。132例病例分为放疗敏感组(n=85)和放疗抵抗组(n=47)。放疗敏感组指初始治疗后至少3年内无局部复发和远处转移,即PFS≥36个月。放疗抵抗组指初始治疗后3年内出现放疗未控制,局部复发或远处转移,即PFS<36个月[5]。因此,本研究将放疗抵抗组分为3个亚组:放疗未控制亚组,局部复发亚组和远处转移亚组。放疗未控制亚组指肿瘤从未消失直至患者死亡。局部复发亚组指初始治疗后3年内出现局部复发。远处转移亚组指初始治疗后3年内出现远处转移。PFS定义为治疗结束至第一次证实有局部复发或远处转移的时期。如在初始放疗后诊断为放疗未控制、局部复发或远处转移必须有临床检查,病理活检或影像学检查等证据。每个宫颈肿瘤大小评估均由临床检查来直接测量,而不采用影像学手段间接测量。在本研究中,放疗未控制亚组9例,局部复发亚组17例,远处转移亚组22例。其中1例在放疗期间出现远处转移,且直至患者死亡肿块从未消失,笔者认为这1例患者既属于放疗未控制亚组也属于远处转移亚组。另外有3例患者在放疗后出现远处转移,但该3例患者PFS大于36个月。所以,本研究将这3例患者归为放疗敏感组。
所有患者均接受放射肿瘤医师制定的外放射治疗和高剂量率的腔内放疗。外照射开始后的3~4周开始腔内放疗。A点中位总剂量为90(66~102)Gy。外照射在A点的中位计量为46(30~52)Gy。腔内放疗在A点的中位计量为42(20~54)Gy。其中部分患者同时接受以铂类为基础的化疗。但化疗药物并不统一,甚至铂类药物也不统一,如顺铂、卡铂和奥沙利铂等。这些差异增加了统计分析难度。
1.2 免疫组织化学检测
用免疫组化的方法检测Osteopontin与E-cadherin,将4μm的组织切片在二甲苯溶液中脱蜡,0.01M柠檬酸缓冲液(pH 6.0)微波处理(Osteopontin孵育10min,E-cadherin孵育15min)。冷却30min并在磷酸盐缓冲液中浸泡后,用3%过氧化氢孵育30min以消除内源性过氧物酶活性,接下来在10%常规山羊血清(磷酸盐缓冲液稀释)中孵育30min,滴加1∶200比例稀释的抗Osteopontin(Santa Cruz Biotechnology Inc.,Dallas,TX)抗体和1∶200比例稀释的抗E-cadherin(Cell Signaling Technology Inc.,Beverly,MA)抗体,4℃过夜。使用ChemMate试剂盒(Dako,Glostrup,Denmark)和3,3-二氨基联苯胺(DAB)显色试剂盒进行染色。为阴性对照,使用非免疫性的同型抗体代替一级抗体。
1.3 染色评价标准
由两名不知晓临床特征及预后的病理科医生对所有样本进行双盲法阅片。首先低倍镜(×40)下观察全片Osteopontin和E-cadherin表达情况,然后高倍视野(×400)下观察。采用免疫反应评分(immunoreactivity score,IRS)系统[6]。根据染色细胞比例:0分为无染色,1分为阳性细胞数≤1/3,2分为阳性细胞数>1/3且≤2/3,3分为阳性细胞数>2/3;根据染色强度:0分为阴性,1分为弱阳性,2分为阳性,3分为强阳性。两项得分之和作为免疫反应得分(0~6)。最终得分为0~1分视为低表达,2~6分视为高表达。
1.4 统计学分析
Osteopontin和E-cadherin表达与宫颈鳞癌临床病理因素之间的分析,采用卡方检验和Fisher's精确检验。放疗剂量差异采用t检验分析。生存分析中截尾值包括随访截止及因其他原因而非宫颈鳞癌死亡的患者。采用Kaplan-Meier计算生存曲线,组间差异采用log-rank检验。根据Cox比例风险模型进行单因素和多因素分析。回归模型包括仅表达Osteopontin(高表达与低表达),仅表达E-cadherin(高表达与低表达),高表达Osteopontin同时低表达E-cadherin(是与否),年龄(≥50岁与<50岁),FIGO分期(Ⅲ+ⅣavsⅠb+Ⅱ),组织病理学分级(中分化+低分化与高分化),肿瘤大小(>4 cm vs≤4 cm)。所有统计学检验,P≤0.05为有统计学意义。
2 结果
2.1 132例病例的临床及组织病理学特征
患者的临床及组织病理学特征见表1。共收集132名LACSCC患者(放疗抵抗组47人,放疗敏感组85人)。其中<50岁49人,≥50岁83人。FIGO分期为Ⅰb+Ⅱ及Ⅲ+Ⅳa的患者分别为70(6+64)人、62(56+6)人。按照WHO病理分级,高分化、中分化和低分化的人数分别为10、114和8。肿块最大径≤4 cm的人数为79人,>4 cm的人数为53人。放疗抵抗组与放疗敏感组病例之间的肿块大小、FIGO分期和组织病理学分级差异均有统计学意义,P值分别为0.000、0.004和0.014。两组之间患者年龄、联合化疗(以铂类为基础)、A点总剂量、外照射A点计量和腔内照射A点剂量差异均无统计学意义。
2.2 Osteopontin与E-cadherin的表达与临床病理学参数的关系
Osteopontin位于宫颈癌细胞胞膜和胞质,其在放疗抵抗组的着色较放疗敏感组明显(图1A和1B)。132例宫颈癌患者中,Osteopontin低表达者65例,占49.2%(65/132),高表达67例,占50.8%(67/132)。分析数据发现Osteopontin的表达与FIGO分期和肿瘤大小显著相关(P值分别为0.001和0.004),而与患者年龄和病理分级不相关(P值分别为0.963和0.203)。见表2。
E-cadherin位于宫颈癌细胞膜,其在放疗敏感组的着色较放疗抵抗组明显(图1C和1D)。132例宫颈癌患者中,E-cadherin低表达者83例,占62.9%(83/132),高表达者49例,占37.1%(49/132)。分析数据发现E-cadherin的表达与病理分级相关(P=0.039)。而与患者年龄、FIGO分期和肿瘤大小无显著相关性(P值分别为0.234,0.070和0.626)。
132例患者中,OPN高表达且E-cadherin低表达者为37.9%(50/132),其他表达组合占62.1%和(82/132)。见表2。
分析发现,Osteopontin高表达且E-cadherin低表达与FIGO分期(P=0.000)和肿瘤大小(P=0.030)密切相关。但与患者年龄(P=0.342)和病理分级(P=0.089)不相关。
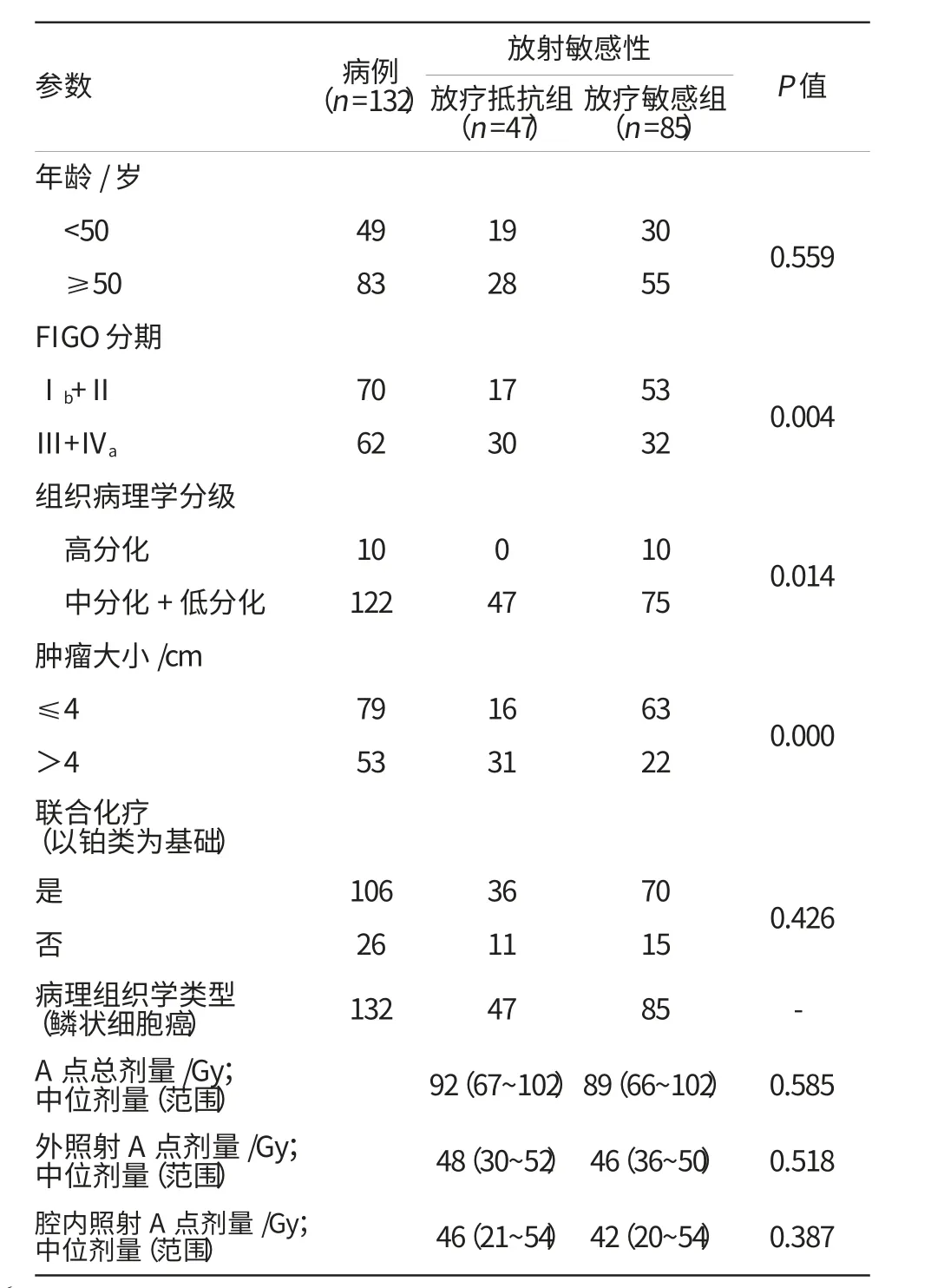
表1 放射敏感性与临床病理学特征的关系
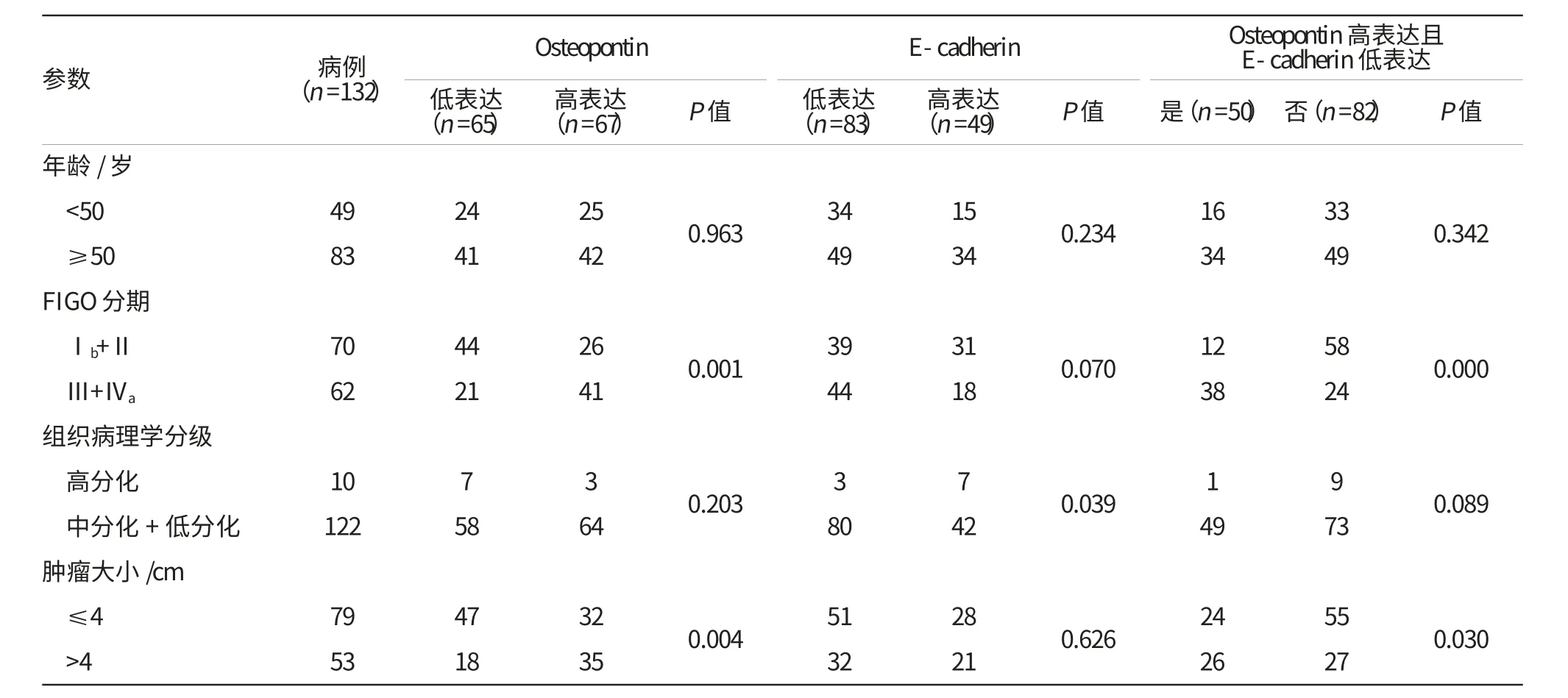
表2 宫颈癌组织中Osteopontin与E-cadherin表达与临床病理学特征的关系
2.3 Osteopontin表达与E-cadherin表达之间的关系
本研究共有132例合格标本为Osteopontin与E-cadherin免疫染色评估。两种标记物均按照免疫组织化学染色程度分为低、高两种类型,详见表3。在Osteopontin高表达的67例病例中,32.8%(22/67)的病例显示E-cadherin高表达。与此相反的是,Osteopontin低表达的65例病例中,41.5%(27/65)的病例显示E-cadherin高表达。Osteopontin的表达与E-cadherin的表达无相关性(r=-0.09,P=0.304)。见表3。
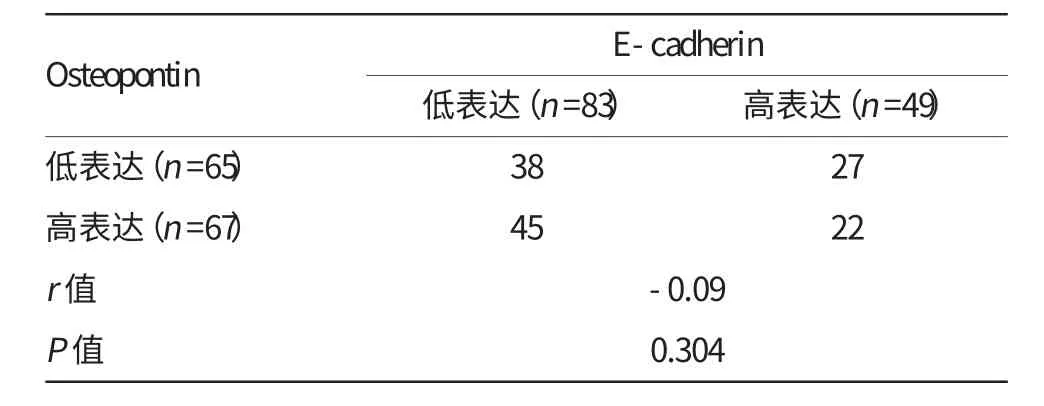
表3 OPN与E-cadherin的表达关系
2.4 Osteopontin表达与E-cadherin表达对放疗的反应
132例LACSCC标本Osteopontin的表达情况总结见表4。47例放疗抵抗组中,6例为Osteopontin低表达,占12.8%(6/47),41例为Osteopontin高表达,占87.2%(41/47)。85例放疗敏感组中,59例为Osteopontin低表达,占69.4%(59/85),26例为Osteopontin高表达,占30.6%(26/85)。Osteopontin的高表达率在放疗抵抗组与放疗敏感组之间的差异具有统计学意义(P=0.000)。根据患者的临床资料放疗抵抗组分为3个亚组:放疗未控制亚组,局部复发亚组和远处转移亚组。Osteopontin的高表达率在这3个 亚 组 中 的 比 例 分 别 为:88.9%(8/9),88.2%(15/17)和86.4%(19/22)。同样的,Osteopontin在这3个放疗抵抗亚组中的高表达与放疗敏感组之间的差异也具有统计学意义(放疗未控制组与放疗敏感组,P=0.001;局部复发亚组与放疗敏感组,P=0.000;远处转移亚组与放疗敏感组,P=0.000)。
132例宫颈鳞癌标本E-cadherin的表达情况总结见表4。47例放疗抵抗组中,E-cadherin低表达有34例,占72.3%(34/47),E-cadherin高表达有13例,占27.7%(13/47)。85例放疗敏感组中,49例为E-cadherin低 表 达,占57.6%(49/85),36例 为E-cadherin高表达,占42.4%(36/85)。E-cadherin的低表达率在放疗抵抗组与放疗敏感组之间的差异无统计学意义(P=0.094)。E-cadherin的低表达率在放疗未控制亚组,局部复发亚组,远处转移亚组的比例分别为88.9%(8/9)、76.5%(13/17)和77.3%(17/22)。分析3个放疗抵抗亚组与放疗敏感组中E-cadherin的低表达发现,E-cadherin低表达率在远处转移亚组与放疗敏感组之间的差异具有统计学意义(P=0.049),而放疗未控制亚组及局部复发亚组与放疗敏感组之间的E-cadherin表达差异无统计学意义(P值分别为0.084和0.147)。
132例宫颈鳞癌标本Osteopontin与E-cadherin联合表达情况总结见表4。表达Osteopontin且低表达E-cadherin的病例在放疗抵抗组中占72.3%(34/47),在放疗敏感组中占18.8%(16/85)。比较放疗抵抗组与放疗敏感组之间Osteopontin高表达且E-cadherin低表达的情况,发现两组之间差异具有统计学意义(P=0.000)。在放疗抵抗亚组中分析O steopontin高表达且E-cadherin低表达分别为:放疗未控制亚组88.9%(8/9),局部复发亚组70.6%(12/17),远处转移亚组68.2%(15/22)。3个亚组的Osteopontin高表达且E-cadherin低表达与放疗敏感组之间差异有统计学意义(放疗未控制亚组与放疗敏感组,P=0.000;局部复发亚组与放疗敏感组,P=0.000;远处转移亚组与放疗敏感组,P=0.000)。
2.5 Osteopontin表达和E-cadherin表达与生存的关系
将患者根据肿瘤Osteopontin表达情况进行分层,Osteopontin低表达组(n=65)与高表达组(n=67)的5年无进展生存率分别为88.1%和44.1%。Kaplan-Meier生存分析(log-rank检验)发现两组之间生存差异有统计学意义(P=0.000,图2A)。
同样将患者根据肿瘤E-cadherin的表达情况分层,E-cadherin低表达组(n=83)与高表达组(n=49)的5年无进展生存率分别为60.2%和78.3%。Kaplan-Meier生存分析(log-rank检验)发现两组之间生存差异无统计学意义(P=0.097,图2B)。
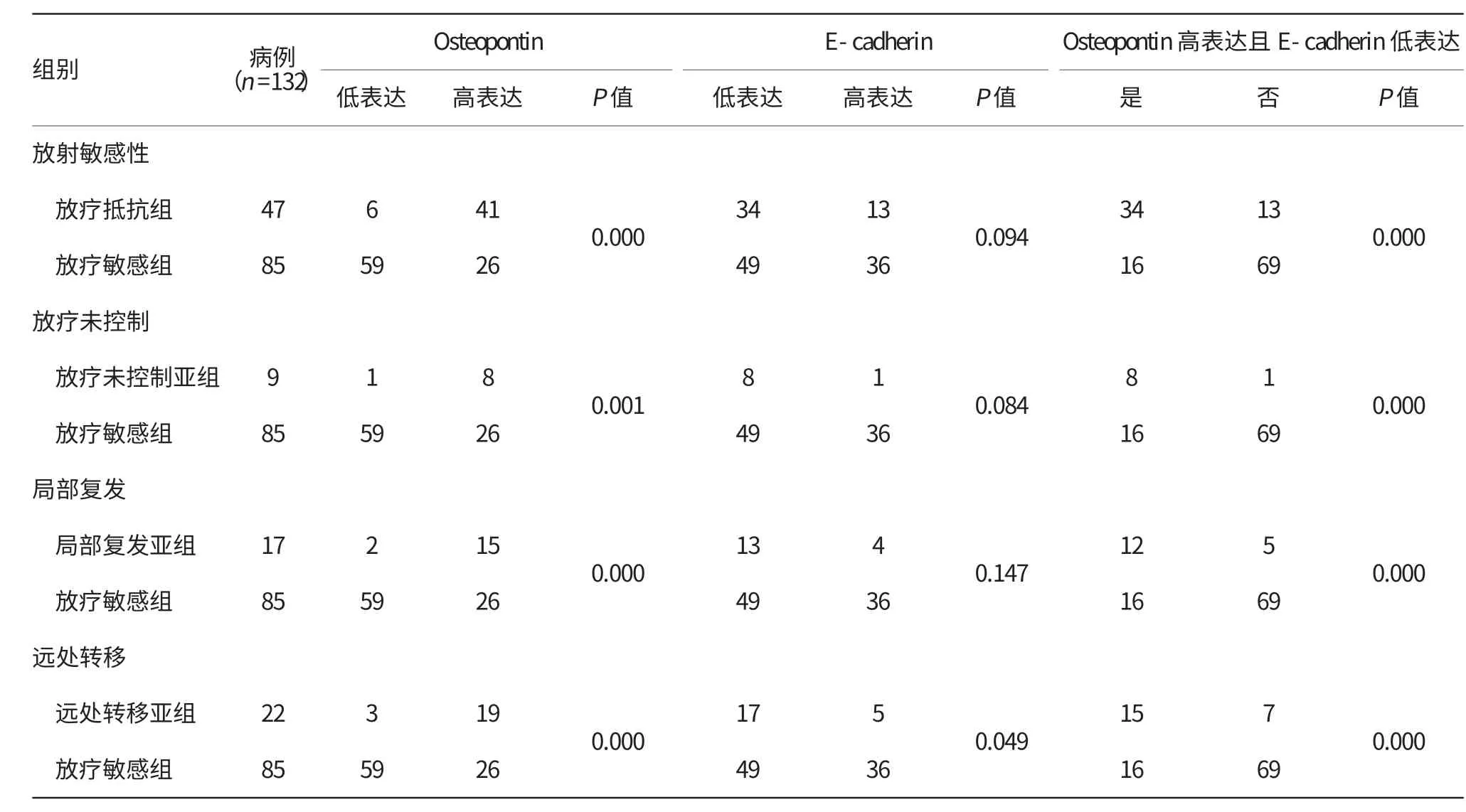
表4 宫颈癌组织中osteopontin与E-cadherin表达与放射敏感性的关系
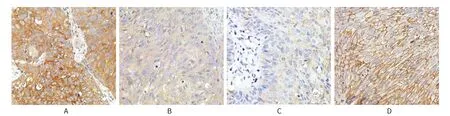
图1 Osteopontin与E-cadherin在放疗抵抗组和放疗敏感组中典型的染色图像(×400)
如果将患者根据肿瘤高表达Osteopontin且低表达E-cadherin分层,那么高表达Osteopontin且低表达E-cadherin病例(n=50)与其他表型病例(n=82)的5年无进展生存率分别为38.1%和81.8%。Kaplan-Meier生存分析(log-rank检验)发现高表达Osteopontin同时低表达E-cadherin的患者预后显著不良(P=0.000,图2C)。对于所有入组的132例病例,5年无进展生存率为66.8%(图2D)。
单因素分析发现LACSCC患者的PFS的预测因素包括Osteopontin表达[风险比(95%CI),6.725(3.246,13.936);P=0.000],Osteopontin高表达且Ecadherin低表达[风险比(95%CI),5.814(3.144,10.752);P=0.000],FIGO分期 [风险比(95%CI),2.610(1.453,4.689);P=0.001],及肿瘤大小[风险比(95%CI),3.366(1.885,6.012);P=0.000]。见表5。
多因素Cox回归分析发现LACSCC患者的PFS的预测因素包括Osteopontin表达[风险比(95%CI),2.847(1.048,7.730);P=0.040],Osteopontin高表达且E-cadherin低 表 达 [风 险 比(95%CI),2.571(1.121,5.894);P=0.026],及肿瘤大小[风险比(95%CI),2.635(1.462,4.750);P=0.001]。见表5。
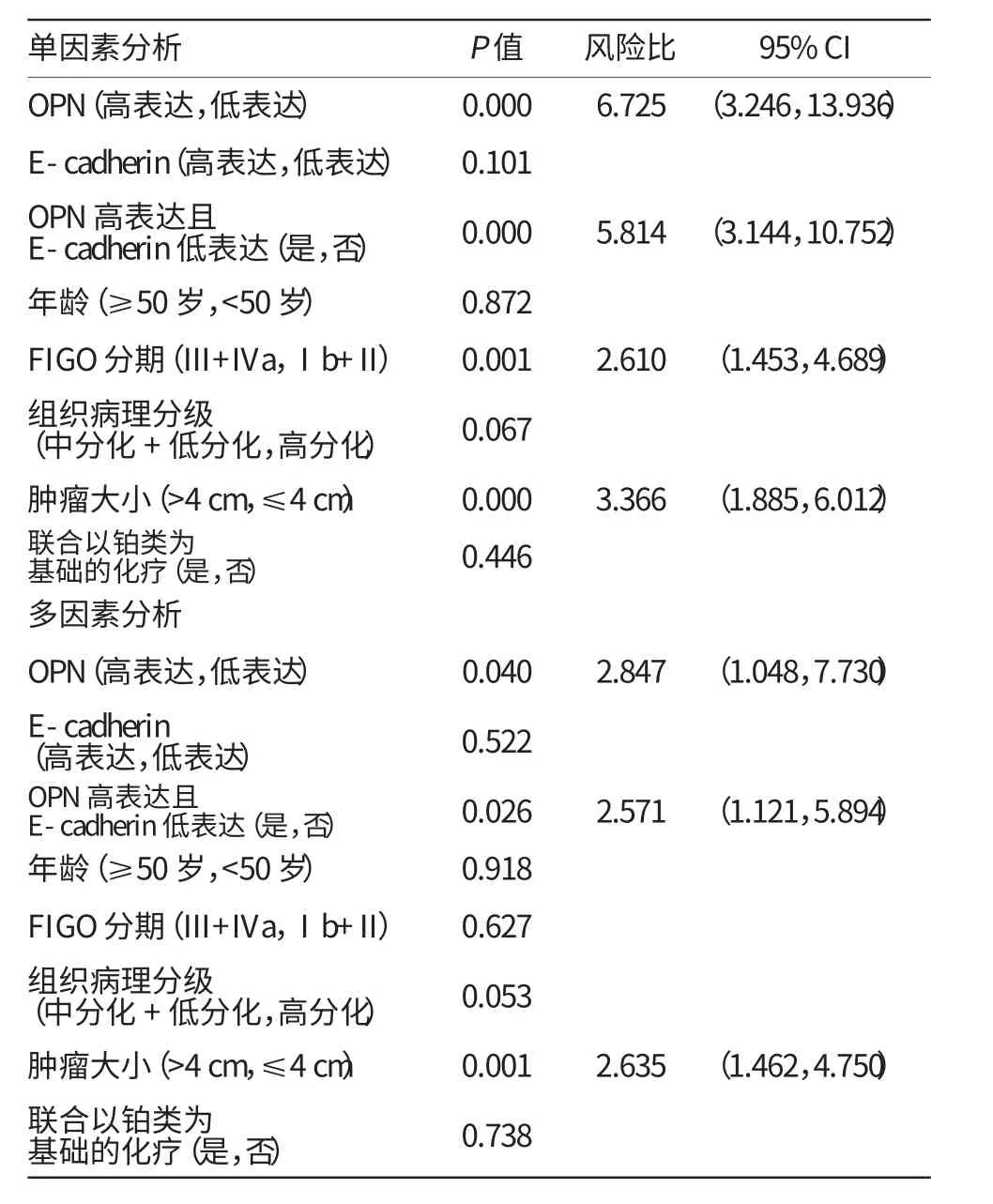
表5 宫颈癌无进展生存期的单因素COX回归分析
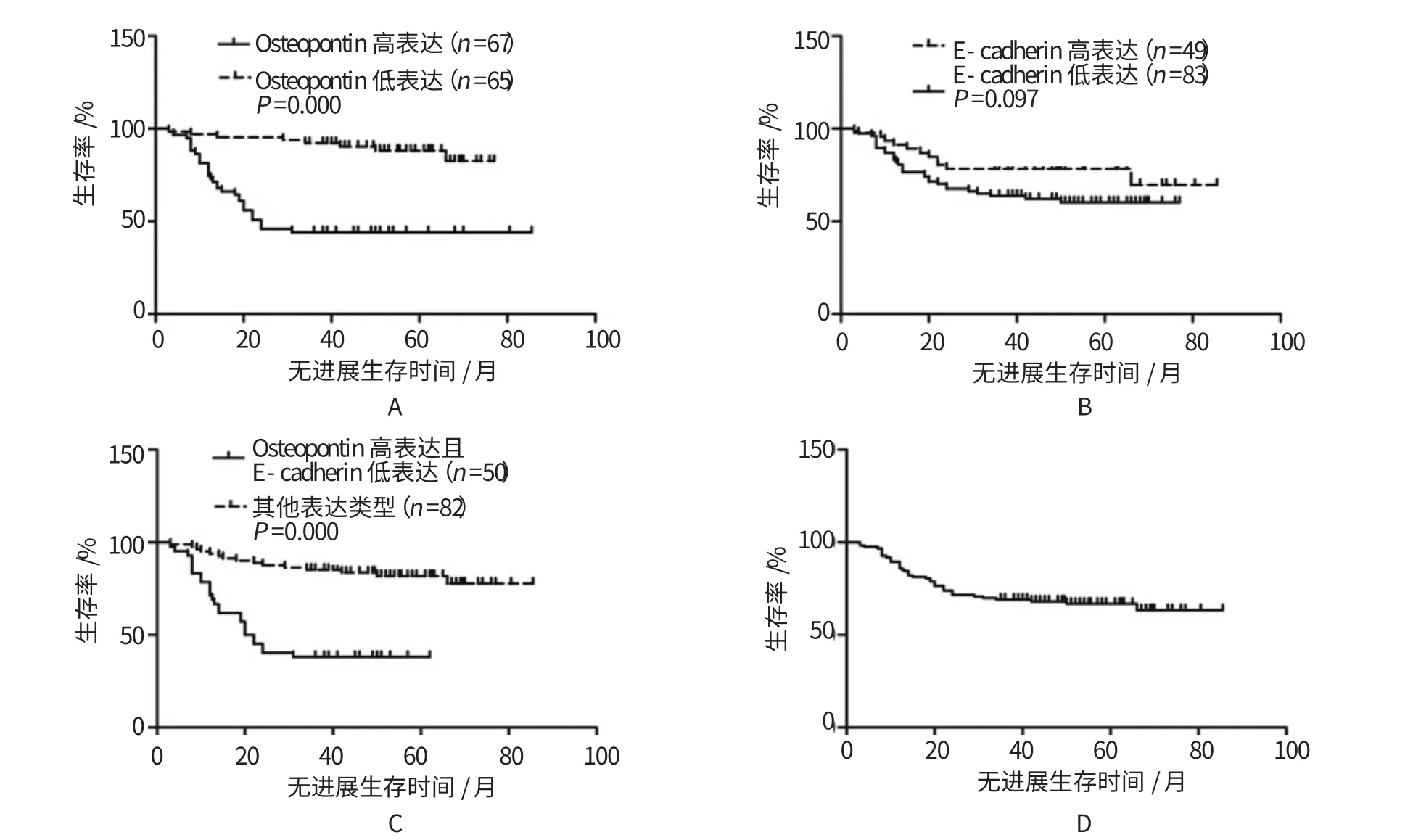
图2 LACSCC K-M生存曲线
3 讨论
本研究显示E-cadherin的表达与病理分级相关,而与本试验涉及的其他临床病理学因素(年龄、FIGO分期和肿瘤大小)不相关。在YONG等[7]的宫颈癌研究中,E-cadherin与病理分级、淋巴结转移相关和与临床分期不相关。同时,YONG等人的研究表明E-cadherin的低表达提示预后不良,但是,本数据显示,E-cadherin低表达和E-cadherin高表达两组间的5年无进展生存率并无差异,而且,E-cadherin不是宫颈鳞癌的预后因素。因此,笔者考虑E-cadherin是否在放疗抵抗中发挥作用,进而影响预后。
本研究首次做了E-cadherin表达与放疗抵抗相关性的研究,发现E-cadherin在放疗抵抗组和放疗敏感组的表达差异无统计学意义。但在3个放疗抵抗亚组中分析E-cadherin的表达情况时,发现远处转移亚组和放疗敏感组间E-cadherin的低表达率差异具有统计学意义。已有研究证实远处转移灶的形成不止与肿瘤细胞发生EMT增加流动性相关,更与其逆过程间质上皮转化(mesenchymal-epithelial transition,MET)过程相关[3]。因此,笔者推断,E-cadherin对放射治疗的影响主要是因为肿瘤细胞发生了EMT,发生了EMT的肿瘤细胞迁徙到其他组织,逃离辐射作用,再经过MET形成转移灶,造成最终的放疗抵抗。而放射治疗区域内的放疗失败,即放疗未控制和局部复发与肿瘤细胞E-cadherin表达无关。所以基于本试验,笔者认为抗肿瘤治疗前EMT的水平与放射治疗区域内发生的放疗抵抗不相关,而与放疗抵抗中远处转移亚组有关,即治疗前EMT高水平提示有更大的可能在放疗后3年内出现远处转移,表现为放疗抵抗。
本研究数据表明,Osteopontin的表达与FIGO分期及肿瘤大小相关,而与患者年龄和病理分级不相关。在胃癌[8]中的研究也显示Osteopontin表达与临床分期、淋巴结转移和远处转移相关。目前O steopontin在宫颈癌中的预后提示意义仍有争议。HAN[9]报道Osteopontin在宫颈癌中高表达与总生存(overall survival,OS;P=0.002)及无疾病生存(disease-free survival,DFS;P=0.033)负相关。JAE[10]的研究则认为Osteopontin在宫颈癌中的表达与生存不相关。本研究结果显示Osteopontin高表达患者的5年无进展生存率低于Osteopontin低表达患者。并且,Osteopontin高表达是LACSCC患者PFS的独立不良预后因子。此外,本研究显示Osteopontin表达与放疗反应呈负相关,且Osteopontin在3个放疗抵抗亚组分别与放疗敏感组间的表达差异均有统计学意义。说明治疗前组织Osteopontin高表达提示放疗抵抗。关于其具体的机制,目前尚不清楚。由于O steopontin被认为是组织乏氧的内源性标记物[11]及肿瘤放疗后再生的指标[12],笔者推测,宫颈癌组织高表达Osteopontin与放疗抵抗有关,部分原因是瘤体乏氧,进而影响放疗敏感性,以及放疗相关的肿瘤再生。
有研究表明Osteopontin在EMT的起始过程发挥作用[4],E-cadherin作为EMT发生的标志性表型变化因子,目前缺乏其与Osteopontin表达的关系及两者联合异常表达与放疗抵抗之间的关系的研究,本研究则填补了这个空白。第一,本研究数据中,O steopontin的表达与E-cadherin的表达并无相关性(r=-0.090,P=0.304);第二,笔者分析了Osteopontin与E-cadherin联合表达与放疗抵抗的关系,发现O steopontin高表达且E-cadherin低表达提示放疗抵抗,并且提示意义较单独Osteopontin高表达更显著。这提示联合检测肿瘤组织Osteopontin和E-cadherin的表达,有助于评估放疗敏感性;第三,高表达O steopontin且低表达E-cadherin的5年无进展生存率低于其他表型。
到目前为止,EMT与放疗抵抗之间的关系尚不明确。首先,有研究发现肿瘤细胞发生EMT后不仅表达间质表型特征获得流动性,还表达某些干细胞表型获得自我更新能力等干性[13]。因此,笔者认为,治疗失败与肿瘤组织中存在通过EMT获得干细胞表型的肿瘤细胞有关。其次,Slug、Snail等上皮间质转化相关转录因子(epithelial mesenchymal transition-Transcription factors,EMT-TFs)不仅使肿瘤细胞更具迁徙性和侵入性,还赋予肿瘤细胞辐射抵抗性。Slug突变或Slug敲除鼠表现出放疗敏感。因此,认为Slug可以诱导肿瘤细胞发生辐射抵抗[14-16]。研究表明Slug通过活化SCF/kit信号通路[14],调节DNA损伤修复[15],抑制辐射后凋亡[16],使细胞接受致死量辐射后仍可存活。最后,由于肿瘤细胞EMT过程是可逆性的[3],即发生了EMT的肿瘤细胞迁徙到远处器官或组织后,可以通过MET重获增殖能力,发展成为转移灶。因此,这种动态过程既增加了研究EMT与放疗抵抗相关性的困难,同时提示肿瘤细胞发生EMT的可逆性可能与放疗抵抗有关。
综上所述,本研究研究显示局部进展期宫颈鳞癌高表达Osteopontin、高表达Osteopontin且低表达E-cadherin提示放疗抵抗及预后不良,并且,高表达Osteopontin且低表达E-cadherin更具有统计学意义。EMT与肿瘤放疗抵抗的关系有待进一步的研究。
[1]FERLAY J,SHIN HR,BRAY F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J].Int J Cancer,2010,127(12):2893-2917.
[2]KIM DH,LEE JH,KI YK,et al.Short-course palliative radiotherapy for uterine cervical cancer[J].Radiat Oncol J,2013,31(4):216-221.
[3]ZEISBERG M,NEILSON EG.Biomarkers for epithelial-mesenchymal transitions[J].J Clin Invest,2009,119(6):1429-1437.
[4]MI Z,BHATTACHARYA SD,KIM VM,et al.Osteopontin promotes CCL5-mesenchymal stromal cell-mediated breast cancer metastasis[J].Carcinogenesis,2011,32(4):477-487.
[5]KIM TJ,LEE JW,SONG SY,et al.Increased expression of pAKT is associated with radiation resistance in cervical cancer[J].Br J Cancer,2006,94(11):1678-1682.
[6]XU L,JIANG Y,ZHENG J,et al.Aberrant expression of beta-catenin and E-cadherin is correlated with poor prognosis of nasopharyngeal cancer[J].Hum Pathol,2013,44(7):1357-1364.
[7]CHENG Y,ZHOU Y,JIANG W,et al.Significance of E-cadherin,beta-catenin,and vimentin expression as postoperative prognosis indicators in cervical squamous cell carcinoma[J].Hum Pathol,2012,43(8):1213-1220.
[8]TANG H,WANG J,BAI F,et al.Positive correlation of osteopontin,cyclooxygenase-2 and vascular endothelial growth factor in gastric cancer[J].Cancer Invest,2008,26(1):60-67.
[9]CHO H,HONG SW,OH YJ,et al.Clinical significance of osteopontin expression in cervical cancer[J].J Cancer Res Clin Oncol,2008,134(8):909-917.
[10]SONG JY,LEE JK,LEE NW,et al.Osteopontin expression correlates with invasiveness in cervical cancer[J].Aust N Z J Obstet Gynaecol,2009,49(4):434-438.
[11]BACHE M,REDDEMANN R,SAID HM,et al.Immunohistochemical detection of osteopontin in advanced head-and-neck cancer:prognostic role and correlation with oxygen electrode measurements,hypoxia-inducible-factor-1alpha-related markers,and hemoglobin levels[J].Int J Radiat Oncol Biol Phys,2006,66(5):1481-1487.
[12]SOLBERG TD,NEARMAN J,MULLINS J,et al.Correlation between tumor growth delay and expression of cancer and host VEGF,VEGFR2,and osteopontin in response to radiotherapy[J].Int J Radiat Oncol Biol Phys,2008,72(3):918-926.
[13]ARMSTRONG AJ,MARENGO MS,OLTEAN S,et al.Circulating tumor cells from patients with advanced prostate and breast cancer display both epithelial and mesenchymal markers[J].Mol Cancer Res,2011,9(8):997-1007.
[14]PEREZ-LOSADA J,SANCHEZ-MARTIN M,PEREZ-CARO M,et al.The radioresistance biological function of the SCF/kit signaling pathway is mediated by the zinc-finger transcription factor Slug[J].Oncogene,2003,22(27):4205-4211.
[15]PEREZ-CARO M, BERMEJO-RODRIGUEZ C, GONZALEZ-HERRERO I,et al.Transcriptomal profiling of the cellular response to DNA damage mediated by Slug (Snai2)[J].Br J Cancer,2008,98(2):480-488.
[16]INOUE A,SEIDEL M G,WU W,et al.Slug,a highly conserved zinc finger transcriptional repressor,protects hematopoietic progenitor cells from radiation-induced apoptosis in vivo[J].Cancer Cell,2002,2(4):279-288.

