INHA在多浪羊和卡拉库尔羊卵巢的定位
靳兴涛,王惠娥 ,缪增强,苏勇华
(塔里木大学 动物科学学院,新疆 阿拉尔843300)
卵泡发育是一个以形态变化为特征的动态生长过程,同时伴有卵泡功能的分化。原始卵泡经过发育和分化可形成优势卵泡,使卵子成熟并排出,也可中途闭锁[1]。抑制素是下丘脑 垂体 性腺轴调控系统的重要调节激素,对卵泡的正常生长、分化及闭锁起到刺激或抑制作用。抑制素对FSH 具有调节作用已经被许多研究所证实,但它作用机制目前尚有争议。
抑制素(Inhibin,INH) 是雄性动物的睾丸支持细胞C 和雌性动物的卵巢颗粒细胞所分泌的二聚体糖蛋白激素。抑制素基因由α 亚基和β 亚基通过二硫键连接而成,β 亚基包括βA 和βB 两种形式,α 亚基分别与这两种亚基结合形成INHA 和INHB[2,3]。研究发现,在动物胚胎期、新生动物卵巢及成年雌性动物卵巢中均可以检测到抑制素亚基基因的表达,但抑制素的不同亚基基因表达的具体时间和表达量在不同物种中存在着很大的差异[4]。Robertson DM[5]等认为,抑制素可以阻断促性腺激素释放激素(GnRH) 受体的合成,也可作为GnRH的阻滞剂,主要阻断了GnRH 受体后水平的信息传递,从而降低了细胞对GnRH 的反应性。而Bicsak[6]等认为,抑制素可直接通过调节腺苷酸环化酶的活性来影响垂体FSH 合成。许多试验证明,用不同类型的抑制素免疫原免疫动物,均可引起血FSH 水平增加,而对黄体化激素LH 没有直接作用,被免疫动物循环LH 水平无明显变化。但也有体外试验表明,猪抑制素制备物可加强绵羊垂体细胞GnRH 诱导的LH 释放,而抑制素对GnRH 诱发的鼠垂体细胞FSH 和LH 释放均表现为抑制作用。这说明抑制素对LH 的作用可能存在种间差异。
本研究拟针对上述实际存在的问题,对新疆多浪羊和卡拉库尔羊两个地方品种利用免疫组织化学法进行卵巢上INHA 的特异性免疫组织化学染色分析,希望从中发现它们的某些分布变化规律,从而为有针对性地建立不同地方绵羊品种的卵泡发育体系提供理论依据。
1 材料与方法
1.1 实验动物
在新疆喀什莎车县,选取健康、发育良好的未孕雌性多浪羊和卡拉库尔羊各10 只,2 ~3 岁。屠宰后取卵巢组织,置于4%甲醛固定液中。
1.2 主要试剂
兔抗INHA 抗体,抗兔SP 免疫试剂盒,DAB显色试剂盒均购自北京博奥森生物技术有限公司。国产分析纯有磷酸缓冲液(PBS) 、加拿大树脂、柠檬酸缓冲液自配。
1.3 切片标本制备
甲醛固定好的卵巢组织修正后梯度浓度酒精脱水,二甲苯透明,常规石蜡包埋,连续切片厚度6~8 μm。
1.4 INHA 免疫组织化学染色程序
参考王惠娥文献[7,8]。
1.5 图像分析
每样本分别选取5 张阳性切片,并随机观察每张片子的5 个视野,用image J 数码医学图像分析系统计数各级卵泡免疫组化阳性细胞率(阳性细胞面积/总细胞面积) 的均值。
1.6 数据统计
采用软件SPSS 12.0 进行数据处理,利用单因子方差分析进行结果的差异显著性检验并进行多重比较,数据相关分析均为平均数±标准误。
2 结果
2.1 显微镜下的染色结果
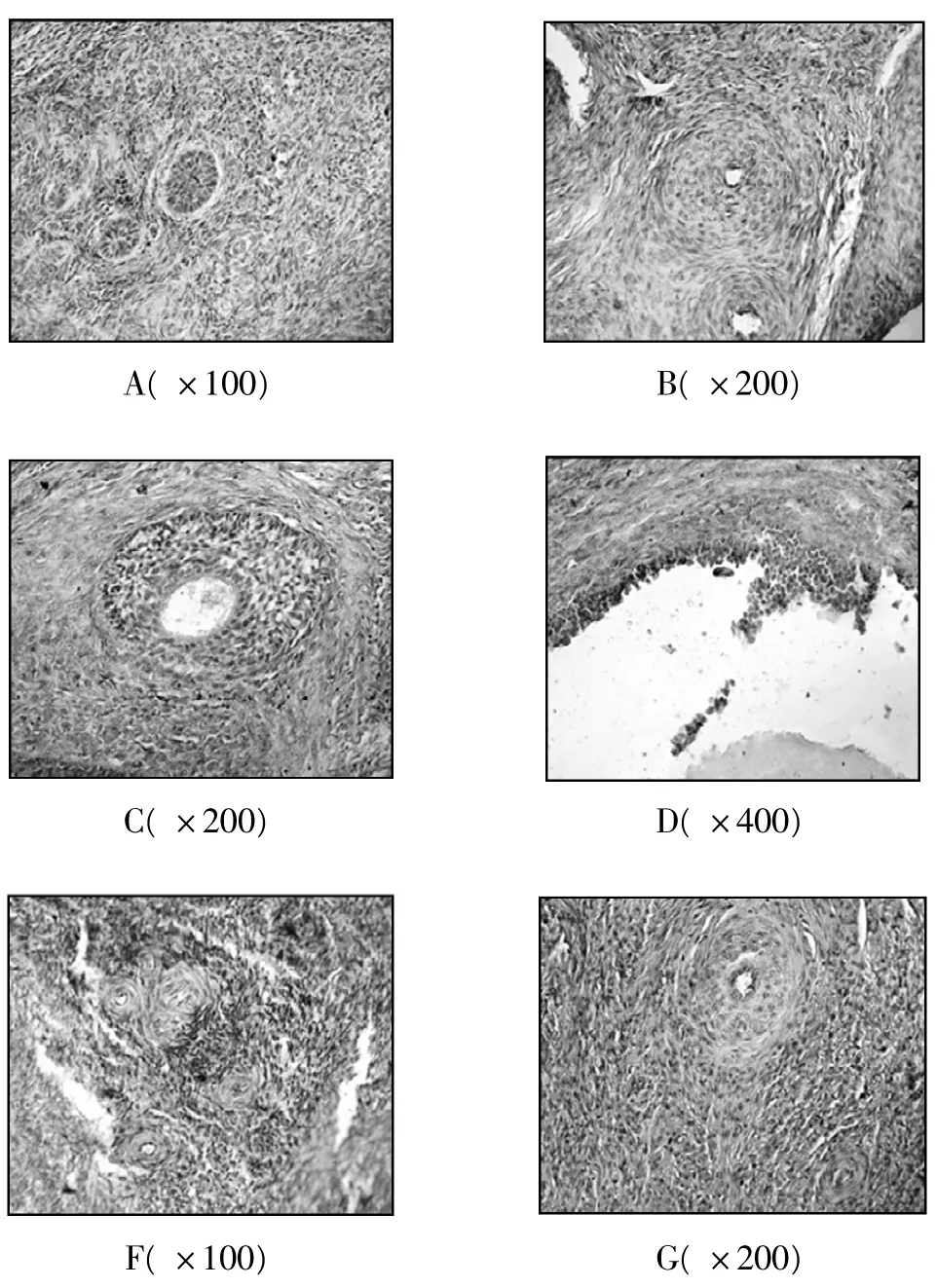
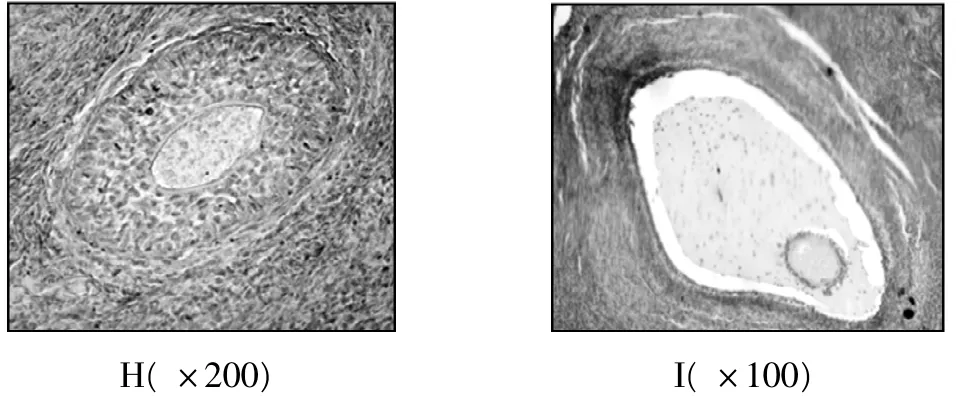
图1 抑制素A 在各级卵泡免疫组化定位
2.2 绵羊卵巢中抑制素的定位分布
由图1 可以看出,免疫组化染色阳性切片背景无色或淡蓝色,抑制素A 免疫反应细胞为黄色或棕黄色; 阳性细胞的胞质中着有黄色或棕黄色反应颗粒,苏木素染成细胞核为淡蓝色或蓝色。对照组切片染色阴性,背景无色或淡蓝色,无黄色或棕黄色染色,说明免疫组化SP 法分别具有抑制素A 免疫反应的特异性。
2.3 卵巢中抑制素免疫反应物质的分布和图像分析
光镜下观察抑制素A 阳性细胞主要分布在膜细胞和卵泡旁血管周围间质中。原始卵泡开始就有抑制素A 阳性物质,初级卵泡单层高柱状的颗粒细胞胞质中可见阳性反应。随着卵泡的发育,卵泡膜细胞分化出来后即呈现较高的染色强度,其与卵泡体积大小无关。初级卵泡和次级卵泡阳性细胞数量显著高于原始卵泡和成熟卵泡(P <0.05) 。

表1 卵泡抑制素A 阳性细胞图像分析
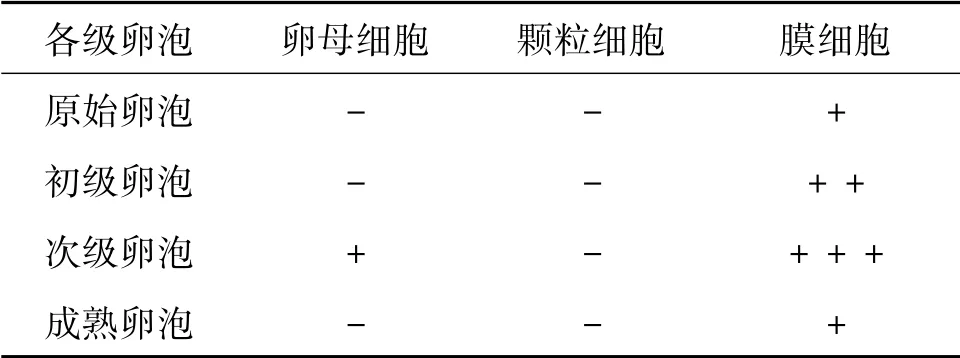
表2 各级卵泡抑制素A 阳性细胞染色强度
由表1 可见,卡拉库尔羊和多浪羊抑制素A阳性细胞在卵泡发育各阶段以及成熟卵泡的膜细胞和血管周围间质都有表达。初级卵泡和次级卵泡中除了膜细胞和血管周围间质表达抑制素A 阳性外,卵母细胞也有表达,且随着卵泡的增大,阳性细胞表达率呈先递增后递减趋势。卡拉库尔羊和多浪羊初级、次级卵泡抑制素A 阳性表达率显著高于原始卵泡和成熟卵泡(P <0.05) 。两品种间比较,多浪羊各级卵泡抑制素A 阳性细胞数均比卡拉库尔羊高,但差异不显著(P >0.05) 。
由表2 可见,随卵泡体积增大,阳性膜细胞数量增多,卵泡腔出现并逐渐增大至大腔阶段。膜细胞着色强度增强至腔前卵泡随后减弱,卵母细胞和颗粒细胞着色强度变化不明显,细胞间质可见阳性染色强度。
3 讨论
3.1 抑制素在绵羊卵巢中的定位研究
目前国内外有关绵羊抑制素的研究,主要侧重编码其各自相应蛋白产物的基因在转录水平的调节变化,而利用免疫组化技术检测其各自相应蛋白产物表达变化的报道相对较少。本实验结果证明抑制素阳性物质主要分布于卵泡膜细胞和细胞间质,而颗粒细胞、卵母细胞中分布较少或没有分布。
3.2 抑制素基因在两个绵羊品种间卵巢中相对表达量
抑制素会对卵泡发育、分化和成熟及排卵的过程起作用。卵泡发育是一个以形态变化为特征的生长过程,同时伴随着卵泡功能的分化,原始卵泡经过发育和分化后,可形成优势卵泡,使卵子成熟和排出,也可中途闭锁。抑制素可通过自分泌及旁分泌对卵泡的正常生长分化及闭锁起到刺激或抑制卵泡优势化过程中,抑制素数量逐渐增高。研究表明,在成年动物,抑制素水平在动情周期的颗粒细胞和卵泡膜细胞中变化最为明显,这说明优势卵泡的选择与抑制素表达有很大关系。Abdennebi[5]等通过对多胎的罗曼诺夫绵羊和单胎的法兰西岛绵羊研究发现,在小的有腔卵泡中,抑制素在颗粒细胞中有清晰的表达,但在卵细胞中,仅检测到低水平的抑制素,在大的有腔卵泡中,抑制素水平在内膜细胞和颗粒细胞中均有高度的表达。
由表1 和图1 可以看出,多浪羊和卡拉库尔羊初级卵泡和次级卵泡抑制素阳性表达率显著高于(P <0.05) 原始卵泡和成熟卵泡。随着卵泡发育,抑制素阳性细胞率呈递增趋势,直至腔前卵泡达到最高峰,随之卵泡成熟而下降。各级卵泡抑制素的表达量多浪羊均比卡拉库尔羊表达量高,但差异不显著(P >0.05) 。该结果与Abdennebi[5]等的结果相一致。他们通过对高产的ROM 羊和低产IF 羊的研究也发现,在大的成熟卵泡的颗粒细胞中,仅检测到低水平的抑制素,在小的有腔卵泡中,抑制素水平在颗粒细胞中有高度的表达。金萱[9]等研究发现,出生后5 d 的大鼠所分化的颗粒细胞中开始INHA 亚基基因表达,随后逐渐增加至窦状卵泡期达到高峰,健康的卵泡颗粒细胞中INHA 的活性强而卵母细胞中tPA 活性弱; 闭锁卵泡卵母细胞中tPA 活性高,其颗粒细胞表达的INHA 的mRNA 活性较弱,说明颗粒细胞表达的抑制素A 与卵母细胞tPA 活性存在密切关系。说明在卵泡优势化过程中,抑制素起着非常重要的作用。抑制素作用于除了优势卵泡以外的其他卵泡,抑制其发育成熟,使其闭锁,从而使优势卵泡能够发育成熟并排卵。
4 结论
多浪羊与卡拉库尔羊的抑制素阳性物质主要见于膜细胞和细胞间质。多浪羊与卡拉库尔羊在其初级卵泡和次级卵泡中抑制素的表达阳性率都显著高于其原始卵泡和成熟卵泡(P <0.05) 。且随着卵泡的不断增大,抑制素水平在腔前卵泡之前达到高峰,随后下降。因此,这可能与卵泡优势化有关,进而与多胎性有关。
[1]郭淑华.相关分子在哺乳动物原始卵泡启动和生长中的作用[J].潍坊学院学报.2010,(06).
[2]Robertson DM.Foulds LM.Leversha L.et al.ISolation of inhibin from bovine follicular fluid [J].Bioeheln.BioPhys.Res.Commun.,1985,126: 220-226.
[3]Campbell B K,Baird D T.Inhibin A is a follicle stimulating hormone responsive marker of granulosa cell differentiation,which has both autocrine and paracrine actions in sheep[J].J Endocrinol,2001,169: 333-345.
[4]赵中权.抑制素对山羊繁殖力的影响[M].特种经济动物饲养.2011.
[5]Abdennebi,Wigglesworth K,Pendola F,et al.Murine oocytes suppress expression of luteinizing hormone receptor messenger ribonucleic acid by granulosa cells[J].Biol Reprod,1997,56: 976-984.
[6]Bicsak T A,Vale W,VaughanJ,et a1.Hormonal regulation of inhibin production by cultured sertoli cells[J].Mol Cell E.ndocrinol,1987,49: 211-7.
[7]王惠娥,汪澜,尼亚孜布.卡拉库尔羊卵巢中促性腺激素受体蛋白的分布[J].畜牧与兽医.2013.(09).
[8]王惠娥,汪澜,盛伟明.免疫组化法检测促黄体素受体在多浪羊和卡拉库尔羊卵巢上的分布[J].中国畜牧兽医.2013.(03).
[9]金萱,刘以训.卵泡生长、分化和闭锁的调控[J].科学通报.2003.(14).

