CSFV及美洲型、欧洲型PRRSV多重qRT-PCR鉴别检测方法的建立及应用*
施开创,邹联斌,胡 杰,张步娴,莫胜兰,官家明,陈汉忠*
(1. 广西动物疫病预防控制中心,广西 南宁 530001;2. 广西大学 动物科学技术学院,广西 南宁 530005)
CSFV及美洲型、欧洲型PRRSV多重qRT-PCR鉴别检测方法的建立及应用*
施开创1,邹联斌1,胡 杰1,张步娴1,莫胜兰1,官家明2,陈汉忠2*
(1. 广西动物疫病预防控制中心,广西 南宁 530001;2. 广西大学 动物科学技术学院,广西 南宁 530005)
根据猪瘟病毒(CSFV)以及猪繁殖与呼吸综合征病毒(PRRSV)基因组序列特点,设计 3 对特异性引物和 3 条TaqMan 探针,经过反应条件的优化,建立了能同时检测并区分CSFV以及美洲型、欧洲型PRRSV的多重TaqMan荧光定量RT-PCR(qRT-PCR)方法。该方法具有特异性强、敏感性高、重复性好的特点,可以特异扩增CSFV和PRRSV,而与猪的其它常见病毒无交叉反应;对CSFV及美洲型、欧洲型PRRSV3种重组质粒标准品的检出下限均为2.68拷贝/μL;组内及组间重复试验的变异系数均小于1.5 %。应用该方法对253份临床疑似样品进行检测,结果病原阳性106份,其中20 份为CSFV阳性,86 份为美洲型PRRSV阳性,11 份为CSFV和美洲型PRRSV混合感染,未检测到欧洲型PRRSV。试验表明,研究建立的多重qRT-PCR方法可用于CSFV和PRRSV的快速鉴别检测及流行病学调查。
猪瘟病毒;猪繁殖与呼吸综合征病毒;多重TaqMan荧光定量RT-PCR
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome, PRRS)是由PRRS病毒(PRRSV)引起以妊娠母猪流产、早产、产死胎、木乃伊胎等繁殖障碍,以及各种年龄猪特别是仔猪严重呼吸道疾病为特征的一种高度接触性传染病。PRRSV可分为两种基因型,即以LV株为代表的欧洲型和以VR-2332株为代表的美洲型,两者之间基因组核苷酸序列的同源性约为60 %[1]。我国于1996年首次分离到美洲型PRRSV(NA-PRRSV)经典株[2],于2006年分离到以Nsp2蛋白第481位aa和第533~561位aa出现30个aa不连续缺失为遗传特征的NA-PRRSV高致病性变异株(HP-PRRSV)[3],于2011年报道致病性欧洲型PRRSV(EU-PRRSV)[4]。猪瘟(Classical swine fever,CSF)是由CSF病毒(CSFV)引起猪以高热稽留、出血、坏死和高死亡率为主要特征的一种高度接触性传染病。我国长期坚持使用猪瘟兔化弱毒疫苗免疫预防猪瘟,取得显著成效,但迄今未能根除猪瘟。CSF和PRRS在我国时有发生,并且存在病原隐性感染和持续性感染的现象[5-6],同时CSFV和PRRSV的继发感染和混合感染严重[7],给养猪业造成严重危害。本研究针对CSFV和PRRSV基因组序列特点,设计3对特异性引物和3条TaqMan探针,建立了能同时检测并区分CSFV及美洲型、欧洲型PRRSV的多重TaqMan荧光定量RT-PCR(qRT-PCR)方法,为CSFV和PRRSV的快速鉴别检测提供了有效的技术手段。
1 材料与方法
1.1 病毒株
猪瘟病毒(CSFV)疫苗毒C株、PRRSV美洲型经典毒株VR-2332株、变异毒株JXA1株及欧洲型疫苗毒DV株、猪伪狂犬病毒(PRV)疫苗毒Bartha-K61株、猪细小病毒(PPV)疫苗毒N株、猪口蹄疫病毒(FMDV)疫苗毒O/MYA98/BY/2010株、猪圆环病毒2型(PCV2)疫苗毒LG株由本实验室保存。
1.2 主要试剂
Premix Ex TaqTM (Perfect Real Time)试剂盒、RNA PCR Kit (AMV) Ver.3.0试剂盒、MiniBEST Viral RNA/DNA Extraction Kit Ver.4.0试剂盒、Agarose Gel DNA Purification Kit Ver.2.0试剂盒、pMD18-T载体、DH5α感受态细胞、Hind Ⅲ和EcoRⅠ限制酶、质粒提取试剂盒均购自宝生物工程(大连)有限公司。
1.3 引物和探针的设计与合成
参考GenBank中登录的CSFV石门株(AY775178)及PRRSV VR-2332株(U87392)、LV株(M96262)的基因组序列,利用Primer Express 3.0 软件包设计特异性引物和TaqMan 探针(见表1)。引物和探针由宝生物工程(大连)有限公司合成。
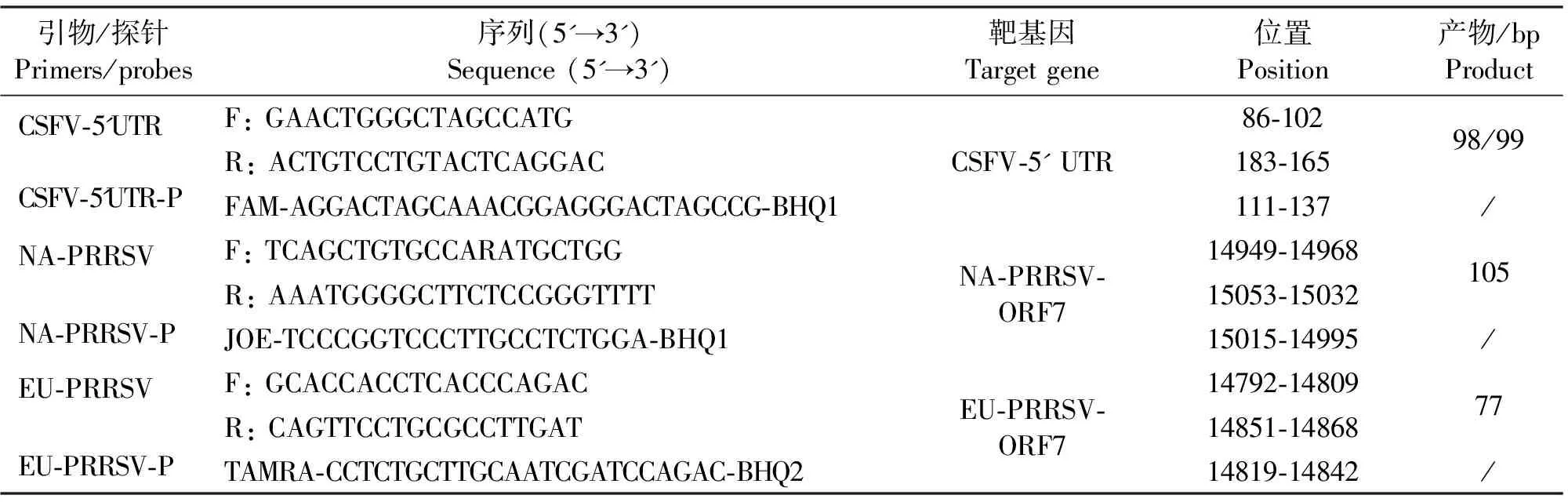
表1 引物及探针序列
注:CSFV-5'UTR-F/R引物对扩增CSFV强毒株目的片段长度为98 bp、弱毒疫苗株目的片段长度为99 bp。
Notes: The primer CSFV-5'UTR-F/R was used to amplify 98 bp from wild-type and 99 bp from C-strain CSFV.
1.4 核酸抽提及反转录
取病毒液或待检临床样品,按MiniBEST Viral RNA/DNA Extraction Kit Ver.4.0试剂盒使用说明,抽提总DNA/RNA。提取的总RNA,按RNA PCR Kit (AMV) Ver.3.0试剂盒使用说明进行反转录,获得cDNA。-20 ℃保存备用。
1.5 病毒重组质粒标准品制备
以CSFV C株及PRRSV VR-2332株、DV株的cDNA为模版,分别进行PCR扩增得到99 bp、105 bp、77 bp目的片段。回收PCR产物,连接pMD18-T载体、转化DH5α感受态细胞,阳性克隆进行PCR、酶切、测序鉴定。构建的重组质粒标准品分别命名为 p-C-5'UTR、p-N-ORF7和p-E-ORF7。用紫外分光光度计测定质粒的光吸收值(OD260 nm),计算出摩尔浓度,根据公式换算成拷贝数:每μL样品中检测基因的拷贝数=浓度(ng/μL)×阿佛加德罗常数×10-9/(660×重组质粒碱基数)。-20 ℃保存,用前稀释。
1.6 多重qRT-PCR反应条件的优化
建立25 μLPCR反应体系,分别对退火温度(52℃~62℃)以及模板(将初始浓度为1.59×1010拷贝/μL的p-C-5'UTR、1.89×1010拷贝/μL的p-N-ORF7、3.11×1010拷贝/μL的p-E-ORF7三种重组质粒按不同比例混合形成不同的浓度组合)、引物(将3对引物稀释成终浓度分别为0.3、0.4、0.6、0.8、1.0、1.2 pmol/μL,进行不同浓度的组合)、探针(将3条探针稀释成终浓度分别为0.20、0.40、0.55、0.70、0.85、1.00、1.20 pmol/μL,进行不同浓度的组合)、参比染料(分别加入0.2、0.3、0.4、0.5 μL的50× Rox参比染料)的浓度进行优化,获得多重qRT-PCR的最佳反应条件。
1.7 多重qRT-PCR标准曲线的制作
分别将三种质粒标准品10倍系列稀释,将同一浓度梯度按优化好的比例混合,使25 μL反应体系中p-C-5'UTR、p-N-ORF7、p-E-ORF7三种质粒的终浓度均为2.68×108~2.68×102拷贝/μL。根据优化的反应条件,在ABI Step one plus型PCR仪上扩增,反应结束后计算机软件自动生成标准曲线。
1.8 特异性试验
以 CSFV C 株、PRRSV VR-2332株、JXA1株、DV株以及FMDV、PRV、PPV、PCV2的cDNA或DNA为模板,进行多重qRT-PCR,鉴定其特异性。
1.9 敏感性试验
将3种质粒标准品按比例混合,使25 μL反应体系中每种质粒的终浓度均为2.68×106~2.68×100拷贝/μL,进行多重qRT-PCR,确定其检出下限。
1.10 重复性试验
将3种质粒标准品p-C-5'UTR、p-N-ORF7和p-E-ORF7按比例混合后,取3个浓度梯度(均为2.68×108、2.68×106、2.68×104挎贝/μL),进行组内及组间重复性试验,鉴定其稳定性。
1.11 多重qRT-PCR的应用
应用建立的多重qRT-PCR,对2011~2013年广西各地送检的疑似临床样品进行检测,以评价本方法的实用性。同时应用本实验室建立的检测CSFV及美洲型、欧洲型PRRSV的多重 RT-PCR方法[8]对上述样品进行检测,分析两种方法检测结果的符合率。
2 结果与分析
2.1 重组质粒标准品的制备
以CSFV C株、PRRSV美洲型VR-2332株、欧洲型DV株的cDNA为模版进行PCR,得到与预期目的片段大小一致的扩增产物。PCR产物经纯化、连接、转化,阳性克隆经鉴定,成功构建了重组质粒标准品,分别命名为 p-C-5'UTR、p-N-ORF7、p-E-ORF7(见图1)。
2.2 多重qRT-PCR最佳反应条件的确定
经过对退火温度及模板、引物、探针、ROX参比染料的浓度进行优化后,确定多重qRT-PCR 25 μL反应体系为:Premix Ex TaqTM 12.5 μL,CSFV-5'UTR-F(25 pmol/μL)、CSFV-5'UTR-R(25 pmol/μL)各0.3 μL、CSFV-5'UTR-PRRSV-P(25 pmol/μL)0.1 μL,NA-PRRSV-F(25 pmol/μL)、NA-PRRSV-R(25 pmol/μL)各0.35 μL、NA-PRRSV-P(25 pmol/μL)0.1 μL,EU-PRRSV-F(25 pmol/μL)、EU-PRRSV-R(25 pmol/μL)各1.2 μL、 EU-PRRSV-P(25 pmol/μL)1.2 μL,ROX 参比染料 0.5μL,模板(p-C-5'UTR、p-N-ORF7和 p-E-ORF7 按1:1:1比例混合)2 μL,用灭菌双蒸水补至 25 μL。最佳反应条件:95℃ 20 s;95℃ 1 s,56℃ 20 s,40个循环。
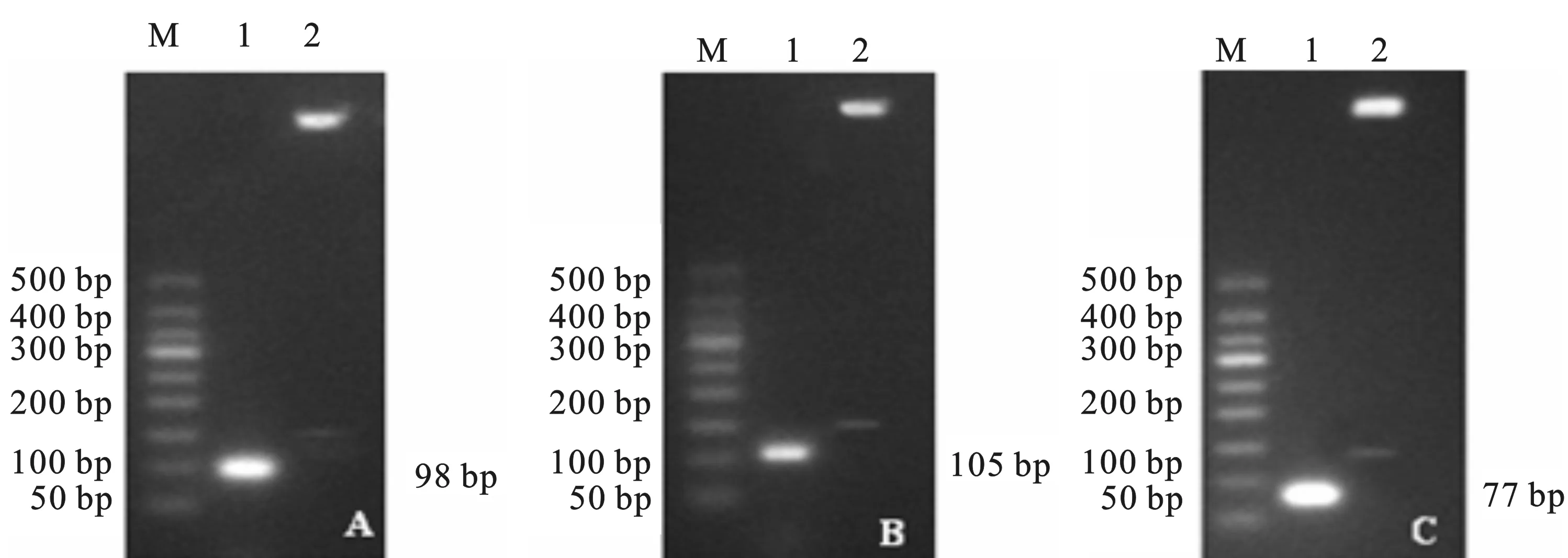
图1 重组质粒 p-C-5'UTR (A)、p-N-ORF7 (B) 和 p-E-ORF7(C) 的鉴定
2.3 多重qRT-PCR标准曲线的绘制
按优化好的比例混合质粒标准品,10倍系列稀释成不同浓度(在25 μL反应体系中p-C-5'UTR、p-N-ORF7和p-E-ORF7均为2.68×108~2.68×102拷贝/μL),按照优化的反应条件进行多重qRT-PCR,得到扩增曲线(见图2)和标准曲线(见图3),标准曲线的相关系数 r2均达到1.000,表明起始模板浓度与 Ct 值呈现良好的线性关系。
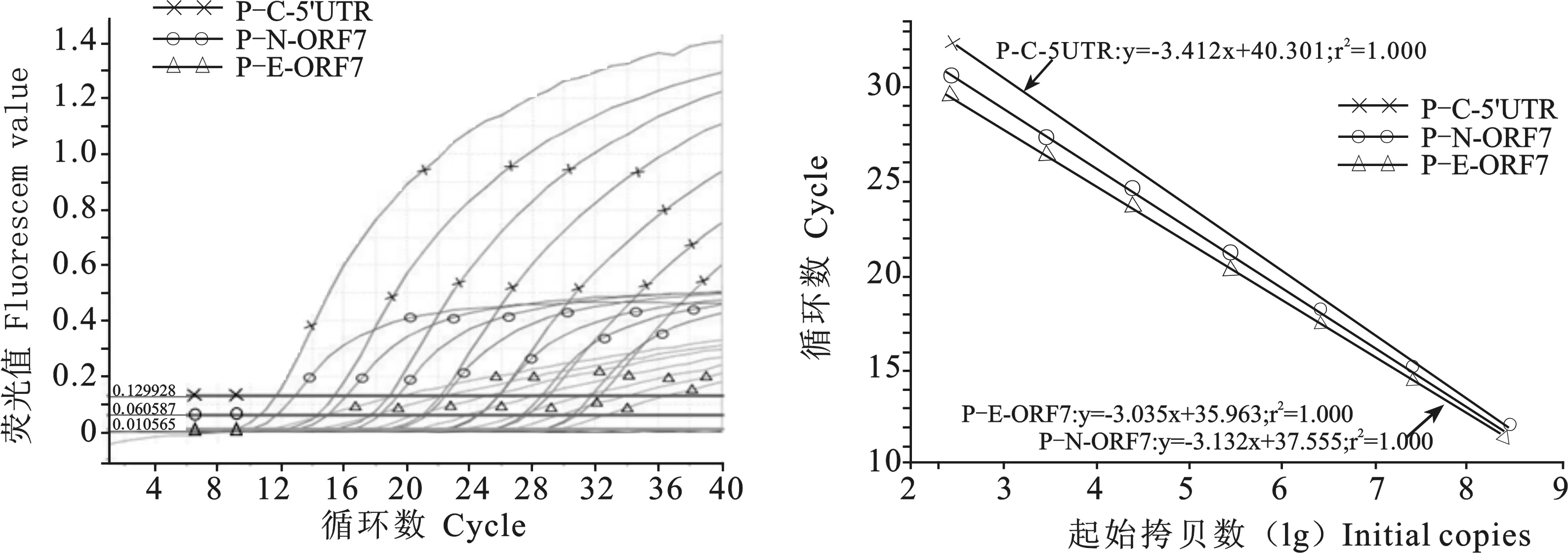
图2 多重qRT-PCR的扩增曲线 图3 多重qRT-PCR的标准曲线
Fig.2 Dynamic curves of the multiplex quantitative TaqMan Fig.3 Standard curves of the multiplex qRT-PCR real-time RT-PCR (qRT-PCR)
2.4 特异性分析
在多重qRT-PCR 体系中,当只加入CSFV及美洲型、欧洲型PRRSV中某种病毒的cDNA作为模板时则仅能得到相应病毒的特异性扩增曲线,当以CSFV及美洲型、欧洲型PRRSV混合cDNA为模板时则能得到三种病毒的扩增曲线,而与其他猪源病毒(FMDV、PRV、PPV、PCV2)均无交叉反应(见图4),表明具有很强的特异性。
2.5 敏感性分析
以三种质粒标准品混合物为模板,进行多重qRT-PCR时,p-C-5'UTR、p-N-ORF7和p-E-ORF7的检出下限均为2.68 拷贝/μL(见图5)。
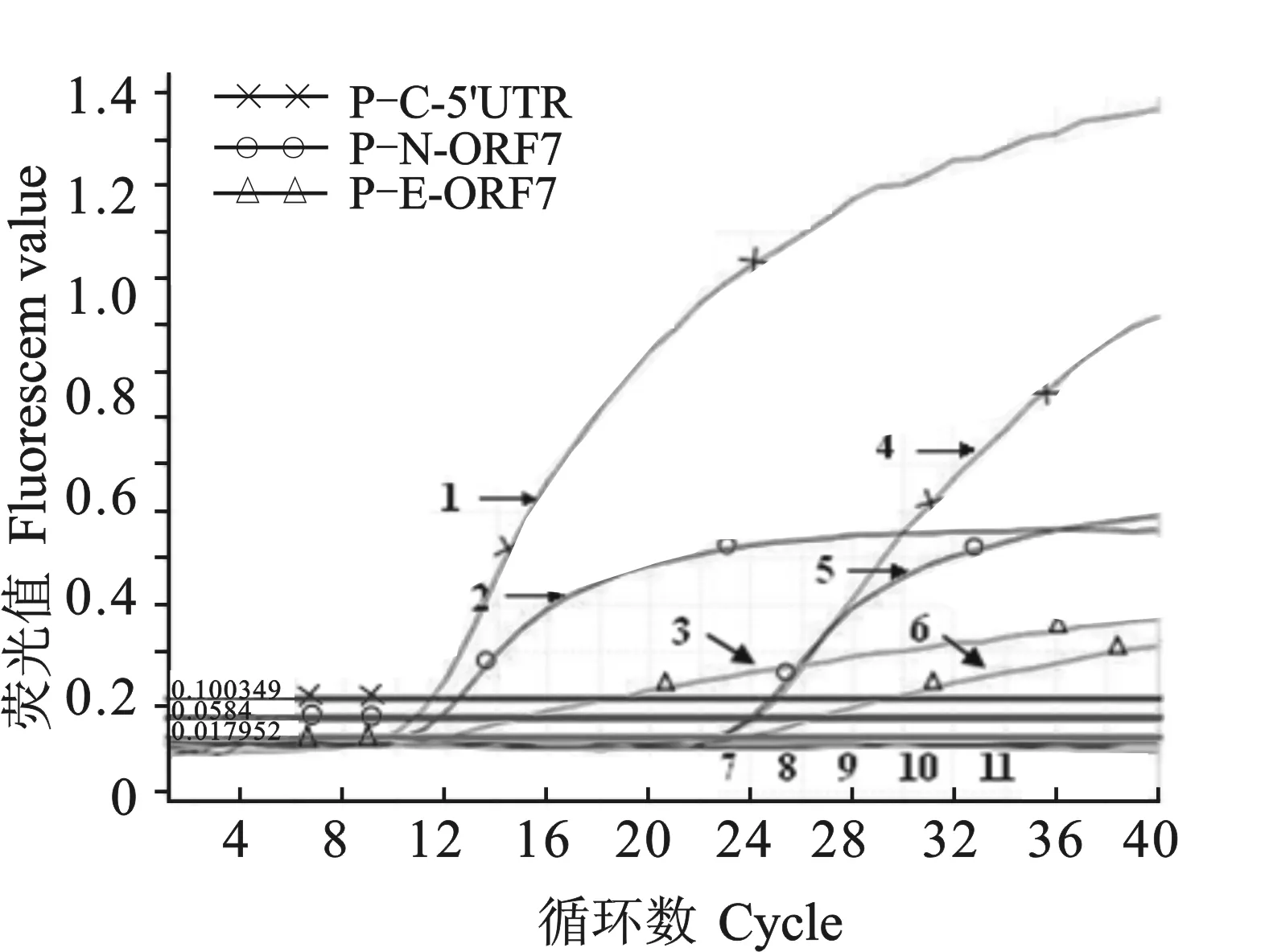
图4 多重qRT-PCR特异性试验的扩增曲线
1. p-C-5'UTR; 2. p-N-ORF7; 3. p-E-ORF7; 4.CSFV; 5.VR-2332; 6. DV; 7.distilled water; 8.FMDV; 9.PRV; 10.PPV; 11. PCV2
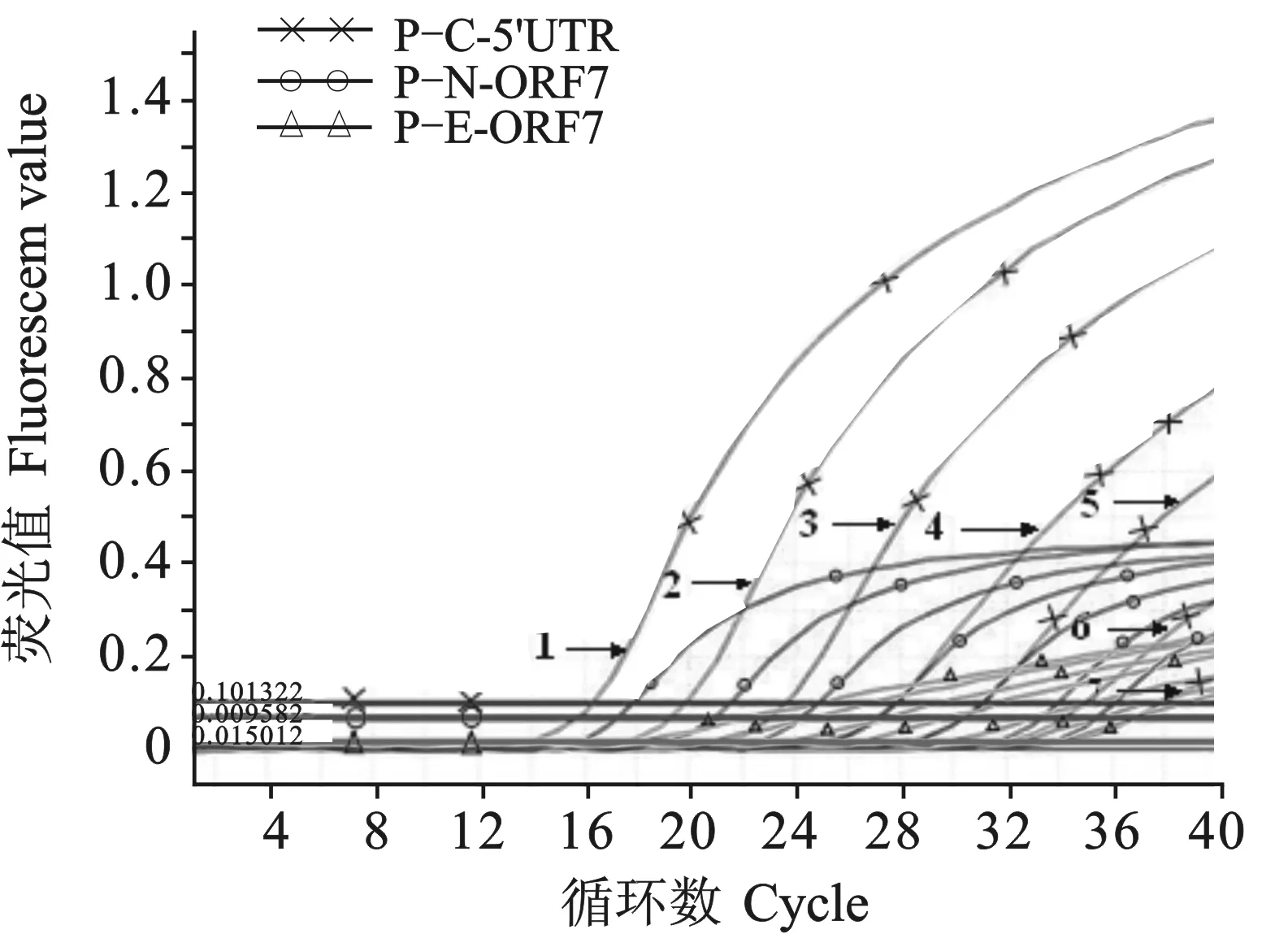
图5 多重qRT-PCR敏感性试验的扩增曲线
图中,仅标示p-C-5'UTR 质粒不同浓度的扩增曲线
Notes:Only the dynamic curves of plasmid p-C-5'UTR were marked with their corresponding concentration1: 2.68×106copies/μL; 2: 2.68×105copies/μL; 3: 2.68×104copies/μL; 4: 2.68×103copies/μL; 5: 2.68×102copies/μL; 6: 2.68×101copies/μL; 7: 2.68×100copies/μL
2.6 重复性分析
对三种质粒标准品混合物的3个浓度梯度进行重复性试验,结果,不同浓度的Ct 值其组内及组间变异系数均小于1.5 %(见表2),表明该方法具有良好的重复性。
2.7 多重qRT-PCR的应用
利用建立的多重qRT-PCR对253份临床样品进行检测,结果病原阳性106份,其中NA-PRRSV阳性86份,检出率为33.99%;CSFV阳性20份,检出率为7.91%;CSFV和NA-PRRSV混合感染11份,占4.35%;未检测EU-PRRSV。部分样品的检测结果见图6。同时,应用普通多重RT-PCR方法对上述临床样品进行检测,结果病原阳性86份,其中NA-PRRSV阳性71份,检出率为 28.06%;CSFV阳性15份,检出率为5.93%;CSFV和NA-PRRSV混合感染8份,占3.16%;未检测到EU-PRRSV。多重qRT-PCR与普通多重RT-PCR检测结果的符合率为92.09%,前者比后者的检出率高。
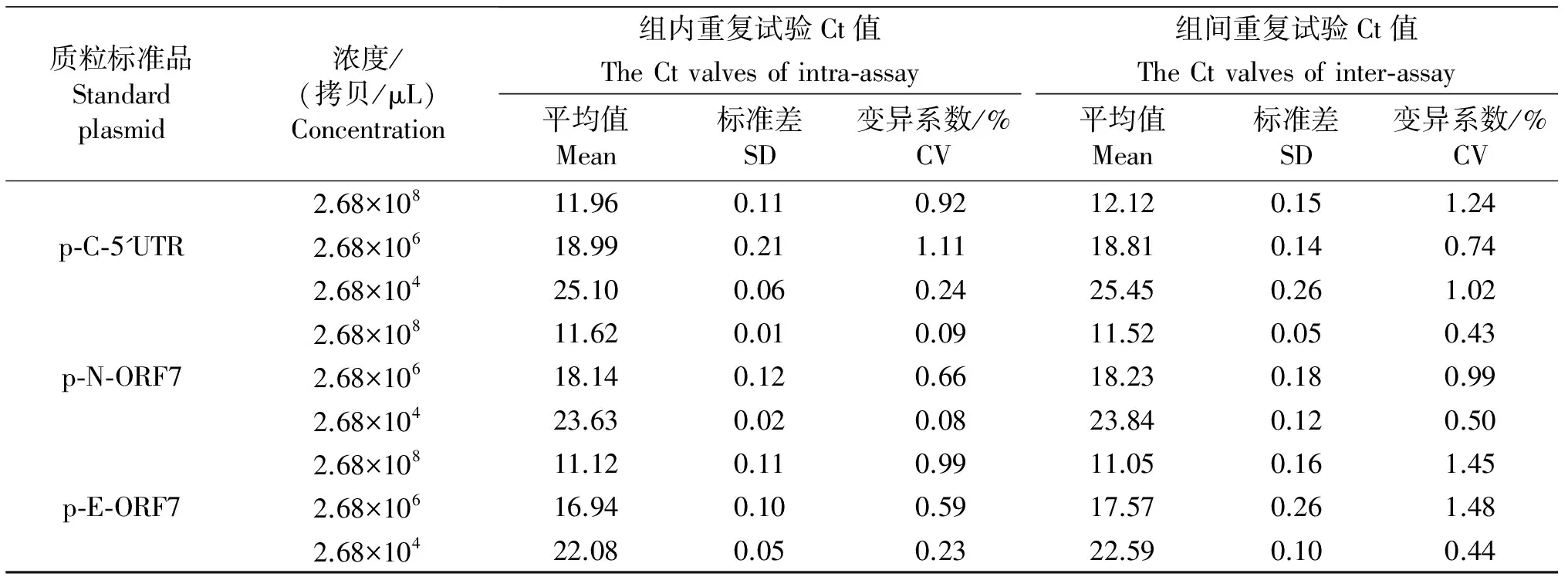
表2 多重 qRT-PCR的重复性分析
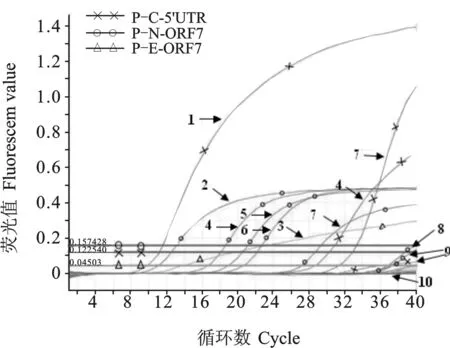
图6 多重qRT-PCR对部分临床样品的检测结果
注:6份临床样品中,4、5、6、7号样品为NA-PRRSV阳性,4和7号样品为CSFV阳性。1 p-C-5'UTR; 2 p-N-ORF7; 3 p-E-ORF7; 4-9 临床样品; 10 distilled water
Notes: Of the 6 clinical samples, No. 4, 5, 6 and 7 were positive for NA-PRRSV, while No. 4 and 7 were positive for CSFV。1 p-C-5'UTR; 2 p-N-ORF7; 3 p-E-ORF7; 4-9 Clinical samples; 10 distilled water
3 讨 论
当前,NA-PRRSV经典毒株、变异毒株以及EU-PRRSV在我国均有流行,HP-PRRSV成为优势毒株[9],PRRSV流行毒株在临床上日益复杂。CSFV的致病与流行呈现非典型化,主要表现为隐性带毒和慢性感染,但典型猪瘟仍时有发生[10]。PRRSV和CSFV 已成为严重危害我国养猪业的两种病原,并且继发感染、混合感染屡见不鲜[7]。因此建立能同时检测并区分CSFV以及PRRSV的鉴别检测方法,对快速诊断CSF和PRRS具有重大意义。虽然有学者建立了可同时检测CSFV和NA-PRRSV的多重RT-PCR[11-12]及多重qRT-PCR的方法[13-14],但迄今未见报道能够同时检测并区分CSFV以及NA-PRRSV、EU-PRRSV的多重qRT-PCR方法。本研究根据CSFV基因组5' UTR的序列特点以及NA-PRRSV、EU-PRRSV在ORF7基因的序列差异[1],设计了3对特异性引物和3条TaqMan探针,利用位于CSFV 5' UTR高度保守区域的1对引物和1条探针来扩增并区分CSFV,利用位于PRRSV ORF7基因的2对引物和2条探针来扩增并区分NA-PRRSV、EU-PRRSV,实现了在同一个扩增反应中鉴别3种不同病毒即CSFV、NA-PRRSV、EU-PRRSV。经过反应条件的优化,成功建立了特异性强、敏感性高、重复性好的CSFV及美洲型、欧洲型PRRSV的多重qRT-PCR鉴别检测方法,并应用于临床样品的检测,证实了其可靠性和适用性。
利用建立的多重qRT-PCR方法对253份临床样品进行检测,结果NA-PRRSV检出率为33.99 %,CSFV检出率为7.91 %,CSFV和NA-PRRSV混合感染占4.35 %,未检测到EU-PRRSV。表明,NA-PRRSV仍是当前的优势流行毒株,是当前防控的重点。发病猪群存在CSFV和PRRSV的混合感染和继发感染,应予高度重视。本研究虽未从广西临床样品中检测到EU-PRRSV,但由于该毒株已在我国存在和流行[4, 15],因此广西猪群依然面临来自EU-PRRSV的巨大威胁,应加强对EU-PRRSV的监测。
4 结 论
综上所述,本研究建立的多重qRT-PCR能够同时检测并区分CSFV、NA-PRRSV、EU-PRRSV,且具有特异性强、敏感性高、重复性好的特点,可用于CSFV及PRRSV的快速鉴别检测及流行病学调查。
[1] Nelsen C J, Murtaugh M P, Faaberg K S. Porcine reproductive and respiratory syndrome virus comparison: divergent evolution on two continents[J].Journal of Virology,1999,73(1):270-280.
[2] 郭宝清,陈章水,刘文兴,等.从疑似PRRS流产胎儿分离PRRSV的研究[J].中国预防兽医学报,1996,87(2):1-4.
[3] Tian K, Yu X, Zhao T, et al. Emergence of fatal PRRSV variants: unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J].PloS One,2007, (6): e526.
[4] Chen N, Cao Z, Yu X, et al. Emergence of novel European genotype porcine reproductive and respiratory syndrome virus in mainland China[J].Journal of General Virology,2011,92(4):880-892.
[5] Wills R W, Doster A R, Galeota J A, et al. Duration of infection and proportion of pigs persistently infected with porcine reproductive and respiratory syndrome virus[J].Journal of Clinical Microbiology,2003,41(1):58-62.
[6] 姚文生,范学政,王 琴,等.我国猪瘟流行现状与防控措施建议[J].中国兽药杂志,2011, 45(9):44-47.
[7] 王连想,马静云,谢青梅,等.猪繁殖与呼吸综合征病毒变异株与猪瘟病毒等混合感染的调查与分析[J].中国兽医杂志,2009,45(10):3-5.
[8] 莫胜兰,施开创,胡 杰,等.猪瘟病毒和不同型猪繁殖与呼吸综合征病毒的多重 RT-PCR 检测方法的建立[J].动物医学进展,2012,33(9):9-15.
[9] Liu J K, Wei C H, Yang X Y, et al. Genetic diversity and evolutionary characterization of Chinese porcine reproductive and respiratory syndrome viruses based on NSP2 and ORF5[J]. Archives of Virology,2013,158(8):1 811-1 816.
[10] 宁宜宝,吴文福.我国猪瘟流行新特点与疫苗免疫研究[J].中国兽药杂志,2011,45(8):33-37.
[11] Liu J K, Wei C H, Yang X Y, et al. Multiplex PCR for the simultaneous detection of porcine reproductive and respiratory syndrome virus, classical swine fever virus and porcine circovirus in pigs[J].Molecular and Cellular Probes,2013,27(3-4): 49-152.
[12] Liu S, Zhao Y, Hu Q, et al. A multiplex RT-PCR for rapid and simultaneous detection of porcine teschovirus, classical swine fever virus and porcine reproductive and respiratory syndrome virus in clinical specimens[J].Journal of Virological Methods,2011,172(1-2):88-92.
[13] Cheng D, Zhao J J, Li N, et al. Simultaneous detection of Classical swine fever virus and North American genotype Porcine reproductive andrespiratory syndrome virus using a duplex real-time RT-PCR[J].Journal of Virological Methods,2008,151(2):194-199.
[14] 牛 伟,丁 壮,黄晓莉,等. 实时荧光定量PCR方法检测猪繁殖与呼吸综合征病毒和猪瘟病毒[J].中国兽医学报,2011,31(2):174-177.
[15] Zhou Z, Liu Q, Hu D, et al. Complete genome sequence of a European genotype porcine reproductive and respiratory syndrome virus in china[J].Genome Announcements,2013,1(3):e00175-13.
Establishment and Application of Multiplex qRT-PCR for Differential Detection of CSFV and North American and European PRRSV
SHI Kai-chuang1, ZOU Lian-bin1, HU Jie1, ZHANG Bu-xian1, MO Sheng-lan1, GUAN Jia-ming2, CHEN Han-zhong2*
(1.GuangxiProvincialCenterforAnimalDiseaseControlandPrevention,Nanning,Guangxi530001,China; 2.CollegeofAnimalScienceandTechnology,GuangxiUniversity,Nanning,Guangxi530005,China)
A multiplex quantitative TaqMan real-time RT-PCR (qRT-PCR) assay was established for differential detection of classical swine fever virus (CSFV) and North American (NA) and European (EU) genotype porcine reproductive and respiratory syndrome virus (PRRSV) under optimized reaction condition using the three pairs of specific primers and three TaqMan probes designed according to the different genomic sequences among CSFV, NA-PRRSV and EU-PRRSV. The assay proved specifical,sensitive and reproducible, and helped amplify CSFV, NA-PRRSV and EU-PRRSV and meanwhile restraining from cross reaction with other important porcine pathogens. Detection limit of CSFV, NA-PRRSV and EU-PRRSV, all was 2.68 copies/μL ,respectively; variable coefficient was less than 1.5 percent in both intra-and inter-assay. The established assay was used to detect CSFV and PRRSV in 106 of the 253 clinical samples detected following the assay revealed positive, among which 20 samples were positive for CSFV, 86 samples for NA-PRRSV, 11 for both while none for EU-PRRSV. The results indicated that this assay could be used as an effective tool for rapid detection and epidemic surveillance of CSFV and PRRSV.
classical swine fever virus (CSFV); porcine reproductive and respiratory syndrome virus (PRRSV); multiplex quantitative TaqMan real-time RT-PCR (multiplex qRT-PCR)
2014-02-07,
2014-03-27 [基金项目] 广西科学基金项目(桂科青0832057);广西科学研究与技术开发计划项目(桂科转14125004-22)
施开创(1968-),男,广西隆安人,研究员,博士,研究方向:动物疫病诊断与防控技术。E-mail:shikaichuang@126.com
*[通讯作者] 陈汉忠(1955-),男,广西北流人,教授,博士,研究方向:动物疫病防治,E-mail: chenhanz211@sohu.com
S811.6
A
1005-5228(2015)03-0063-006

