两个烟草赤星病抗源的遗传分析
冯 莹,蒋彩虹,程立锐,杨爱国,郑吉云,赵清海,杨修峰,尹华玲,冯全福*
两个烟草赤星病抗源的遗传分析
冯 莹1,蒋彩虹1,程立锐1,杨爱国1,郑吉云1,赵清海2,杨修峰2,尹华玲3,冯全福1*
(1.烟草行业烟草基因资源利用重点实验室,中国农业科学院烟草研究所,青岛 266101;2.山东潍坊烟草有限公司诸城分公司,山东 诸城 262200;3.云南省烟草公司楚雄州公司双柏县分公司,云南 双柏 675100)
以高抗赤星病烟草品种净叶黄(JYH)、Beinhart1000-1(Beinhart)和感病品种NC82为材料分别构建了2个杂交组合的P1、P2、F1、F2四世代群体,成熟期赤星病菌人工接种鉴定后,采用主基因+多基因混合遗传模型对JYH和Beinhart两个材料进行抗性分析,结果表明,两者的赤星病抗性均受两对加性-完全显性主基因+加性-显性多基因控制。组合1的加性效应以第1对主基因为主,且多基因的加性效应大于显性效应;组合2的两对主基因负向加性效应相等,且多基因的显性效应大于加性效应;2个组合F2群体主基因遗传率分别为64.72%和63.88%,表明赤星病的抗性遗传以主基因效应为主,并且受环境影响较大。
烟草;赤星病;主基因+多基因;遗传分析
烟草是我国重要的叶用经济作物,整个生育期易受多种真菌类病害侵染[1]。由交链孢菌引起的赤星病[A lternarialongipes(Ellet Ev.)Tisdaleet Wadk]作为一种烟草成熟期真菌病害,在各烟区普遍发生,直接影响烟叶的产量和品质[2],造成严重经济损失[3-4]。考虑到降低农药残留及保护环境,培育烟草赤星病抗病品种是最为经济有效的方法[5]。国内外专家对此开展了一系列研究[6]。Chaplin等[7]认为雪茄烟品种Beinhart的赤星病抗性是由单基因控制的部分显性遗传。从河南地方品种长脖黄选育的烟草品种净叶黄(JYH)高抗赤星病[8]。王素琴等[9]用JYH与12个感病品种杂交后得到的多数F2群体病情指数呈现1∶2∶1的质量遗传,且抗病性由显性基因控制。
盖钧镒等[10]研究的主基因+多基因混合遗传模型可以准确估算基因效应和方差等遗传参数。该模型已在大豆豆腐和豆乳得率[11]、黄瓜抗黑星病[12]、菊花花器性状[13]、玉米株高[14,15]、小麦[16]、青花菜花球荚叶性状[17]、烟草部分烘烤及农艺性状[18-24]等方面得到应用,但是在烟草抗赤星病多抗源遗传分析上尚未可见。已报道的烟草赤星病抗性遗传结果均采用传统分析方法,本试验利用2份抗病材料(JYH、Beinhart)和1份感病材料(NC82)分别构建的P1、P2、F1、F2四世代分离群体,运用主基因+多基因模型分析烟草抗赤星病的遗传规律,为烟草抗赤星病育种创新及抗病等研究提供理论依据和实践经验。
1 材料与方法
1.1 试验材料
2份抗病材料为国内烤烟品种JYH和美国雪茄烟品种Beinhart;1份感病材料为烤烟品种NC82。种子均由国家烟草中期库提供。利用上述3份材料配制两个杂交组合。组合1以JYH(P1)为母本,NC82(P2)为父本,构建F1、F2群体;组合2以Beinhart(P1)为母本,NC82(P2)为父本,构建F1、F2群体。两个组合、4世代试验材料(表1)播种于中国农业科学院烟草研究所青岛试验基地。

表1 两组合各世代材料数Table 1 The Number of each generation of two combinations
1.2 试验方法
1.2.1 成熟期赤星病人工接种鉴定 参照蒋彩虹的[25]方法完成菌液制备、接种、病情划分。
1.2.2 遗传分析 采用混合遗传模型多世代联合分离分析方法[26]进行数据遗传分析,建立A-E 5类共24种遗传模型。通过最大似然法和IECM(Iterated expectation and conditional maximization)估计各世代、各成分分布的参数,然后通过AIC(Akaike's information criterion)值最小原则选择最佳模型,同时进行一系列适合性检验,包括均匀性检验,Smirnov(nW2)和Kolmogorov(Dn),选择最优遗传模型。从而估计各基因效应值、各组合的遗传效应、误差方差σ2,成分分布方差f群体表型方差并计算主基因和多基因的遗传方差和遗传率
2 结 果
2.1 两组合4世代赤星病病级的次数分布
分别对组合1和组合2的四世代群体进行成熟期人工接种赤星病菌,调查各世代单株病级。两组合4世代赤星病抗性病级次数见图1和图2。两组合抗性分离表现及卡方检验见表2。
对两个抗源与NC82进行赤星病抗性显著性检测,结果显示JYH与Beinhart表现抗病,与感病亲本NC82差异极显著(P<0.01)。JYH的单株病级多集中在1级,表现为高抗赤星病;Beinhart的单株病级0、1、2级均有分布,同样也表现为高抗。组合1的F1代的平均病级为2.60,倾向于感病;组合1的F2群体呈现单峰较明显的偏态分布,赤星病的抗性遗传表现出主基因特征,初步推测受主基因加多基因共同控制;但卡方检测结果表明,杂交F2代抗病单株与感病单株的分离比符合两对互补基因理论分离比(9∶7)(表2),因此,需要利用混合遗传模型对其抗性遗传进一步分析和验证。组合2的F1代的平均抗病级别为2.20,倾向于抗病。F2群体单株病级在低值和高值呈现双峰分布,赤星病的抗性表现出主基因遗传特征。F2代抗病单株与感病单株的比例约为0.97∶1(表2),卡方检测结果表明该分离比均不符合一对基因(3∶1)、两对互补基因(9∶7)或两对显性主基因(15∶1)的理论值,因此组合2的抗性遗传受主基因和多基因共同控制。

图1 JYH×NC82组合的四世代抗性级值次数分布图Fig. 1 Distribution of the number of plants w ith different resistance grades in 4 populations of combination YJH×NC82

表2 两组合抗性分离表现及卡方检验Table 2 The χ2test of genetic resistance of two combinations
2.2 主基因+多基因遗传分析
用“主基因+多基因”混合遗传模型对2个组合四个世代的赤星病级数据进行遗传分析,通过IECM算法获得A、B、C、D、E5类共24种遗传模型的极大似然函数值(Max-likelihood-value)和AIC值(akaike’s information criterion, AIC)。
2.2.1 JYH(组合1)抗赤星病遗传模型 选择AIC值较小的E-2、E-5、D-3、D-4模型为备选模型(表3)。适合性检验表明(表4),在20个检验统计量中,选择AIC值最小且统计量达到显著水平个数最少的E-5模型为JYH抗赤星病最优遗传模型,即两对加性-完全显性主基因+加性-显性多基因模型。
2.2.2 Beinhart(组合2)抗赤星病遗传模型 选择AIC值较小的E-5、E-1、D-0模型为备选模型(表3)。适合性检验表明(表5),在20个检验统计量中,选择AIC值最小且统计量达到显著水平个数最少的E-5模型为Beinhart抗赤星病最优遗传模型,即两对加性-完全显性主基因+加性-显性多基因模型。

表3 两组合遗传模型的AIC值Table 3 The AIC values of the different genetic models in two combinations

表4 YJH×NC82遗传模型的适合性检验Table 4 Test for goodness of fit about YJH×NC82 genetic model
2.3 遗传效应分析
两组合的赤星病抗性均受2对加性-完全显性主基因+加性-显性多基因控制。组合1的加性效应以第1对主基因为主,[h]/[d]<1,说明多基因的加性效应大于显性效应。组合2两对主基因的加性效应均为-0.8935,[h]/[d]>1,说明多基因的显性效应大于加性效应。两组合F2群体主基因遗传率分别为64.72%和63.88%,说明该组合赤星病的抗性遗传以主基因效应为主,并且受环境影响较大(表6)。
3 讨 论
烟草属于自花授粉作物,长期的人工选择过程中产生严重的遗传瓶颈,导致现有品种之间遗传背景狭窄。在烟草抗赤星病育种过程中主要使用的抗源为JYH,长期使用单一抗源会导致其抗病性下降,存在抗性品种丧失抗性的风险,因此充分利用新赤星病抗源具有重要意义。在本试验还对赤星病的另一个重要抗源Beinhart进行了赤星病抗性遗传研究,了解两个抗源的遗传规律,可以为烟草赤星病抗性育种提供理论基础。

表5 Beinhart×NC82遗传模型的适合性检验Table 5 Test for goodness of fit about Beinhart×NC82genetic model
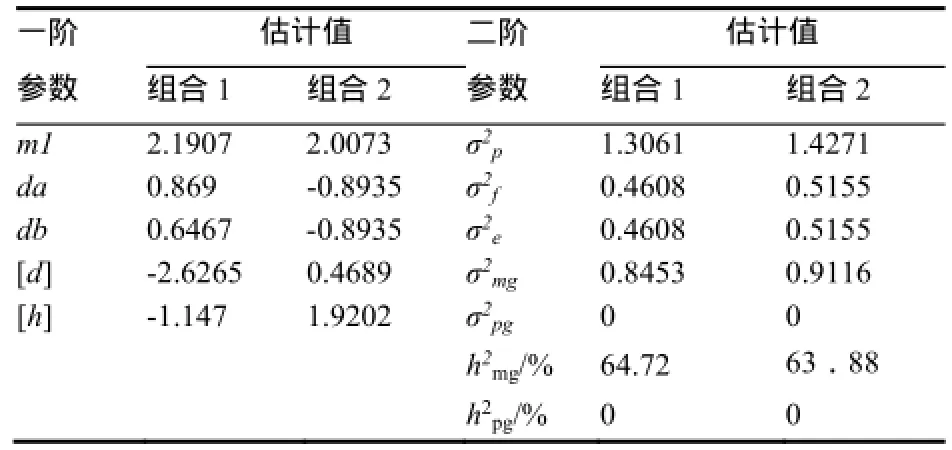
表6 两组合遗传参数估计Table 6 The estimates of genetic parameters in tw o combinations
此前,国内外学者对这2种抗源抗病遗传分析所得的结论不尽相同。Stavely等[27]对包括Beinhart在内的8个高抗赤星病材料做了遗传分析,认为其抗病性都是由多基因控制的,表现为数量遗传。Monga等[28]对10个印度黄花烟品系抗性遗传做的双列杂交分析,表明其抗病性由多个微效基因控制,控制抗病性的基因大部分为显性。郭永峰等[29-30]通过研究表明抗源Beinhart的抗性位点表现为受多基因控制的水平抗性遗传规律,而JYH抗性基因大部分是隐性的。蒋彩虹等[31]以JYH和NC82为亲本,构建的F1、F2、BC1群体进行遗传分析发现其赤星病抗性由显性多基因控制。
本研究对上述2份高抗材料的遗传分析显示,两者的抗病性均受两对加性-完全显性主基因+加性-显性多基因控制,且以主基因效应为主,多基因的加显效应有不同表现。且能够充分利用每个单株信息,确定主基因个数及其效应,与传统孟德尔遗传分离比率方法相比(卡方分析),克服了孟德尔方法难以确定分组标准的难题,而且也可以直接估算主基因与多基因的遗传效应值[12]。另外试验利用非分离世代的表型可以估算环境误差,在表6得出两个组合的σ在数值上分别为0.4608、0.4608和0.5155、0.5155,根据前文1.2.2得出多基因方差及其遗传率为0,所以多基因方差及效应值为0是由于环境对表型影响较大[23,32],导致利用非分离世代(P1、P2和F1)误差方差较大,从而导致多基因的效应值被低估,这是试验方法及数量性状试验误差本身造成的[33]。由于F2群体无法对试验结果重复验证,针对出现的问题在以后的试验中可以考虑利用DH或RIL等重复性较好的群体对赤星病抗性等多基因遗传率较低的数量性状进行分离分析,从而提高遗传分析的精度。
本研究采用主基因+多基因混合遗传模型,不需要分子实验室条件,仅依据表型数据分析即可确定赤星病抗性遗传模型。而现在发展相对成熟的QTL分子标记技术需要适当的分离群体和准确的试验数据,这些试验数据也可用来进行遗传分析,两种方法所得结果可以相互印证。因而,分离分析法可以单独使用,也可以作为QTL定位的前期研究基础,在开展主效QTL定位之前,利用分离分析法优先分析其遗传规律,对发掘主效QTL具有重要参考价值。本课题组分别对JYH和Beinhart这两个赤星病抗源进行了QTL定位。结果表明,对于抗源Beinhart,高婷婷等[34]发掘到2个与赤星病抗性相关的主效QTL,分别位于7号和15号连锁群上,抗性位点来源于抗源Beinhart,这与前面所得结论是相互印证的。蒋彩虹[31]以赤星病抗源JYH为材料获得1个与抗性基因紧密连锁的QTL标记,位于23号连锁群。本研究表明,虽然赤星病抗源JYH的抗性受2对主基因+多基因控制,但是以第一对主效基因的加性效应为主,因此与QTL定位结果基本相同。在本研究中确定的另外一个效应值相对较小的主效基因在QTL定位中没有定位到的原因可能与我们在进行抗源JYH定位中采用的是BSA法有关。BSA法是一种行之有效的发掘主效QTL的方法,但是其缺点是会漏掉效应值较小的位点。所以,在利用BSA法进行赤星病抗性QTL定位的过程中,可能将来源于抗源JYH的另一个主效QTL遗漏。因此,根据遗传分析结果,用抗源JYH和感病亲本配制的分离分析群体,利用SSR标记分析每个后代基因型,进行全基因组QTL发掘将是接下来的一个研究重点。除此之外,根据课题组已有的研究基础,选择JYH为进一步挖掘和鉴定赤星病抗性基因的材料。在充分了解两个抗源抗病机理和抗性遗传方式的基础上,采取常规杂交育种和分子标记相结合,完成抗性基因的转移,加快品种繁育,更快获得优质高抗,适合生产需要的抗病品种也是今后的一个研究重点。
4 结 论
本研究采用主基因+多基因混合遗传模型对JYH和Beinhart两个材料进行分析,结果表明,两者的赤星病抗性均受两对加性-完全显性主基因+加性-显性多基因控制,且以主基因效应为主,受环境影响较大。试验依据表型即可判断遗传模型,可为后续的基因定位提供参考。
[1] 张严柱. 中国烟草行业发展战略选择问题研究[D].大连:东北财经大学,2012.
[2] 易龙,肖崇刚,马冠华,等. 防治烟草赤星病有益内生细菌的筛选及抑菌作用[J]. 微生物学报,2004,44(1):19-22.
[3] Lucas G B. Disease of Tobacco[M]. 3rd ed. Biological Consulting Association, Raleigh. Harold. E. Parker and Sons, Printers. Fuquay-Varina, New Caledonia, 1975∶267-296.
[4] Yakinova E T, Yordanova Z P, Slavov S, et al. Alternaria alternata AT toxin induces programmed cell death in tobacco[J]. Phytopathol, 2009(157)∶ 592-601.
[5] 佟道儒. 烟草育种学[M]. 北京:中国农业出版社,1997:432-438.
[6] 张万良,翟争光,谢扬军,等. 烟草赤星病研究进展[J]. 江西农业学报,2011,23(1):118-120.
[7] Chaplin, J F, T W. Graham. Brown spot resistance in Nicotiana tabacum[J]. Tob. Sci., 1963(7)∶ 59-62.
[8] 中国农业科学院烟草研究所. 中国烟草品种志[M].北京:农业出版社,1987.
[9] 王素琴,李杨立,刘凤兰,等. “净叶黄”抗赤星病遗传规律的测定[J]. 烟草科技,1995(1):30-32.
[10] 盖钧镒. 植物数量性状遗传体系的分离分析方法研究[J]. 遗传,2005,27(1):130-136.
[11] 王春娥,盖钧镒,傅三雄,等. 大豆豆腐和豆乳得率的遗传分析与QTL定位[J]. 中国农业科学,2008,41(5):1274-1282.
[12] 李全辉,沈镝,李锡香,等. 黄瓜抗黑星病不同基因源的遗传分析[J]. 植物遗传资源学报,2011,12(2):291-296.
[13] 张飞,陈发棣,房伟民,等. 菊花花器性状杂种优势与混合遗传分析[J]. 中国农业科学,2010,43(14):2953-2961.
[14] 王铁固,马娟,张怀胜,等. 玉米株高主基因+多基因遗传模型分析[J]. 玉米科学,2012,20(4):45-49.
[15] 马娟. 玉米主要株型性状的主基因+多基因遗传模型分析[D]. 新乡:河南科技学院,2012.
[16] 侯璐,宋晓贺,路亚明,等. 小簇麦易位系V9128-3抗条锈病基因的遗传分析和SSR分子标记[J]. 植物病理学报,2009,39(1):67-75.
[17] 刘二艳,刘玉梅,方智远,等. 青花菜花球‘荚叶’性状主基因+多基因遗传分析[J]. 园艺学报,2009,36(11):1611-1618.
[18] 王日新,任民,张兴伟,等. 普通烟草栽培种内株高性状主基因加多基因遗传分析[J]. 中国烟草科学,2009,30(2):15-20.
[19] 倪超,徐秀红,张兴伟,等. 烤烟品种易烤性相关性状的主基因+多基因遗传分析[J]. 中国烟草科学,2011,32(1):1-4,11.
[20] 张兴伟,王志德,牟建民,等. 烤烟叶绿素含量遗传分析[J]. 中国烟草学报,2011,17(3):48-52.
[21] 张兴伟,王志德,孙玉合,等. 烤烟叶数、叶面积的遗传分析[J]. 植物遗传资源学报,2012,13(3):467-472.
[22] 张兴伟,王志德,任民,等. 烤烟几个重要植物学性状的遗传分析[J]. 中国烟草科学,2012,33(5):1-8.
[23] 牟建英,钱玉梅,张兴伟,等. 烟草白粉病抗性基因的遗传分析[J]. 植物遗传资源学报,2013,14(4):668-672.
[24] 高加明,王志德,张兴伟,等. 香料烟青枯病抗性基因的遗传分析[J]. 中国烟草科学,2010,31(1):1-4.
[25] 蒋彩虹. 烟草赤星病抗性分子标记筛选[D]. 北京:中国农业科学院,2007.
[26] 盖钧镒等. 植物数量性状遗传体系[M]. 北京:科学出版社,2003:22-23.
[27] Stavely J R. Inheritance of brown spot resistance in Nicotiana tabacum[J]. Proc. Am. Phytopathol., 1975(2)∶228-230.
[28] Dobhal V K, Monga D. Genetic analysis of field resistance to brown spot caused by A lternaria alternata( Fries) Keissler in Nicotiana tabacum Linn[J]. Tob. Res. 1991, 17(1)∶ 11-15.
[29] 郭永峰,付宪奎,哈君利. 抗赤星病烟草及其研究利用[J]. 中国烟草科学,1998,19(1):32-35.
[30] 郭永峰,朱贤朝,石金开,等. 烟草对赤星病田间抗性的遗传研究[J]. 中国烟草科学,1998,19(3):1-6.
[31] 蒋彩虹,罗成刚,任民,等. 一个与净叶黄抗赤星病基因紧密连锁的SSR标记[J]. 中国烟草科学,2012,33(1):19-22.
[32] 沈镝,方智远,李锡香,等. 黄瓜果肉色的遗传分析[J]. 植物遗传资源学报,2011,12(2):216-222.
[33] 章元明,盖钧镒. 利用DH和IRIL群体鉴定QTL体系并估计其遗传效应[J]. 遗传学报,2000,27(7):634-640.
[34] 高亭亭,蒋彩虹,罗成刚,等. Beinhart1000-1抗赤星病基因的QTL定位[J]. 中国烟草学报,2014,20(2):104-107.
Genetic Analysis of Resistance to Brown Spot Disease in Tobacco Cultivars Jingyehuang and Beinhart1000-1
FENG Ying1, JIANG Caihong1, CHENG Lirui1, YANG Aiguo1, ZHENG Jiyun1, ZHAO Qinghai2,YANG Xiufeng2, YIN Hualing3, FENG Quanfu1*
(1. Key Laboratory for Tobacco Gene Resources, Tobacco Research Institute, Chinese Academy of Agricultural Sciences, Qingdao 266101, China; 2. Zhucheng Branch of Weifang Tobacco Co., Ltd., Zhucheng, Shandong 262200, China; 3. Shuangbai Branch of Chuxiong Tobacco Company, Shuangbai, Yunnan 675100, China)
Tobacco cultivar/line Jingyehuang, named JYH, and Beinhart1000-1, named Beinhart, have shown effective resistance to brown spot disease. In this study, populations of P1, P2, F1, and F2were generated as experimental materials from two crosses between the two cultivars and susceptible cultivar NC82. The joint segregation analysis method of mixed major gene plus polygene genetic model was used to investigate the inheritance of resistance to brown spot disease in tobacco. The results showed that the inheritances of both JYH and Beinhart fitted to a m ix genetic model of two major genes w ith additive-com plete dom inance effects p lus poly-genes w ith additive-dom inance effects (E-5 model). For high resistance material JYH, the additive effect of the first major gene was larger than the second one. For high resistance material Beinhart, the additive effect of two major genes was equal. Heritability of the major genes was 64.72% in JYH×NC82, and 63.88% in Beinhart×NC82 in F2, indicating that resistances to brown spot disease in tobacco cultivars JYH and Beinhart were mainly controlled by major genes.
tobacco; brown spot disease; major gene plus poly-gene; genetic analysis
S572.03
1007-5119(2015)05-0001-07
10.13496/j.issn.1007-5119.2015.05.001
公益性行业(农业)科研专项项目(201203091);中国烟草总公司科技重大专项项目[110201301009(JY-09)]
冯 莹(1988-),女,在读硕士研究生,研究方向:作物遗传育种。E-mail:fyacang@sina.com。*通信作者,E-mail:quanff@163.com
2015-04-29
2015-09-16

