C3a、C5a在局灶节段肾小球硬化症小鼠发病中的作用*
任凌燕,张 颖,晏现丽,周雅丽,权松霞,邢国兰
1)郑州大学第一附属医院肾脏内科 郑州 450052 2)河南省高等学校临床医学重点学科开放实验室 郑州 450052 3)郑州大学肾脏病研究所 郑州 450052
C3a、C5a在局灶节段肾小球硬化症小鼠发病中的作用*
任凌燕1,2),张 颖1),晏现丽1,2),周雅丽1),权松霞1),邢国兰1,3)#
1)郑州大学第一附属医院肾脏内科 郑州 450052 2)河南省高等学校临床医学重点学科开放实验室 郑州 450052 3)郑州大学肾脏病研究所 郑州 450052
#通信作者,女,1964年8月生,博士,教授,研究方向:慢性肾功能衰竭的防治,E-mail:xgl@zzu.edu.cn
C3a;C5a;局灶节段肾小球硬化症;小鼠
目的:探讨C3a、C5a在局灶节段肾小球硬化症发病中的作用。方法:雄性BALB/c小鼠分为正常对照组、野生型组、C3aR敲除组、C5aR敲除组,每组15只。野生型组、C3aR敲除组、C5aR敲除组小鼠一次性注射阿霉素(10 mg/kg)造模,正常对照组给予等体积的生理盐水,注射阿霉素后第0、1、4、8、12周观察小鼠一般状况,检测24 h尿蛋白和血清白蛋白、甘油三酯、胆固醇、肌酐。另取15只小鼠,于第4、8、12周每组处死5只小鼠,观察肾脏组织病理学变化。结果:与正常对照组比较,注射阿霉素4、8、12周后,模型小鼠24 h尿蛋白和血清甘油三酯、胆固醇、肌酐水平增加(P<0.05), 而血清白蛋白水平下降(P<0.05);与野生型组比较,C3aR、C5aR敲除组各项指标明显改善(P<0.05)。C3aR、C5aR敲除组比野生型组小鼠肾脏组织病理学改变明显减轻。结论:C3a、C5a参与了局灶节段肾小球硬化症的发病过程。
局灶节段肾小球硬化症(focal segmental glomerulosclerosis,FSGS)发病机制尚不明确,现有研究[1-3]主要聚焦在遗传突变、循环渗透因子、机械应力等非免疫因素导致的足细胞损伤与丢失。近期研究[4]显示FSGS患者的尿液及肾组织存在补体激活,提示补体激活与FSGS发生有关。C3a、C5a是补体活化的关键致炎效应分子。该研究应用C3aR、C5aR基因敲除小鼠,通过建立经典的阿霉素肾病模型,探讨补体C3a、C5a在FSGS发病中的作用。
1 材料与方法
1.1 实验动物与材料 SPF级健康雄性野生型和C3aR、C5aR基因敲除BALB/c小鼠,8~10周龄,体重25~30 g,野生型小鼠购于河南省实验动物中心,C3aR、C5aR基因敲除小鼠购于美国Jackson实验室。阿霉素购于北京索莱宝科技有限公司。尿蛋白、血清白蛋白(ALB)、血清甘油三酯(TG)、血清总胆固醇(TC)、血清肌酐(Cr)检测试剂盒购于宁波医杰生物科技有限公司。
1.2 实验分组 适应环境1周,自由摄食基础饲料。将小鼠分为4组:正常对照组、野生型组、C3aR敲除组、C5aR敲除组,每组15只,其中野生型组、C3aR敲除组、C5aR敲除组经尾静脉一次性注射阿霉素10 mg/kg(用生理盐水配制成2 g/L[5]),正常对照组注射等体积生理盐水。
1.3 一般状况及血、尿生化指标测定 观察各组小鼠注射阿霉素前后的一般状况,于注射阿霉素前及注射阿霉素1、4、8、12周后用代谢笼收集24 h尿液,测定24 h尿蛋白水平;通过小鼠内眦静脉取血,全自动生化分析仪测定血清ALB、TG、TC和Cr水平。
1.4 肾脏组织病理学改变 60只小鼠分组同1.2。于注射阿霉素4、8、12周后每组各处死5只小鼠,用体积分数10%的甲醛溶液固定肾组织,常规石蜡包埋,2 μm厚切片, 过碘酸雪夫反应(PAS)染色、马松三色(MASSON)染色,观察肾脏组织病理学变化情况。
1.5 统计学处理 采用SPSS 16.0 进行分析,所有计量资料均进行正态分布和方差齐性检验。应用重复测量数据的方差分析比较4组小鼠24 h尿蛋白和血清ALB、TC、TG、Cr水平的差异,检验水准α=0.05。
2 结果
2.1 一般情况的比较 正常对照组小鼠正常活动,正常饮食。而注射阿霉素1周后模型小鼠精神欠佳,进食、活动量减少,被毛直立,毛不顺滑,4周后所有小鼠均恢复正常,饮食、活动量增加。12周内野生型组小鼠有5只死亡;C3aR敲除组有1只死亡。
2.2 各组小鼠24 h尿蛋白水平的比较 与正常对照组比较,注射阿霉素1周后,模型小鼠24 h尿蛋白水平显著增加,达到高峰,大量蛋白尿一直持续到实验第12周;与野生型组比较,C3aR敲除组、C5aR敲除组尿蛋白水平显著下降。见表1。

表1 各组小鼠24 h尿蛋白水平比较 mg/24 h
F组间=41.868,P<0.001;F时间=240.732,P<0.001;F交互=13.272,P<0.001;*:与正常对照组比较,P<0.05;#:与野生型组比较,P<0.05。
2.3 各组小鼠血清ALB、TC、TG和Cr水平的比较 见表2~5。与正常对照组小鼠比较,注射阿霉素后模型小鼠血清ALB水平降低,1周后降至最低,4周后有所回升;与野生型组比较,C3aR敲除组、C5aR敲除组降低程度明显减轻。 与正常对照组比较,模型小鼠血清TG和TC水平显著增加;与野生型组比较,C3aR敲除组、C5aR敲除组增加程度明显减轻。与正常对照组比较,注射阿霉素4周后模型小鼠血清Cr水平显著增加;与野生型组比较,注射阿霉素8周后C3aR敲除组、C5aR敲除组血清Cr水平增加程度明显减轻。
2.4 肾脏病理改变 野生型组第4周可见部分肾小球出现局灶、节段硬化,伴有足细胞肿胀,肾小管有较多蛋白管型,肾间质变化不明显;第8周部分肾小球出现球性硬化,伴有明显的足细胞增生和肥大,肾小管上皮细胞空泡变性,可见大量蛋白管型,肾间质可见轻度纤维化;第12周弥漫性肾小球出现球性硬化,足细胞明显增生和肥大,部分肾小管萎缩、片状扩张,肾间质小动脉管壁增厚、管腔狭窄,间质内可见灶状淋巴细胞浸润和轻度纤维化。C3aR敲除组、C5aR敲除组第4、8、12周偶见部分肾小球出现系膜基质轻、中度增生,球囊粘连,呈现节段性轻、中度硬化,肾小管少量蛋白管型,肾间质未见明显病变。见图1、2。

表2 各组小鼠血清ALB水平的比较 g/L
F组间=71.326,P<0.001;F时间=516.152,P<0.001;F交互=17.074,P<0.001;*:与正常对照组比较,P<0.05;#:与野生型组比较,P<0.05。
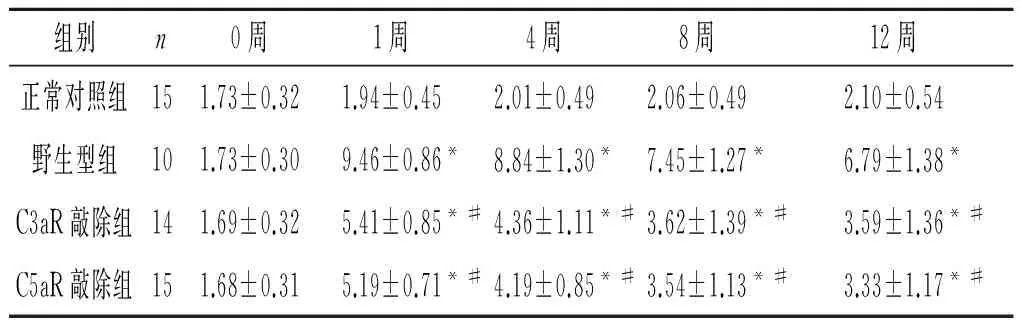
表3 各组小鼠血清TC水平的比较 mmol/L
F组间=81.891,P<0.001;F时间=484.972,P<0.001;F交互=8.761,P<0.001;*:与正常对照组比较,P<0.05;#:与野生型组比较,P<0.05。
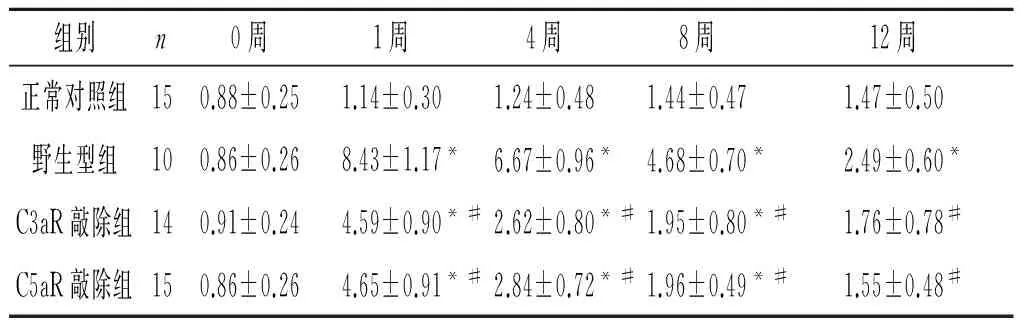
表4 各组小鼠血清TG水平的比较 mmol/L
F组间=65.070,P<0.001;F时间=595.738,P<0.001;F交互=21.860,P<0.001;*:与正常对照组比较,P<0.05;#:与野生型组比较,P<0.05。

表5 各组小鼠血清Cr水平的比较 mmol/L
F组间=38.531,P<0.001;F时间=106.631,P<0.001;F交互=17.763,P<0.001;*:与正常对照组比较,P<0.05;#:与野生型组比较,P<0.05。

图1 4组小鼠肾脏病理改变(PAS,×200)

图2 4组小鼠肾脏病理改变(MASSON,×200)
3 讨论
近年研究[4]提示补体激活可能参与了FSGS 的发生和发展。C1q肾病89.5%病理表现为FSGS,提示补体活化与FSGS 密切相关,补体调节蛋白的异常参与FSGS 发病。有学者[6]发现补体激活抑制因子缺失会加速FSGS的发展。补体三条激活途径具有共同的末端通路,即产生过敏毒素C3a、C5a,启动炎症反应以及形成膜攻击复合物(C5b-9)导致细胞溶解效应。C3a、C5a 是补体激活后产生的最主要的致炎产物,与特异性受体C3aR、C5aR 结合后,通过趋化、促炎症介质释放、促细胞黏附等作用,参与了过敏、感染及自身免疫疾病等多种炎症性疾病的发病过程。抑制C3a、C5a 相应受体可以减轻炎症反应和组织损伤。在既往的研究[7]中发现,FSGS患者尿液C3活化产物水平显著升高,而尿液C5b-9 水平与其他肾脏病患者无明显差别,提示C3a、C5a 可能是FSGS 中补体损伤的主要效应因子。研究[8-9]发现C3a、C5a 参与多种肾脏疾病的发病过程。拮抗或敲除C3aR、C5aR可能延缓疾病进展[10]。
Tang等[11]利用阿霉素诱导肾病模型后发现C3a 参与肾小管间质炎症和纤维化,C3aR基因敲除可改善肾功能。阿霉素进展性肾病已经成为经典的局灶节段肾小球硬化模型,以大量蛋白尿、进行性肾小球硬化和肾间质纤维化为主要特征。该研究利用对肾毒性比较敏感的野生型、C3aR基因敲除、C5aR基因敲除Balb/c小鼠[12],一次性经尾静脉注射阿霉素(10 mg/kg)造模。注射阿霉素4、8、12周后,野生型组小鼠24 h尿蛋白定量和血清TC、TG、Cr水平均显著高于其他3组,血清ALB显著低于其他3组。野生型组第4周可见部分肾小球出现局灶、节段硬化,肾小管有较多蛋白管型,肾间质变化不明显;第8周部分肾小球出现球性硬化,肾小管上皮细胞空泡变性,可见大量蛋白管型,肾间质可见纤维化;第12周弥漫性肾小球出现球性硬化,部分肾小管萎缩、片状扩张,肾间质小动脉管壁增厚、管腔狭窄,间质内少量纤维化。C3aR敲除组、C5aR敲除组第4、8、12周偶见部分肾小球呈现节段性轻、中度硬化,肾小管少量蛋白管型,肾间质未见明显病变,与野生型组比较,肾脏病理改变较轻。12周内野生型组小鼠死亡5只,C3aR敲除组死亡1只,C5aR敲除组及正常对照组无小鼠死亡。由此可见,C3aR敲除、C5aR敲除可明显改善肾脏功能,减轻肾脏病理改变。
综上所述,C3a、C5a参与了FSGS的发病过程,但具体的机制还有待于进一步研究。
[1]Rood IM, Deegens JK, Wetzels JF. Genetic causes of focal segmental glomerulosclerosis:implications for clinical practice[J].Nephrol Dial Transplant, 2012,27(3):882
[2]Wei C, El Hindi S, Li J, et al. Circulating urokinase receptor as a cause of focal segmental glomerulosclerosis[J].Nat Med,2011,17(8):952
[3]梁丹丹,曾彩虹.局灶节段性肾小球硬化的发病机制[J].肾脏病与透析肾移植杂志,2009,18(1):70
[4]Markowitz GS,Schwimmer JA,Stokes MB,et al.C1q nephropathy: a variant of focal segmental glomerulosclerosis[J].Kidney Int,2003,64(4):1232
[5]Turnberg D,Lewis M,Moss J,et al.Complement activation contributes to both glomerular and tubulointerstitial damage in adriamycin nephropathy in mice[J].J Immunol,2006,177(6):4094
[6]Bao L,Haas M,Pippin J,et al.Focal and segmental glomerulosclerosis induced in mice lacking decay-accelerating factor in T cells[J].J Clin Invest,2009,119(5):1264
[7]Morita Y,Ikeguchi H,Nakamura J,et al.Complement activation products in the urine from proteinuric patients[J].J Am Soc Nephrol,2000,11(4):700
[8]段喜梅,张颖,刘璐,等.C3a、C5a及其受体在IgA肾病发病中的作用[J].郑州大学学报:医学版,2013,48(3):313
[9]张朝甲,张颖,刘璐,等.糖尿病肾病患者肾脏组织中C3aR、C5aR的表达[J].郑州大学学报:医学版,2014,49(2):162
[10]Mizuno M,Blanchin S,Gasque P,et al.High levels of complement C3a receptor in the glomeruli in lupus nephritis[J].Am J Kidney Dis,2007,49(5):598
[11]Tang Z,Lu B,Hatch E,et al.C3a mediates epithelial-to-mesenchymal transition in proteinuric nephropathy[J].J Am Soc Nephrol,2009,20(3):593
[12]Zheng Z,Schmidt-Ott KM,Chua S,et al.A Mendelian locus on chromosome 16 determines susceptibility to doxorubicin nephropathy in the mouse[J].Proc Natl Acad Sci U S A,2005,102(7):2502
(2014-12-07 收稿 责任编辑李沛寰)
Roles of C3a and C5a in pathogenesis of focal segmental glomerulosclerosis in mice
RENLingyan1,2),ZHANGYing1),YANXianli1,2),ZHOUYali1),QUANSongxia1),XINGGuolan1,3)
1)DepartmentofNephrology,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou4500522)Key-DisciplinesLaboratoryforClinicalMedicineofHenanProvince,Zhengzhou450052 3)InstituteofNephrology,ZhengzhouUniversity,Zhengzhou450052
C3a;C5a;focal segmental glomerulosclerosis;mouse
Aim: To investigate the roles of C3a,C5a in the pathogenesis of focal segmental glomerulosclerosis.Methods: Male Balb/c were divided into four groups: normal control group,wild-type group,C3aR knockout group and C5aR knockout group, and each group had 15 mice.Wild-type group, C3aR knockout group, and C5aR knockout group were given adriamycin at 10 mg/kg by a single tail intravenous injection,and the normal control group was given the same amount of normal saline.To compare their general condition,the levels of 24 hour urinary protein, serum albumin,serum triglyceride,serum cholesterol,and serum creatinine at 0,1st,4th,8th,and 12th week after injection were detected.Five mice was sacrificed at the 4th,8th,and 12th to observe the pathology changes of kidney.Results: After being injected adriamycin for 1,4,8,and 12 weeks,the levels of 24 hour urinary protein,serum triglyceride,serum cholesterol,and serum creatinine went up significantly(P<0.05),while serum albumin decreased significantly(P<0.05).Compared with the C3aR knockout and C5aR knockout groups,the changes of the above indicators were more significant in the wild-type group(P<0.05). Compared with the wild-type group,the C3aR knockout and C5aR knockout groups had milder pathological changes in kidney.Conclusion: C3a and C5a may take part in the pathogenesis of focal segmental glomerulosclerosis.
10.13705/j.issn.1671-6825.2015.03.008
*国家自然科学基金青年科学基金项目 8140040515
R692.9

