CX3CR1参与雷公藤内酯对MPP+帕金森病大鼠多巴胺能神经元的保护作用*
周子懿, 高俊鹏, 向 军, 陈依萍, 蔡业峰, 罗恩丽△, 蔡定芳△
(1广州中医药大学第二附属医院,广东省中医院脑病一科,广东 广州 510120; 2广州医科大学附属广州市第一人民医院中医科,广东 广州 510180; 3复旦大学附属中山医院中西医结合神经病学研究室,上海 200032)
CX3CR1参与雷公藤内酯对MPP+帕金森病大鼠多巴胺能神经元的保护作用*
周子懿1▲, 高俊鹏2▲, 向 军3, 陈依萍3, 蔡业峰1, 罗恩丽1△, 蔡定芳3△
(1广州中医药大学第二附属医院,广东省中医院脑病一科,广东 广州 510120;2广州医科大学附属广州市第一人民医院中医科,广东 广州 510180;3复旦大学附属中山医院中西医结合神经病学研究室,上海 200032)
目的: 探讨雷公藤内酯对1-甲基-4-苯基吡啶(MPP+)帕金森病模型大鼠的保护作用及其可能机制。方法: 采用MPP+黑质内注射建立帕金森病大鼠模型。实验分为假手术组、模型组、雷公藤内酯组及其溶剂对照组,利用酪氨酸羟化酶(TH)免疫荧光强度测定多巴胺神经元存活率、小胶质细胞标记物OX-42免疫荧光强度测定小胶质细胞激活程度、Western blotting测定趋化因子受体CX3CR1表达量。结果: 免疫组化结果表明,MPP+黑质内注射可使模型组OX-42免疫荧光强度增高,DA神经元进行性变性死亡。雷公藤内酯组OX-42免疫荧光强度较模型组低(P<0.01),TH阳性神经元数量较模型组多(P<0.01)。Western blotting结果提示雷公藤内酯组CX3CR1表达量较模型组低(P<0.05)。结论: 雷公藤内酯对MPP+帕金森病大鼠模型具有神经保护作用,其机制可能与抑制小胶质细胞激活有关,抑制CX3CR1可能是其抑制小胶质细胞的途径之一。
帕金森病; 小胶质细胞; 雷公藤内酯; 多巴胺能神经元
帕金森病(Parkinson’s disease,PD)是常见的神经变性运动障碍疾病,其病理基础是中脑黑质(substantia nigra,SN)区域多巴胺(dopamine,DA)神经元进行性变性死亡,并引起纹状体DA含量的下降。现有治疗方法虽然可以减轻大部分患者临床症状,但无法阻止或延缓DA神经元的进行性死亡。神经炎症反应(neuroinflammation)作为一种重要的PD致病因素,正受到越来越多的关注。无论在PD动物模型,还是PD患者中,都存在以小胶质细胞(microglia)激活为特征的神经炎症反应。小胶质细胞是中枢神经系统(central nervous system,CNS)的固有免疫细胞,其活化后可分泌白细胞介素(interleukin,IL)1β、肿瘤坏死因子(tumor necrosis factor,TNF)α、趋化因子等,损伤DA神经元,促进神经元变性过程[1-2]。
雷公藤是免疫抑制能力较强的药物之一,用于治疗炎症与自身免疫疾病在我国已有很长的历史。在雷公藤提取出的9种有生物活性的化合物中,雷公藤内酯(triptolide)是抗炎及免疫抑制作用较强的单体[3]。本研究拟在1-甲基-4-苯基吡啶(1-methyl-4-phenylpyridinium,MPP+)-PD大鼠模型中,观察雷公藤内酯对PD模型鼠小胶质细胞的抑制作用,并从趋化因子受体CX3CR1的角度探讨其可能机制。
材 料 和 方 法
1 动物及分组
清洁级健康成年雄性Sprague-Dawley大鼠,体重250~280 g,由复旦大学实验动物中心提供。大鼠饲养在恒温、通风良好的环境中,每天接受12 h的光照,同时供以充足的食物和水。并在每次实验前进行环境适应性训练,以排除应激干扰。实验中大鼠共分为为假手术组、MPP+模型组、雷公藤内酯组和溶剂对照组。MPP+模型组大鼠仅接受MPP+注射,分别在造模后第0、1、3、7、14、21天进行免疫组织化学及Western blotting检测。其它各组大鼠分别在第7天进行Western blotting检测,第21天进行免疫组织化学检测。
2 试剂和药品
MPP+、阿朴吗啡、正常驴血清和抗酪氨酸羟化酶(tyrosine hydroxylase, TH)抗体(Sigma);雷公藤内酯(中国药品生物制品检定所,HPLC纯度99%);OX-42抗体和驴抗兔 IgG(Chemicon);山羊抗CX3CR1 抗体Santa Cruz)。
3 方法
3.1 MPP+-PD大鼠模型的建立及动物给药 造模药物MPP+注射剂量参照先前文献[4],大鼠麻醉后,将其头部固定于立体定位仪,缓慢将2 μL MPP+(10 μg)以0.4 μL/min速度立体定向注射入左侧SN。假手术组给予生理盐水2 μL代替MPP+,注射方法同上。模型组大鼠仅接受MPP+注射,雷公藤内酯组于造模后以5 μg/kg剂量用生理盐水配成0.2 mL腹腔注射,每日 1 次。溶剂对照组给予等量生理盐水腹腔注射,方法同上。
3.2 免疫组织化学测定与定量分析 大鼠在乌拉坦(1.5 g/kg ip)深度麻醉下,经左心室向升主动脉灌注37 ℃生理盐水150 mL,然后用4 ℃ 4%的多聚甲醛400 mL固定液灌注固定。灌注完毕立即剥取大脑,置于上述固定液中后固定2 h后置入10%蔗糖溶液中(4 ℃);4~6 h后换入20%蔗糖,组织块沉底后,再换30%蔗糖至沉底。利用冷冻切片机(Leica)做大脑冠状面连续切片,片厚30 μm。漂片于切片保护液中,备用。从切片保护液中随机挑取大脑薄片,每只大鼠6~8张;0.01 mol/L PBS漂洗,10 min 3次,10%正常驴血清(含0.3 % Triton X-100的0.01 mol/L PBS配制)封闭,4 ℃过夜。兔抗酪氨酸羟化酶(1∶1 000),或mouse-anti-OX-42(1∶1 000),4 ℃孵育40 h。0.01 mol/L PBS漂洗10 min 3次。若丹明偶联的驴抗兔IgG (1∶200),室温下避光孵育90 min。0.01 mol/L PBS漂洗10 min 3次,避光。荧光封片剂封片后于荧光显微镜下观察。图像的采集由Olympus数码相机和相应软件Spot Advance完成。由于胶质细胞在激活后发生肿胀变形,既定视野里用细胞计数的方法不足以反映胶质细胞活性的增强,因此应用Leica Qwin 500图像分析软件对黑质区域OX-42的免疫荧光强度(OX-42-IR)进行测定。每只动物取6张切片,计算其平均光密度值,作为该例动物的最终光密度。
3.3 DA神经元损伤程度的检测 参照Vaananen等[5]的方法,利用DA神经元特异性标志酶酪氨酸羟化酶染色计数多巴胺DA神经元。TH是儿茶酚胺能神经元合成儿茶酚胺的特异性限速酶,对TH阳性神经元的定量是判定DA神经元的存活情况的可靠指标,可反映DA神经元变性死亡的程度。采用荧光显微镜在40倍视野下对脑片SN pc区域TH阳性神经元进行观察计数,TH阳性神经元的相对定量可由损伤侧(MPP+注射侧)TH阳性神经元数量除以损伤对侧(非注射侧)TH阳性神经元数量,结果用百分比表示,各组间进行比较。
3.4 Western blotting检测 各组大鼠麻醉后,迅速断头取出造模同侧中脑部位脑组织,约100 mg左右。将组织置于1~2 mL匀浆器中球状部位,剪碎,置于裂解液中, 低温匀浆,4 ℃、13 000 r/min 离心15 min,取上清。提取蛋白,BCA法测定蛋白质浓度。取总蛋白20 μg,15%SDS-PAGE分离蛋白,电转法转移到NC膜上,NC膜在室温下用5%脱脂牛奶封闭1 h;CX3CR1 I 抗(1∶2 000)或小鼠抗β-actin(1∶10 000) 4 ℃孵育24 h;辣根过氧化物酶偶联的驴抗羊 II 抗(1∶5 000)或驴抗小鼠 II 抗(1∶1 000)室温孵育2 h;化学发光法显影,扫描。用图像处理系统对条带灰度进行分析,以β-actin的表达量作内参照。
4 统计学处理
全部数据采用SPSS 19.0 统计软件包进行统计分析, 正态分布数据用均数±标准误(mean±SEM)表示,免疫组织化学结果采用成组样本的t检验(比较2种处理组的差异时)或单因素方差分析跟随组间t检验(one-way ANOVA followed by Holm-Sidakt-test)。以P<0.05为差异有统计学意义。
结 果
1 MPP+黑质部位注射可导致小胶质细胞激活、多巴胺能神经元损伤
为了对MPP+注射后小胶质细胞激活程度随时间的变化情况加以评定,我们分别在造模后的0、1、3、7、14、21 d采用OX-42对小胶质细胞进行标记并观察。在假手术组中,大鼠黑质区域OX-42着色的小胶质细胞呈现出未被激活的形态,胞体较小,层形足板细长,免疫着色较浅。而对于MPP+模型组,OX-42免疫阳性的小胶质细胞的数量明显增多,并呈现出被激活时的典型形态特征,胞体明显增大,层形足板变厚变短。OX-42-IR值在MPP+注射3 d后较基线(第0天时)比较开始明显升高(P<0.01),7 d时达到最高峰(P<0.01),在第14和21 天时略有下降,但与基线时比较仍存在显著统计学差异(P<0.05),见图1A。
通过对TH阳性神经元的测定,我们观察到黑质MPP+注射可导致同侧DA神经元进行性变性死亡。重复测量数据方差分析结果表明,TH阳性神经元存活率随时间变化的差异有统计学意义(P<0.05),MPP+注射后第3天时与基线比较开始明显降低(P<0.05),在第21天时,即本研究的终点,损伤同侧TH阳性神经元的数量减少至对侧的(8.60±1.21)%(P<0.05),见图1B。
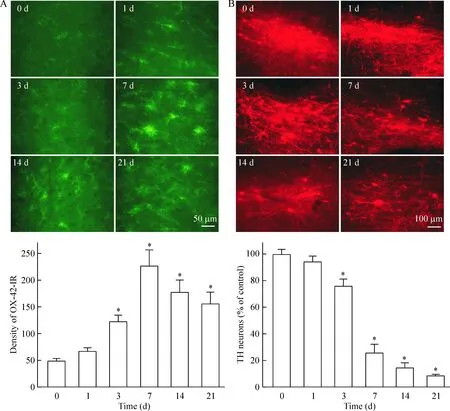
Figure 1.Microglia and dopaminergic neurons in the SN as revealed with OX-42 (A) and TH (B) immunoreactivity, respectively. Mean±SEM.n=6.*P<0.05vs0 d.
图1 MPP+损伤同侧黑质区域OX-42免疫荧光强度、TH阳性神经元数量的变化情况
2 雷公藤内酯对MPP+-PD大鼠小胶质细胞激活情况和DA神经元存活率的影响
在假手术组大鼠的黑质区域,OX-42的免疫着色较少,在MPP+模型鼠的黑质区域,OX-42免疫阳性的小胶质细胞表现出激活时的典型特征。在雷公藤内酯给药组中,OX-42-IR值显著降低,同假手术组比较无显著统计学差异,见图2,提示雷公藤内酯系统性给药可起到抑制小胶质细胞的作用。
对TH阳性神经元的分析显示,雷公藤内酯可使损伤同侧黑质区域TH阳性神经元数量升高到对侧的(34.90±5.33)%,显著高于MPP+模型组(P<0.05)。对于vehicle对照组,其OX-42-IR值和TH阳性神经元百分比同MPP+模型组相比无显著差异,见图2。

Figure 2.The effect of triptolide on MPP+-induced microglial activation and dopaminergic neurotoxicity in rats.Mean±SEM.n=6.*P<0.05vssham;#P<0.05vsMPP+.
图2 雷公藤内酯对MPP+-PD大鼠小胶质细胞激活情况及DA神经元存活情况的影响
3 CX3CR1 在MPP+-PD大鼠SN区域表达变化趋势
CX3CR1蛋白在假手术组的SN区域有一定的表达量,CX3CR1表达量在MPP+造模后第3、7、14、21天均较假手术组升高(P<0.05),在造模后第7天时升高尤为明显,而造模后第1天组与假手术组对比差异无统计学意义,见图3。
4 雷公藤内酯对MPP+-PD大鼠SN区域CX3CR1表达的影响
雷公藤内酯干预组CX3CR1表达量较模型组显著下降(P<0.05)。vehicle对照组CX3CR1表达量与模型组差异无显著统计学意义,见图4。
讨 论
1-甲基-4-苯基-1,2,3,6四氢吡啶(MPTP)及其活性代谢产物MPP+是目前较常用的PD造模药物。上世纪80年代在美国北加州吸毒者所使用的海洛因中混有MPTP,可形成与自发性PD难以分辨的症候群[6],是目前唯一在人类中发现可导致PD症状的神经毒素。然而,当利用MPTP系统给药造模时,不但会引起DA神经元损伤,还会影响到胶质细胞的功能。因MPTP向MPP+的转化主要是在星型胶质细胞内单胺氧化酶(monoamine oxidase, MAO)-B的催化作用下完成,影响MAO-B功能的药物可能会加重MPTP的神经毒性[7],因此,选择MPP+-PD大鼠作为研究对象,可避免因实验药物对星形胶质细胞功能的影响而干扰实验结果,已成为研究小胶质细胞功能状态与DA神经元损伤之间关系的理想模型。
Fractalkine/CX3CL1(FKN)是趋化因子亚家族CX3C的成员,正常生理状态下,FKN以膜分子形式广泛表达于脑组织的神经元细胞,其受体CX3CR1则主要表达在小胶质细胞膜上[8],是激活小胶质细胞的重要靶点。Lee等[9]在CX3CR1基因敲除小鼠中发现小胶质细胞活性明显下降。Shan等[2]用特异性抗体封闭CX3CR1可以减轻小胶质细胞的激活程度,并起到保护多巴胺能神经元的作用。本研究观察到,在MPP+注射后CX3CR1在第3天后逐渐升高,至第7天达到高峰,这与小胶质细胞激活的时相吻合,进一步印证了CX3CR1在小胶质细胞激活中起到重要作用。抑制CX3CR1的表达或抑制其活性有望成为治疗PD的靶点之一。
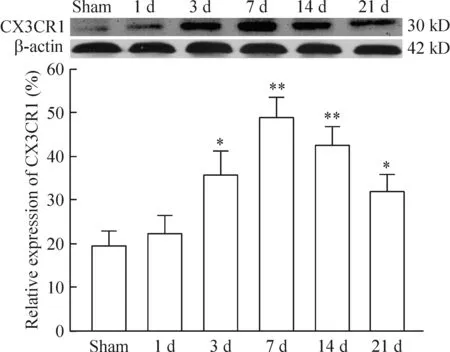
Figure 3.The expression levels of CX3CR1 in the SN area of MPP+-PD rats at different time points.Mean±SEM.n=6.*P<0.05,**P<0.01vssham group.
图3 CX3CR1 在MPP+-PD大鼠SN区域表达变化
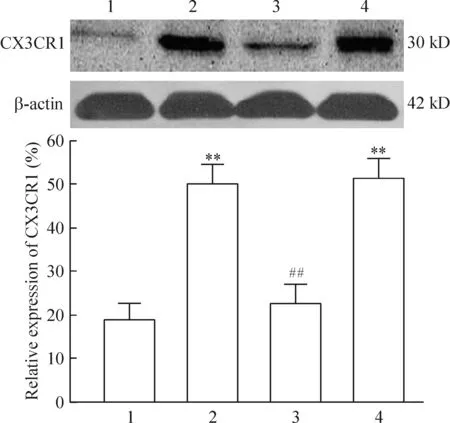
Figure 4.The expression of CX3CR1 in different groups after 7 d of MPP+injection. 1: sham group; 2: MPP+group; 3: MPP++ triptolide group; 4: MPP++ vehicle group.Mean±SEM.n=6.**P<0.01vssham group;##P<0.01vsMPP+group.
图4 MPP+造模后第7天各组CX3CR1表达情况
雷公藤内酯是中药雷公藤中主要的单体成分,本实验中,我们观察到雷公藤内酯可以抑制小胶质细胞的激活,降低TH阳性神经元的死亡率。这些研究结果与雷公藤内酯可以抑制LPS诱导的小胶质细胞激活,保护DA神经元相吻合[10-11],印证了雷公藤内酯有确切的小胶质细胞抑制作用,可减轻TH神经元的损伤。我们同时观察到雷公藤内酯可抑制CX3CR1的表达,提示CX3CR1可能是其抑制小胶质细胞的途径之一。
[1] Borrajo A, Rodriguez-Perez AI, Diaz-Ruiz C, et al. Microglial TNF-alpha mediates enhancement of dopaminergic degeneration by brain angiotensin[J]. Glia, 2014, 62(1):145-157.
[2] Shan S, Hong-Min T, Yi F, et al. New evidences for fractalkine/CX3CL1 involved in substantia nigral microglial activation and behavioral changes in a rat model of Parkinson’s disease[J]. Neurobiol Aging, 2011, 32(3):443-458.
[3] 朱彩凤, 包自阳, 朱 斌,等. 雷公藤内酯醇对IgA肾病大鼠血清IgA异常糖基化的影响[J]. 中国病理生理杂志, 2009, 25(1):186-187.
[4] Hayashita-Kinoh H, Yamada M, Yokota T, et al. Down-regulation of alpha-synuclein expression can rescue dopa-minergic cells from cell death in the substantia nigra of Parkinson’s disease rat model[J]. Biochem Biophys Res Commun, 2006, 341(4):1088-1095.
[5] Vaananen AJ, Rauhala P, Tuominen RK, et al. KDI tripeptide of gamma 1 laminin protects rat dopaminergic neurons from 6-OHDA induced toxicity [J]. J Neurosci Res, 2006, 84(3):655-665.
[6] Tristão FS, Amar M, Latrous I, et al. Evaluation of nigrostriatal neurodegeneration and neuroinflammation following repeated intranasal 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP) administration in mice, an experimental model of Parkinson’s disease[J]. Neurotox Res, 2014, 25(1):24-32.
[7] Przedborski S, Vila M. The 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine mouse model: a tool to explore the pathogenesis of Parkinson’s disease[J]. Ann NY Acad Sci, 2003, 991:189-198.
[8] Smith JA, Das A, Ray SK, et al. Role of pro-inflammatory cytokines released from microglia in neurodegenerative diseases[J]. Brain Res Bull, 2012, 87(1): 10-20.
[9] Lee S, Varvel NH, Konerth ME, et al. CX3CR1 deficiency alters microglial activation and reduces beta-amyloid deposition in two Alzheimer’s disease mouse models [J]. Am J Pathol, 2010, 177(5):2549-2562.
[10]Gao JP, Sun S, Li WW, et al.Triptolide protects against 1-methyl-4-phenyl pyridinium-induced dopaminergic neurotoxicity in rats: implication for immunosuppressive therapy in Parkinson’s disease[J]. Neurosci Bull, 2008, 24(3):133-142.
[11]Zhou HF, Liu XY, Niu DB, et al. Triptolide protects dopaminergic neurons from inflammation-mediated damage lipopolysaccharide intranigral induced by injection[J]. Neurobiol Dis, 2005,18(3):441-449.
CX3CR1 mediates the neuroprotective effect of triptolide on 1-methyl-4-phenylpyridinium-induced hemiparkinson rats
ZHOU Zi-yi1, GAO Jun-peng2, XIANG Jun3, CHEN Yi-ping3, CAI Ye-feng1, LUO En-li1, CAI Ding-fang3
(1FirstDepartmentofNeurology,SecondAffiliatedHospital,GuangzhouUniversityofTraditionalChineseMedicine,GuangdongProvincialHospitalofTraditionalChineseMedicine,Guangzhou510120,China;2GuangzhouFirstPeople’sHospital,GuangzhouMedicalUniversity,Guangzhou510180,China;3LaboratoryforNeurologicalResearch,TheInstituteofIntegrativeMedicine,ZhongshanHospital,FudanUniversity,Shanghai200032,China.E-mail:sciencecn@hotmail.com;doctorcn@hotmail.com)
AIM: To investigate the effect of triptolide on the inhibition of microglial activation in 1-methyl-4-phenyl pyridinium (MPP+)-induced hemiparkinson disease rats. METHODS: The rat model of Parkinson disease was established by intranigral injection of MPP+. The rats were randomly divided into sham group, MPP+group, triptolide group and vehicle group. The survival of dopaminergic neurons was detected by the immunofluorescence of tyrosine hydroxylase (TH) in the substantia nigra (SN). The activation of microglia was determined by immunofluorescence of OX-42 (microglia marker) in the SN. The expression of chemokine receptor CX3CR1 in SN was measured by Western blotting. RESULTS: Intranigral injection of MPP+increased the fluorescence intensity of the microglial marker, and promoted DA neuron degenerative death. Immunohistological analysis showed that the OX-42 density was decreased (P<0.01) and tyrosine hydroxylase (TH) positive neurons were increased in the triptolide group (P<0.01). The expression of CX3CR1 was lower in triptolide group than that in model group (P<0.05). CONCLUSION: Triptolide may improve PA neurons function in MPP+-induced rats through inhibiting CX3CR1 expression and microglial activation.
Parkinson’s disease; Microglia; Triptolide; Dopaminergic neuron
1000- 4718(2015)04- 0659- 05
2014- 10- 22
2014- 11- 27
国家自然科学基金资助项目(No. 81373712)
R363; R741
A
10.3969/j.issn.1000- 4718.2015.04.015
△通讯作者 罗恩丽 Tel: 020-81887233; E-mail: sciencecn@hotmail.com; 蔡定芳 Tel: 021-64041990; E-mail: doctorcn@hotmail.com
▲并列第1作者

