DEC1基因过表达对人食管癌ECA109细胞增殖及侵袭能力的影响
杨纯平, 王华川, 温剑虎
(重庆医科大学附属第一医院胸心外科,重庆 400016)
DEC1基因过表达对人食管癌ECA109细胞增殖及侵袭能力的影响
杨纯平, 王华川, 温剑虎△
(重庆医科大学附属第一医院胸心外科,重庆 400016)
目的: 探讨DEC1基因过表达对人食管癌ECA109细胞增殖和侵袭能力的影响及可能机制。方法:将质粒pcDNA3.1(-)/DEC1(DEC1组)和pcDNA3.1(-)(vector组)利用脂质体分别转染至人食管癌ECA109细胞中,通过real-time PCR检测转染48 h后的细胞内DEC1 mRNA表达,Western blot分别检测转染72 h后细胞内DEC1、基质金属蛋白酶9(MMP9)及细胞周期蛋白cyclin D1的蛋白表达;采用CCK-8实验、平板集落实验及Transwell实验分别检测DEC1过表达对细胞的增殖和侵袭能力的影响。结果: 与vector组相比,DEC1组中DEC1的表达明显增高(P<0.01);cyclin D1和MMP9的表达明显降低(P<0.05);细胞增殖与侵袭能力明显受到抑制(P<0.01)。结论:过表达DEC1可明显抑制ECA109细胞的增殖和侵袭能力,DEC1可能通过影响MMP9和cyclin D1参与其中。
DEC1基因; 食管癌; ECA109细胞; 细胞增殖; 细胞侵袭
食管癌是严重危害人类健康的恶性肿瘤,资料显示食管癌可能由多种因素致病[1-2],与患者的年龄、性别、职业、生活环境密切相关,由于缺乏有效的早期诊断及综合治疗,而导致目前食管癌患者总体病死率仍居高不下[3-4]。因此,寻找和开发新的治疗食管癌的方法和分子靶点是当前研究的重要课题。
分化型胚胎软骨发育基因1(differentiated embryo-chondrocyte expressed gene 1,DEC1)属于生长发育基因,参与软骨形成,神经发生,细胞的分化等生理过程,同时还参与了肿瘤的发生与发展,在肿瘤细胞的增殖、凋亡和分化起着重要作用[5-6]。近年来研究发现,DEC1在肺腺癌、乳腺癌和食管癌等多种肿瘤中高表达[7-8],且与缺氧诱导因子1α(hypoxia-inducible factor 1 alpha,HIF-1α)的表达显著相关[9],可能是肿瘤缺氧的直接标志[10]。本研究在此基础上,将已构建好的DEC1真核过表达质粒转染至食管癌ECA109细胞中,观察其对ECA109细胞的增殖和侵袭能力的影响,并探讨其可能机制。
材 料 和 方 法
1 主要试剂
兔抗人MMP9单克隆抗体购自北京博奥森公司;兔抗人cyclin D1单克隆抗体购自CST;兔抗人DEC1单克隆抗体购自Abcam;actin抗体购自Santa Cruz;HRP标记的羊抗兔IgG购自北京鼎国生物技术有限公司;Total RNA提取试剂盒购自Omega;脂质体转染试剂LipofectamineTM2000购自Invitrogen。
2 细胞培养
人食管癌ECA109 细胞株由我院肿瘤研究中心提供,由含10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的RPMI-1640培养液,37 ℃、5% CO2培养箱中培养,胰酶消化细胞,2~3 d传代1次,取对数生长期细胞实验。
3 实验方法
3.1 过表达DEC1质粒的构建与转染 根据DEC1基因在GenBank中cDNA序列(NM_003670.2)设计引物如下:P1:5’-TTTAAGCTTGCCACCATGGAGCG-GATCCCCAG-3’(含HindIII酶切位点);P2:5’-CCGGTCTAGAGTCTTTGGTTTCTAAGT-3’(含XbaI酶切位点),引物由上海生工生物工程技术公司合成。从ECA109细胞提取总RNA,反转录获得cDNA,以其为模板进行PCR扩增,切胶回收后,按照Invitrogen公司pcDNA3.1(-)说明书构建重组质粒,转化DH5α感受态大肠杆菌,挑选转化子,提取质粒,经酶切和测序鉴定pcDNA3.1(-)/DEC1构建成功。按照脂质体LipofectamineTM2000说明书操作,将pcDNA3.1(-)及pcDNA3.1(-)/DEC1,按质粒与脂质体质量比为1:2转染入ECA109细胞中,实验分组为DEC1组[pcDNA3.1(-)/DEC1]和vector组[pcDNA3.1(-)]。
3.2 Real-time PCR检测转染细胞中DEC1、cyclin D1和MMP9的mRNA表达水平 将转染48 h后的vector组和DEC1组细胞提取总RNA,按TaKaRa逆转录反应说明书合成cDNA,稀释10倍后进行real-time PCR,用于扩增DEC1的上游引物为5’-GGCGGGGAATAAAACGGAGCGA-3’,下游引物为5’-CCTCACGGGCACAAGTCTGGAA-3’;β-actin的上游引物为5’-AGCGAGCATCCCCCAAAGTT-3’,下游引物为5’-GGGCACGAAGGCTCATCATT-3’。反应条件为95 ℃ 3 min;95 ℃ 5 s,60 ℃ 15 s,72 ℃ 15 s,共39个循环。同一实验重复3次,实验数据分析采用2-ΔΔCt法计算。
3.3 Western blot 检测转染细胞中DEC1、cyclin D1和MMP9蛋白表达水平 提取各组ECA109细胞总蛋白,BCA法测定蛋白浓度,加入5×SDS上样缓冲液100 ℃ 5 min,每孔40 μg,80 V恒压SDS-PAGE,250 mA恒流2 h冰浴电转至PVDF膜,5%的脱脂牛奶室温封闭2 h,与特异性 I抗(DEC1 1∶2 000,MMP9 1∶1 000,cyclin D1 1∶1 000)4 ℃过夜,II抗孵育2 h后ECL化学发光并显影。
3.4 CCK-8实验 将转染24 h的各组细胞消化收集,按每孔2 000个接种于96孔板中,待细胞贴壁后记为0 h,分别在0 h、24 h、48 h、72 h、96 h加入10 μL CCK-8液,37 ℃孵育2 h后,在450 nm处测定吸光度。
3.5 平板集落实验 将转染24 h的各组细胞消化收集,按每孔1 000个接种于6孔板中37 ℃、5% CO2培养,2~3 d换液,10 d后取出,固定并结晶紫染色。
3.6 Transwell实验检测其迁移能力 将Matrigel胶4 ℃过夜后,无血清RPMI1640培养基按8∶1稀释并混匀,每Transwell小室上室均匀铺入60 μL混合液,37 ℃孵育2 h,将转染24 h的各组细胞消化收集并计数,加入含3% 胎牛血清培养基制成细胞悬液,以每孔2 000个(100 μL)加入上室中,下室加入含15% 胎牛血清的培养基,37 ℃、5% CO2培养箱中孵育24 h,棉签擦掉上室细胞,PBS洗3次,甲醇固定30 min,结晶紫染色10 min,PBS洗净,室温风干,光镜下随机选取3个视野计数。
4 统计学处理
采用SPSS 17.0统计学软件,计量资料用均数±标准差(mean±SD)表示,两组均数比较采用t检验,以P<0.05为差异有统计学意义。
结 果
1 转染细胞中过表达DEC1的鉴定
Real-time PCR和Western blot检测结果显示,DEC1组DEC1基因的表达水平明显高于vector组,差异有统计学意义(P<0.01),表明DEC1组的DEC1过表达,见图1、2。
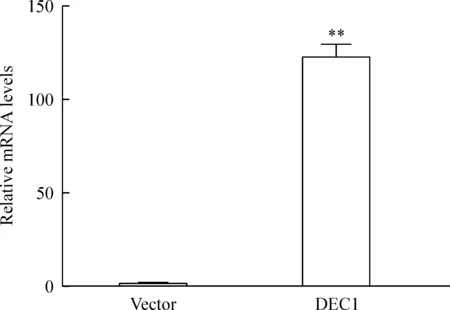
Figure 1.The mRNA expression of DEC1 in the ECA109 cells transfected with plasmid pcDNA3.1 (-)/DEC1 (DEC1 group) or pcDNA3.1 (-) (vector group) detected by real-time PCR. Mean±SD.n=3.**P<0.01vsvector group.
图1 Real-time PCR 检测DEC1 mRNA的表达
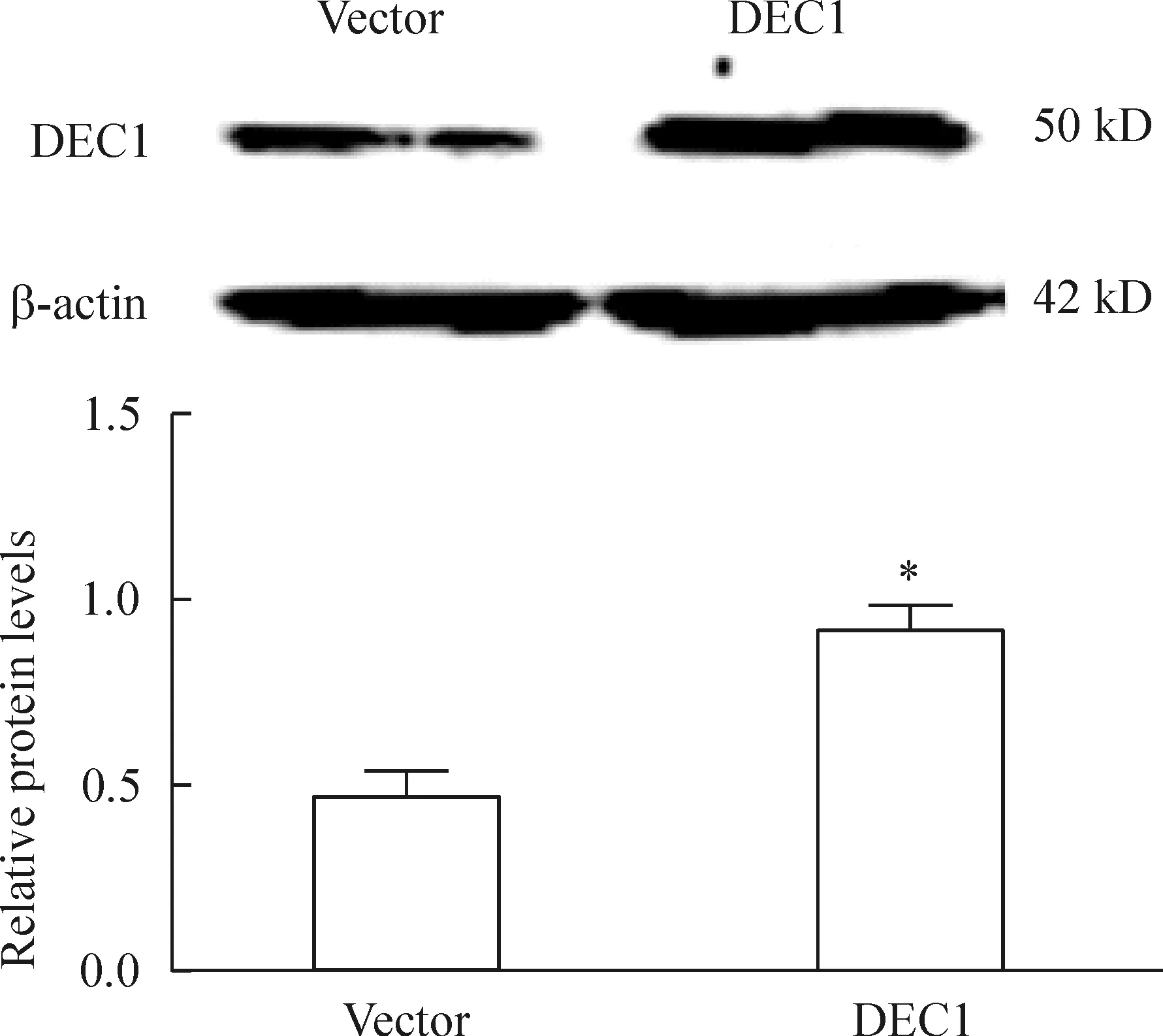
Figure 2.The protein expression of DEC1 in the ECA109 cells transfected with plasmid pcDNA3.1 (-)/DEC1 (DEC1 group) or pcDNA3. 1 (-) (vector group) detected by Western blot. Mean±SD.n=3.*P<0.05vsvector group.
图2 Western blot实验检测DEC1蛋白的表达水平
2 过表达DEC1对ECA109细胞生长能力的影响
CCK-8实验结果显示过表达DEC1基因后,ECA109细胞的生长明显受到抑制,差异具有统计学意义(P<0.01),说明过表达DEC1基因抑制了细胞的生长,见图3。
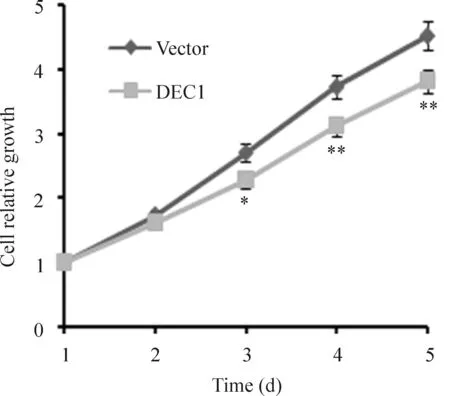
Figure 3.The growth curve of ECA109 cells transfected with plasmid pcDNA3.1 (-)/DEC1 (DEC1 group) or pcDNA3.1 (-) (vector group) evaluated by CCK-8 assay. Mean±SD.n=3.*P<0.05,**P<0.01vsvector group.
图3 CCK-8测定过表达DEC1基因对食管癌ECA109细胞生长的影响
3 过表达DEC1对ECA109细胞克隆形成能力的影响
平板集落实验结果显示,与vector组相比,DEC1组细胞克隆团数量明显减少(P<0.01),说明过表达DEC1后,ECA109细胞的克隆形成能力明显减弱,见图4。
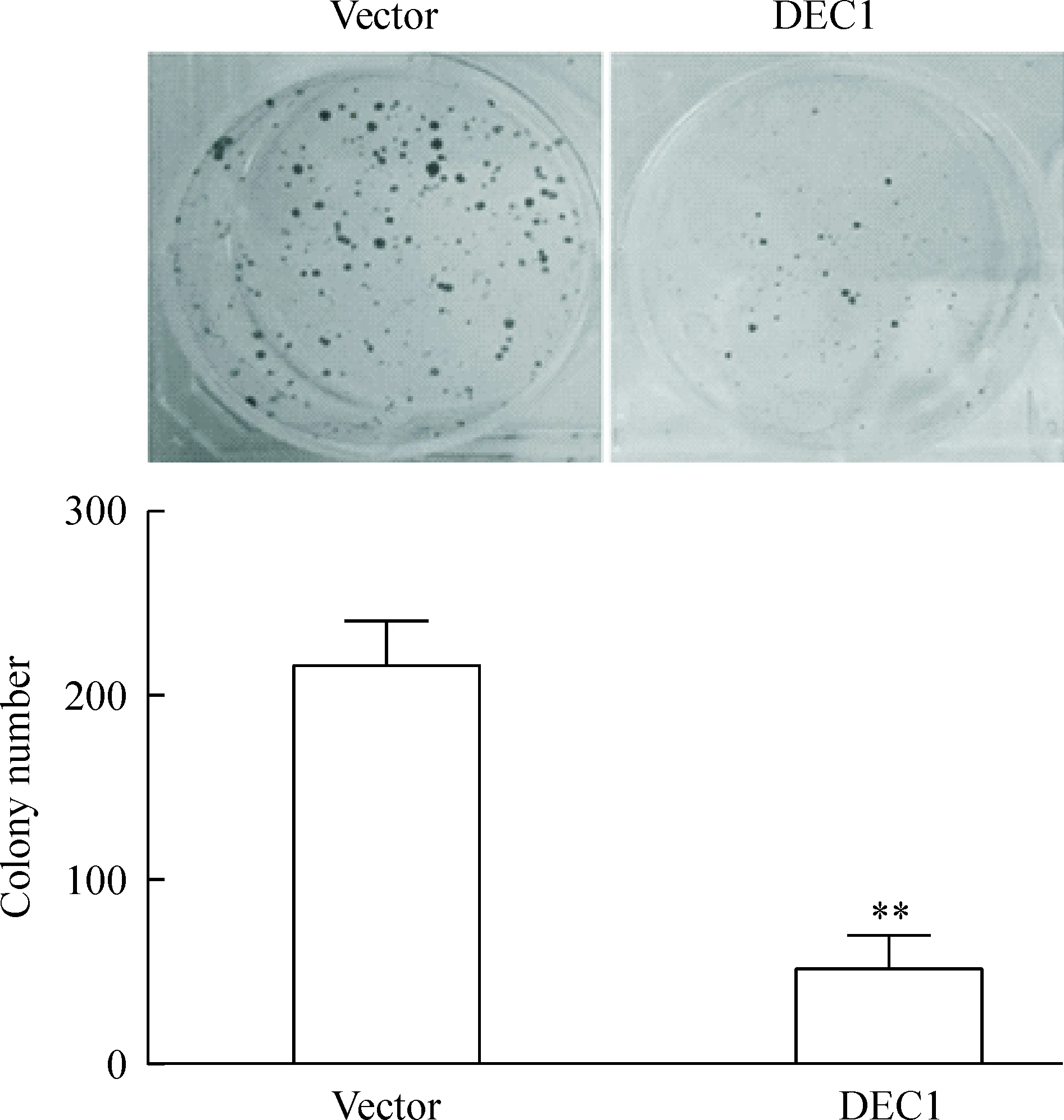
Figure 4.Colony-forming capacity of the ECA109 cells transfec-ted with plasmid pcDNA3.1 (-)/DEC1 (DEC1 group) or pcDNA3.1 (-) (vector group) detecded by colony formation assay. Mean±SD.n=3.**P<0.01vsvector group.
图4 平板集落实验检测过表达DEC1对ECA109细胞克隆形成能力的影响
4 过表达DEC1基因对ECA109细胞侵袭能力的影响
Transwell实验 结果显示,与vector组相比,DEC1组穿过基底膜的细胞数明显减少(P<0.05),说明过表达DEC1后ECA109细胞的侵袭能力减弱,见图5。
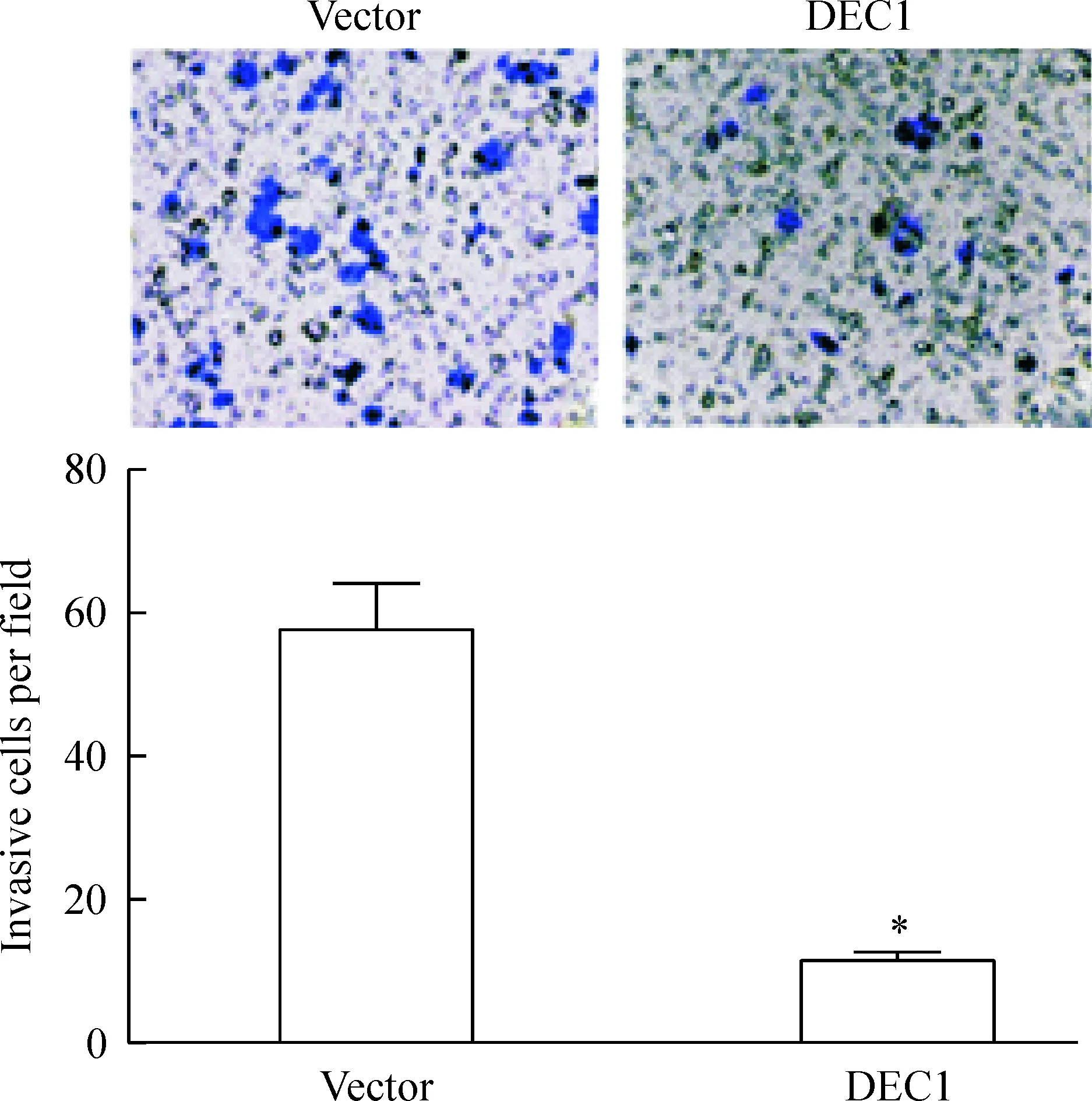
Figure 5.The invasion ability of the ECA109 cells transfected with plasmid pcDNA3.1 (-)/DEC1 (DEC1 group) or pcDNA3.1 (-) (vector group) determined by Transwell invasion assay (×200). Mean±SD.n=3.*P<0.05vsvector group.
图5 过表达DEC1基因对ECA109细胞侵袭能力的影响
5 过表达DEC1基因对ECA109细胞cyclin D1和MMP9表达的影响
Western blot检测结果显示,DEC1组的cyclin D1和MMP9蛋白表达水平明显低于vector组(图6),说明过表达DEC1基因能抑制cyclin D1和MMP9的表达。
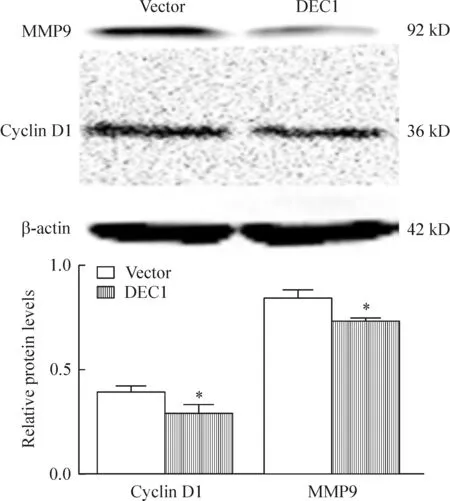
Figure 6.The protein expression of cyclin D1 and MMP9 in the ECA109 cells transfected with plasmid pcDNA3.1 (-)/DEC1 (DEC1 group) or pcDNA3.1 (-) (vector group) determined by Western blot. Mean±SD.n=3.*P<0.05vsvector group.
图6 过表达DEC1对cyclin D1和MMP9蛋白表达的影响
讨 论
DEC家族包括DEC1和DEC2, 都是碱性螺旋-环-螺旋(basic helix-loop-helix, bHLH)结构的转录因子。DEC1基因定位于人类染色体3p25.3-26 上, 大约5.7 kb,包括5个外显子4个内含子,其启动子区域包括多个GC盒,5’端区域有包括cAMP 应答元件及多个E-box在内的多个转录因子结合位点[11]。DEC1蛋白由412个氨基酸组成,定位于细胞核,广泛表达于软骨、肺、肠、脾等大多数正常组织,在脑、胰腺和肾中表达较少[12]。
转录因子DEC1在肿瘤中的表达模式存在组织特异性,其表达与肿瘤增殖的关系尚存争议,一方面研究资料表明在肺癌中沉默DEC1表达可以通过调控cyclin D1的表达进而抑制细胞增殖[8],而乳腺癌中高表达的DEC1通过下调claudin-1的表达促进乳腺癌细胞的侵袭[7],因此为了明确DEC1在肿瘤细胞中的生物学作用,深入研究不同肿瘤细胞中DEC1的表达调控模式至关重要。本研究通过过表达DEC1基因后研究其对食管癌的增殖和侵袭能力的影响并探讨其可能机制,通过CCK-8和平板集落实验表明,过表达DEC1基因后食管癌ECA109细胞的生长和克隆形成能力明显下降,而利用Transwell小室模型在体外模拟肿瘤细胞降解细胞外基质穿过基底膜的迁移过程,实验表明过表达DEC1使ECA109细胞的迁移能力明显下降,显示DEC1在食管癌中可能作为抑癌基因调控食管癌的发生发展。同时我们检测了过表达DEC1后cyclin D1与MMP9的表达,发现在其蛋白表达水平明显降低,cyclin D1与MMP9是调控肿瘤细胞增殖与侵袭的重要因子[14],也是TGF-β信号通路下游的调控因子,研究发现在胰腺癌中DEC1通过影响TGF-β通路进而调控上皮-间质转换的发生[13],提示我们DEC1可能通过活化TGF-β信号通路,进而调节食管癌的发生与发展。Xu等[15]在241例食管癌患者研究发现DEC1表达水平与食管癌患者年龄、食管鳞癌的浸润深度,淋巴结转移情况及pTNMs密切相关,且与食管癌患者的术后生存率显著相关,提示DEC1可能作为食管鳞癌的一个潜在预后指标,对其的研究更有助于食管癌的前期诊断与临床治疗。
综上所述,针对DEC1作为bHLH 类转录因子,是否可作为一个肿瘤标志物,能否作为关键靶点控制肿瘤发生发展,探寻其自身的表达调控及转录调节的机制研究作为今后的实验重点,而本实验以DEC1基因对食管癌细胞的增殖、侵袭能力的影响作为主要切入点进行研究,为明确DEC1基因功能及其是否可作为食管癌的治疗新靶点提供实验依据。
[1] Jemal A, Bray F, Center MM, et al. Global cancer statistics[J].CA Cancer J Clin, 2011, 61(2):69-90.
[2] 郭艳丽,郭 炜,邝 钢,等. 食管鳞状细胞癌中SFRP基因家族启动子区甲基化状态的检测[J]. 中国病理生理杂志, 2011, 27(2):278-283.
[3] Lu P, Yang X, Huang Y , et al. Antitumor activity of a combination of rAd2p53 adenoviral gene therapy and radiotherapy in esophageal carcinoma[J]. Cell Biochem Biophys, 2011, 59(3):147-152.
[4] Shimada H, Ochiai T. Gene therapy for esophageal squamous cell carcinoma[J]. Front Biosci, 2008, 13:3364-3372.
[5] Peng Y, Liu W, Xiong J, et al. Down regulation of diffe-rentiated embryonic chondrocytes 1 (DEC1) is involved in 8-methoxypsoralen-induced apoptosis in HepG2 cells [J].Toxicology, 2012, 301(1-3):58-65.
[6] Bhawal UK, Sato F, Arakawa Y, et al. Basic helix-loop-helix transcription factor DEC1 negatively regulates cyclin D1[J]. J Pathol, 2011, 224(3):420-429.
[7] Liu Y, Miao Y, Wang J, et al. DEC1 is positively asso-ciated with the malignant phenotype of invasive breast cancers and negatively correlated with the expression of claudin-1[J]. Int J Mol Med, 2013, 31(4):855-860.
[8] Liu Y, Wang L, Lin XY, et al. The transcription factor DEC1 (BHLHE40/STRA13/SHARP-2) is negatively associated with TNM stage in non-small-cell lung cancer and inhibits the proliferation through cyclin D1 in A549 and BE1 cells [J]. Tumour Biol, 2013, 34(3):1641-1650.
[9] Ma W, Shi X, Lu S, et al. Hypoxia-induced overexpression of DEC1 is regulated by HIF-1α in hepatocellular carcinoma[J]. Oncol Rep, 2013, 30(6):2957-2962.
[10]Li Y, Bi Z, Yan B, et al. UVB radiation induces expression of HIF-1alpha and VEGF through the EGFR/PI3K/DEC1 pathway[J]. Int J Mol Med, 2006, 18(4):713-719.
[11]Nishiwaki T, Daigo Y, Kawasoe T, et al. Isolation and mutational analysis of a novel human cDNA, DEC1 (deleted in esophageal cancer 1), derived from the tumor suppressor locus in 9q32[J]. Genes Chromosomes Cancer, 2000, 27(2): 169-176.
[12]Wykoff CC, Pugh CW, Maxwell PH, et al. Identification of novel hypoxia dependent and independent target genes of the von Hippel-Lindau (VHL) tumour suppressor by mRNA differential expression profiling[J]. Oncogene, 2000, 19(54):6297-6305.
[13]Wu Y, Sato F, Yamada T, et al. The BHLH transcription factor DEC1 plays an important role in the epithelial-mesenchymal transition of pancreatic cancer[J]. Int J Oncol, 2012, 41(4):1337-1346.
[14]秦瑞英,夏永华,任艳芳,等. AEG-1表达下调对人宫颈癌细胞细胞周期和侵袭能力的影响及其机制[J]. 中国病理生理杂志, 2013, 29(6):1020-1024.
[15]Xu Q, Ma P, Hu C, et al. Overexpression of the DEC1 protein induces senescenceinvitroand is related to better survival in esophageal squamous cell carcinoma[J]. PLoS One,2012, 7(7):e41862.
Effect ofDEC1 gene over-expression on proliferation and invasion abilities of human esophageal cancer ECA109 cells
YANG Chun-ping, WANG Hua-chuan, WEN Jian-hu
(DepartmentofCardiothoracicSurgery,ChongqingMedicalUniversity,Chongqing400016,China.E-mail:tiger001@163.com)
AIM: To investigate the effect ofDEC1 gene over-expression on the proliferation and invasion abilities of human esophageal cancer ECA109 cells. METHODS: ECA109 cells were transfected with plasmid pcDNA3.1 (-)/DEC1 (DEC1 group) or pcDNA3.1 (-) (vector group). The mRNA and protein levels of DEC1, cyclin D1 and MMP-9 were evaluated by real-time PCR and Western blot, respectively. The effects ofDEC1 over-expression on the proliferation and invasion abilities of the ECA109 cells were evaluated by CCK-8 assay, colony formation assay and Transwell test respectively. RESULTS: The DEC1 expression level in ECA109 cells in DEC1 group was significantly higher than that in vector group (P<0.01), but the levels of MMP9 and cyclin D1 expression were opposite (P<0.01). However, both the proliferation and invasion abilities of ECA109 cells in DEC1 groups decreased significantly as compared with those in vector group (P<0.05). CONCLUSION: The over-expression of DEC1 significantly inhibits the proliferation and invasion of ECA109 cells, which may be involved in the expression of cyclin D1 and MMP9.
DEC1 gene; Esophageal cancer; ECA109 cells; Cell proliferation; Cell invasion
1000- 4718(2015)04- 0620- 05
2014- 11- 20
2015- 01- 20
R735.1
A
10.3969/j.issn.1000- 4718.2015.04.008
△通讯作者 Tel: 023-89011132; E-mail: tiger001@163.com

