乳腺化生性癌18 例临床病理分析
黄克强 文亦磊 刘姗姗 叶星江 崔锦珠 欧海玲 张锡流
(广西中医药大学第一附属医院病理科,南宁市 530023,E-mail:41156749@qq.com)
乳腺化生性癌(metaplastic breast carcinoma,MBC)是一组罕见肿瘤。根据2012 年版WHO《乳腺肿瘤组织学分类》[1]规定的MBC 诊断标准,我院病理科在3 861 例乳腺癌中诊断MBC 18 例,占0.47%。为进一步加深对该肿瘤的认识,为病理诊断与临床治疗提供参考,本文结合苏木精-伊红染色(hematoxylin-eosin staining,HE)、免疫组化染色及临床资料,并复习相关文献,对该类肿瘤不同亚型的临床病理特征、免疫表型、诊断和鉴别诊断作较为全面的探讨。
1 资料与方法
1.1 临床资料 2008 年1 月至2013 年12 月我院病理科存档MBC 切片18 例,所有标本根据2012 年版WHO《乳腺肿瘤组织学分类》[1]规定的MBC 诊断标准,由两位病理医师复阅确诊。
1.2 方法 (1)收集患者的临床资料,复习HE 切片,并对患者进行随访。(2)18 例标本均用10%甲醛固定,常规脱水,石蜡包埋制片,常规HE 和免疫组化链霉菌抗生物素蛋白-过氧化物酶联结(streptavidin-perosidase,SP)法染色,DAB 显色。所用抗体包括广谱细胞角蛋白(pan-cytokeratin,P-CK)、上皮膜抗原(epithelial membrane antigen,EMA)、E-钙 黏 素(E-cadherin)、细 胞 角 蛋 白(cytokeratin,CK)5/6、CK7、CK14、CK34βE12、P36、雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、S-100、簇分化抗原(cluster of differentiation,CD)10、CD68、CD99、原癌基因人类表皮生长因子受体2(human epidermal growth factor receptor-2,HER2/C-erbB-2)、Ki-67,均为即用型抗体,购自上海长岛公司和福州迈新公司,按照说明书进行操作,所有标记均用磷酸盐缓冲液代替一抗作为空白对照。
2 结 果
2.1 临床资料 18 例均为女性,年龄37 ~75 岁,平均49 岁;均因乳腺包块就诊,就诊时病程2 ~6 个月;≤50岁10 例,>50 岁8 例;左乳12 例,右乳6 例;肿瘤直径≤5 cm 7 例,>5 cm 11 例;淋巴结转移6 例,无转移12 例;有脉管瘤栓7 例,无11 例。术前多诊断为纤维腺瘤或乳腺癌。就诊时腋窝淋巴结转移6 例,无远处转移。随访3 ~65 个月,平均23 个月。12 例随访过程中复发,其中10 例合并多处淋巴结转移(其中5 例死于肝、肺等全身多处器官转移),另6 例未见复发。
2.2 病理检查
2.2.1 目检:18 例均为乳腺根治术标本,肿物直径3 ~15 cm,平均6 cm。圆形、椭圆形至不规则结节状,边界多不清楚,无明显包膜。切面灰白、灰红、实性,质中、脆,或有砂砾感,3 例有囊腔形成,出血、坏死常见。4 例侵犯表皮。
2.2.2 镜检:7 例为纯上皮化生性癌,其中3 例只有鳞状细胞癌(图1)成分,细胞呈多角形,胞浆丰富,可见细胞间桥和单个细胞角化,但不见典型角化珠;另4 例由鳞状细胞癌和非特殊型浸润性癌构成,两种成分比例从30%至70%不等。10 例为伴间叶分化的化生性癌(图2 ~4),均可见非特殊型浸润性癌,其中4 例化生性成分为软骨肉瘤,5 例化生性成分为软骨肉瘤和骨肉瘤,1 例化生性成分为未分化肉瘤,伴有破骨样多核巨细胞。另1 例为梭形细胞癌,肿瘤细胞呈梭形,缺乏明确的腺癌或鳞癌分化。18 例均有显著核异型,出血、坏死、多核瘤巨细胞、瘤巨细胞易见,核分裂4 ~10 个/高倍镜视野。
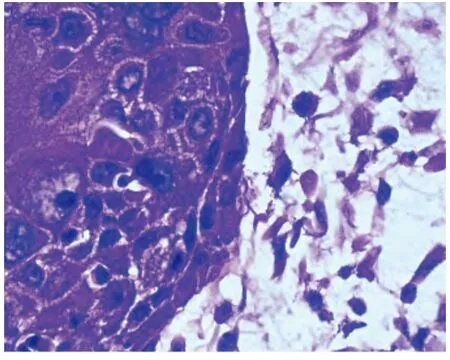
图1 鳞状细胞癌分化,显示癌巢内单个细胞角化及清楚的细胞间桥(HE,×400)
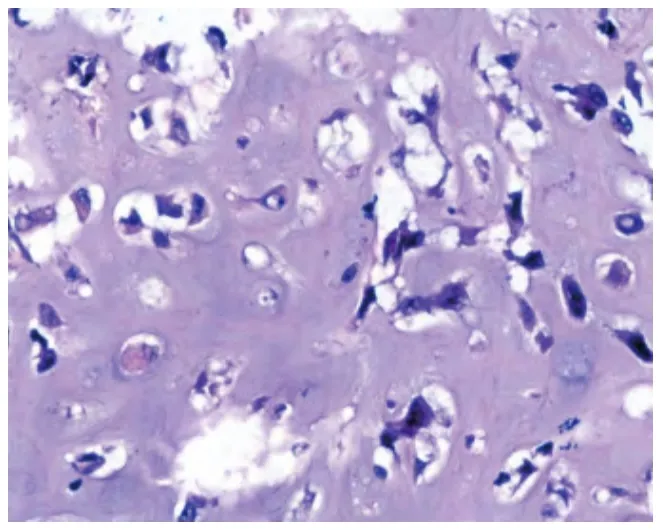
图2 软骨肉瘤分化,软骨细胞排列紊乱,伴有轻-中度异型(HE,×400)
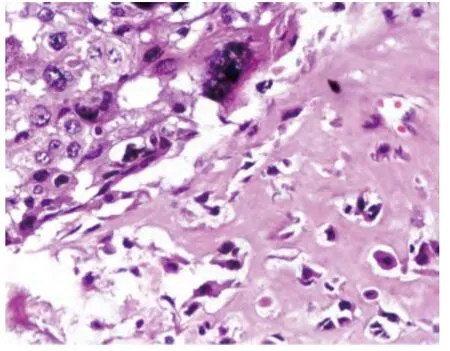
图3 骨肉瘤分化,伴有显著骨组织形成,左上导管癌区域细胞显著异型,可见核分裂和瘤巨细胞(HE,×400)
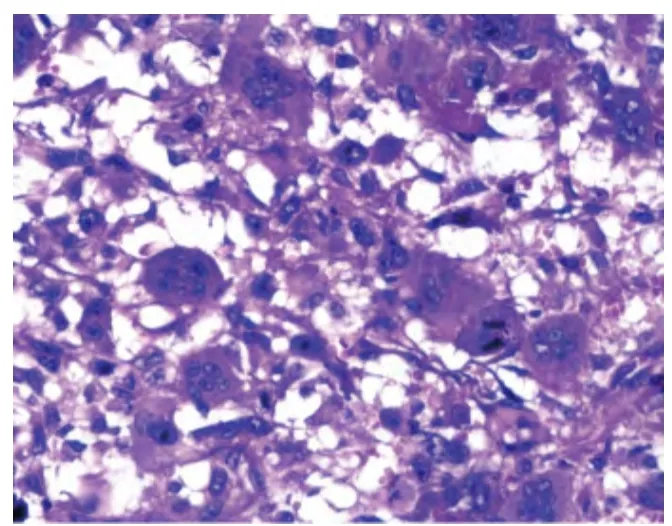
图4 异型的未分化肉瘤样肿瘤细胞与破骨样多核巨细胞混合存在,可见核分裂(HE,×400)
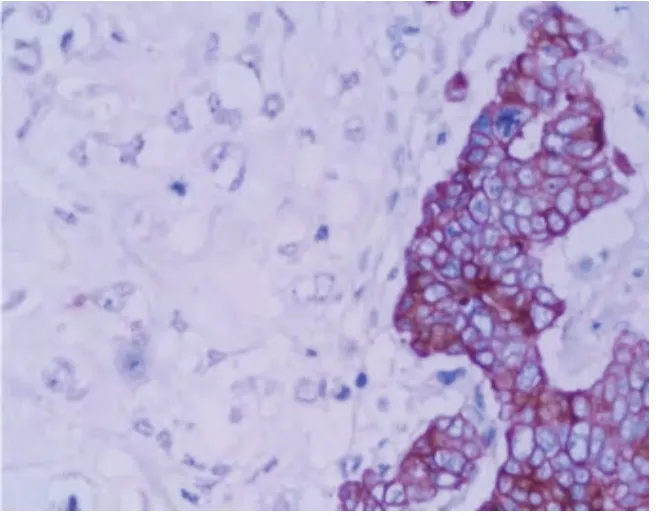
图5 免疫组化P-CK 上皮成分阳性,软骨肉瘤成分阴性(SP 法,×400)
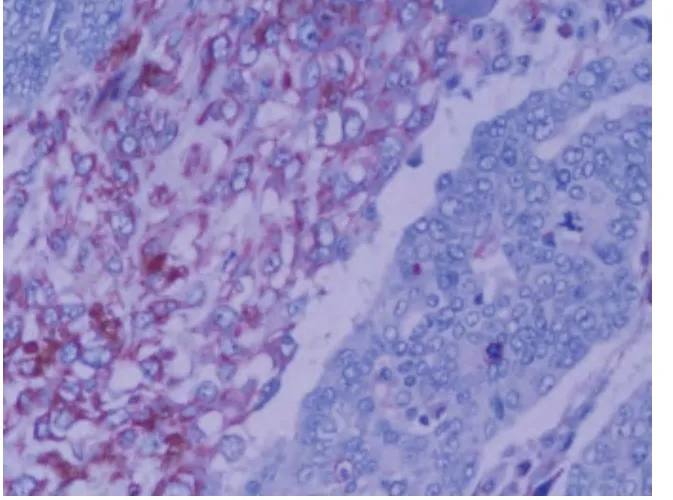
图6 免疫组化Vimentin 肉瘤样区域阳性,上皮成分阴性(SP 法,×400)
2.3 免疫组化 上皮成分表达P-CK(图5)、EMA、E-Cad、CK5/6、CK7、CK34βE12、CK14、P63 等,5 例非特殊浸润性癌成分ER、PR 阳性,波形蛋白(Vimentin)、CD10 灶状阳性;间叶成分表达Vimentin(图6)、S100、CD10、CD68、CD99 等;C-erbB-2 均阴性;Ki-67 增殖指数35%~90%。见表1。

表1 肿瘤成分及免疫组化结果
3 讨 论
MBC 占乳腺浸润性癌的比例小于1%,分为7 种类型[1]:(1)低级别腺鳞癌;(2)纤维瘤病样化生性癌;(3)鳞状细胞癌;(4)梭形细胞癌;(5)伴间叶分化的化生性癌(软骨样分化,骨样分化,伴间叶分化的其他类型);(6)混合性化生性癌;(7)肌上皮癌。
3.1 临床病理特征 本组病例中,有10 例(55.6%)患者年龄≤50 岁,平均49 岁,说明该肿瘤常发生于较年轻人群。多数患者因乳腺肿块而就诊,表现出与非特殊浸润性癌某些不同的特征[2],如肿瘤直径通常较大,淋巴结受累少,肿瘤细胞异型性大,核的级别高以及免疫组化染色激素受体和C-erbB-2 的阴性表达等。本组病例也显示了类似特征,其中1 例肿瘤体积达15 cm×10 cm×5 cm,而病程仅2 个月,说明该肿瘤生长速度迅速。本文有5 例伴软骨和骨肉瘤分化的肿瘤钼靶及X 线摄片观察到钙化或骨化。
3.2 诊断 术前超声及X 线检查无明显特异性,当肿瘤伴有囊性变、出血、坏死、钙化时,超声检查可观察到复杂回声。本文5 例伴有骨和(或)软骨肉瘤分化的化生性癌X 线显示不规则钙化,结合肿物生长迅速,影像学提示钙化或骨化者应高度怀疑化生性癌的可能。但此种改变在血肿以及脂肪坏死时均可出现,因此确诊尚需病理支持。本组病例中,13 例钼靶及X 线摄片考虑为非特殊型浸润性癌,4 例考虑为纤维腺瘤,仅1 例考虑化生性癌。57%的病例在穿刺镜检时能同时观察到非化生和化生性成分[3],本组病例根治术前均做了活检或术中快速冰冻切片检查,同时观察到化生和非化生性成分。
显微镜检,肿瘤中常见导管癌成分,少数非特殊浸润性癌亦可伴有局灶鳞状细胞分化,但混合明显鳞状细胞癌成分则属罕见[1]。本文3 例只由鳞状细胞所组成,可见角化及细胞间桥,诊断为鳞状细胞癌。4 例由鳞状细胞癌和非特殊型浸润性癌构成,部分区域显示腺管样结构。当浸润性癌中混有化生性的间叶成分时称伴间叶分化的化生性癌,本文10 例为该类型。间叶成分可为良性或恶性的骨、软骨组织,或为横纹肌肉瘤、脂肪肉瘤、纤维肉瘤、血管肉瘤等,当间叶成分为恶性时,2003年版WHO 分类称为癌肉瘤。同一肿瘤中出现多种化生性成分时,称为混合性化生性癌。肿瘤由单一的梭形细胞组成称为梭形细胞癌,一般缺少明确的鳞癌或腺癌分化。梭形细胞形态温和,松散、交错排列,常有纤维化或透明变性区域。低级别腺鳞癌由小腺管及实性上皮条索组成,浸润至梭形细胞间质。实性细胞巢常有明显鳞状上皮化生,间质成分可呈纤维瘤病样,或呈纤维化、硬化性改变。纤维瘤病样化生性癌表现类似软组织的纤维瘤病,为形态温和的梭型细胞呈波浪状、束状或编织状排列,伴有不同程度胶原化,并向周围的乳腺间质浸润性生长。新版分类中肌上皮癌被归入化生性癌,原因是在形态学与免疫组化表型与梭型细胞鳞癌相似,也没有证据显示两者有不同的生物学行为,但今后的研究有可能将两者区分。肿瘤的成分及各自比例对治疗、预后评估等方面有指导意义,因此病理诊断时应予详细说明。
化生性癌ER、PR、C-erbB-2 仅有少数病例表达,阳性率各约10%[4]。而P63 则表达于几乎所有MBC 的鳞癌成分,以及部分梭形细胞成分,可以作为辅助诊断的有用抗体[5]。本研究5 例非特殊型浸润性癌成分ER、PR 呈弱阳性表达,7 例伴有鳞癌成分的肿瘤均表达P63阳性。一般上皮性成分表达P-CK,腺癌可表达CK8/18,鳞癌表达CK5/6,CK14,梭型细胞癌表达CK7 等。间叶成分表达Vimentin,软骨、骨分化表达S100,CD99,破骨样细胞巨细胞CD68 阳性。部分肿瘤可呈上皮、间叶双向表达,肌上皮标记物如CK34βE12、抗平滑肌抗体(anti-smooth muscle antibody,SMA)在梭形细胞成分中表达的比率最高[6]。本组病例Ki-67 阳性指数较高,从35%~90%不等,与该类肿瘤生长速度较快有关。
3.3 鉴别诊断 化生性癌应与多种乳腺肿瘤鉴别,免疫组化有一定的辅助作用:(1)鳞状细胞癌的棘细胞松解型需与血管肉瘤鉴别,前者充分取材可发现局灶性鳞状细胞分化,鳞状细胞表达CK,血管肉瘤表达CD34 可供鉴别;梭形细胞癌、肌上皮癌需与各型间叶肿瘤鉴别,间叶组织Vimentin 阳性,肌上皮SMA 等阳性。(2)伴间叶分化的化生性癌和混合性化生性癌伴软骨分化时需与多形性腺瘤鉴别,前者缺乏肌上皮细胞,上皮成分恶性,异型性明显,后者上皮良性,周围总是有肌上皮细胞包绕;叶状肿瘤也可以伴有显著的骨和软骨肉瘤、平滑肌肉瘤、脂肪肉瘤等分化,需要与伴相应分化的化生性癌鉴别,多处取材可发现叶状肿瘤成分,且上皮成分为良性。伴有破骨样多核巨细胞的癌需与伴反应性肉芽肿或感染性肉芽肿的癌鉴别。纤维瘤病样化生性癌应与结节性筋膜炎、纤维瘤病鉴别。
3.4 治疗及预后 化生性癌腋窝淋巴结受累的概率比一般的乳腺癌要小[7],但恶性程度却更高,整体存活率明显偏低[8]。与文献报告相似,本文18 例患者初诊时6例淋巴结受累,组织学为鳞状细胞癌,而7 例伴间叶分化的化生性癌发现血管内瘤栓,说明该类型肿瘤具有早期血道转移潜能,与一般的肉瘤相似。预后不良的因素包括肿瘤直径较大、组织学上的异质性、更高的增殖指数和更低的分化程度等。预后与组织学类型的关系观点不一。有学者认为肿瘤预后与传统分型无关[9],可能与肿瘤中梭形细胞成分的级别有关[10],肉瘤型的肿瘤在伴有间叶分化的肿瘤中预后较差[11],肺、骨、脑是较常见的转移部位[12]。本组病例平均随访时间23 个月,12 例复发,其中10 例伴腋窝、锁骨上等多处淋巴结转移(5 例死于肺、肝等全身多处转移,5 例尚在随访中)。
由于ER、PR、C-erbB-2 表达率较低,甚至表达阳性者激素疗效并不理想。Bae 等[7]报告大部分接受辅助化疗的病人并没有任何生存优势,因此仍然没有成熟有效的治疗方案可供参考,多采用一般腺癌的化疗方案[13]。国内有学者认为,治疗方式是独立的预后因素,以乳腺根治性手术为主,辅以放疗或化疗的综合治疗是乳腺癌肉瘤最佳治疗方式[14]。表皮生长因子受体在化生性乳腺癌中的过表达[15],可能为其治疗提供新的靶点。
[1] Lakhani SR,Ellis IO,Schnitt SJ,et al.WHO classification of tumours of the breast[M].4th ed.Lyon:IARC Press,2012.
[2] 王红群,王庆梅,汤 旸,等.乳腺混合性上皮/间叶化生性癌临床病理观察[J].诊断病理学杂志,2012,19(6):454-456.
[3] Luini A,Aguilar M,Gatti G,et al.Metaplastic carcinoma of the breast,an unusual disease with worse prognosis:the experience of the European Institute of Oncology and review of the literature[J].Breast Cancer Res Treat,2007,101(3):349-353.
[4] Tse GM,Tan PH,Putti TC,et al.Metaplastic carcinoma of the breast:a clinicopathological review[J].J Clin Pathol,2006,59(10):1 079-1 083.
[5] Tse GM,Tan PH,Chaiwun B,et al.p63 is useful in the diagnosis of mammary metaplastic carcinomas[J].Pathology,2006,38(1):16-20.
[6] Kurian KM,Al-Nafussi A.Sarcomatoid/metaplastic carcinoma of the breast:a clinicopathological study of 12 cases[J].Histopathology,2002,40(1):58-64.
[7] Bae SY,Lee SK,Koo MY,et al.The prognoses of metaplastic breast cancer patients compared to those of triple-negative breast cancer patients[J].Breast Cancer Res Treat,2011,126(2):471-478.
[8] Jung SY,Kim HY,Nam BH,et al.Worse prognosis of metaplastic breast cancer patients than other patients with triplenegative breast cancer[J].Breast Cancer Res Treat,2010,120(3):627-637.
[9] Sakamoto G,Inaji H,Akiyama F,et al.General rules for clinical and pathological recording of breast cancer 2005[J].Breast Cancer,2005,12(Suppl):S1-27.
[10]Yamaguchi R,Horii R,Maeda I,et al.Clinicopathologic study of 53 metaplastic breast carcinomas:their elements and prognostic implications[J].Hum Pathol,2010,41(5):679-685.
[11]Tseng WH,Martinez SR.Metaplastic breast cancer:to radiate or not to radiate?[J].Ann Surg Oncol,2011,18(1):94-103.
[12]Esbah O,Turkoz FP,Turker I,et al.Metaplastic breast carcinoma:case series and review of the literature[J].Asian Pac J Cancer Prev,2012,13(9):4 645-4 649.
[13]Carlson RW,Allred DC,Anderson BO,et al.Breast cancer.Clinical practice guidelines in oncology[J].J Natl Compr Canc Netw,2009,7(2):122-192.
[14]杨艳芳,刘 君,方志沂,等.25 例乳腺癌肉瘤的临床特征和预后分析[J].中华肿瘤杂志,2012,34(8):620-623.
[15]Beatty JD,Atwood M,Tickman R,et al.Metaplastic breast cancer:clinical significance[J].Am J Surg,2006,191(5):657-664.

