DTI脑连接组在大脑疾病方面的研究进展
林岚,付振荣,张柏雯,宾光宇,高宏建,吴水才
北京工业大学 生命科学与生物工程学院,北京100124
DTI脑连接组在大脑疾病方面的研究进展
林岚,付振荣,张柏雯,宾光宇,高宏建,吴水才
北京工业大学 生命科学与生物工程学院,北京100124
DTI脑连接组分析通过集成DTI成像技术、图像处理方法和网络理论,使得我们可以通过DTI磁共振成像更真实地接近大脑网络的拓扑结构,帮助我们进一步了解脑组织结构和人类行为及认知间的关系。本文首先讨论了网络构建中的基本元素:DTI数据采集与处理、网络节点定义、网络中边的定义,以及网络分析的基本方法。随后本文就当前DTI脑连接组在一些脑部临床疾病(老年痴呆症、精神分裂症、多发性硬化症等)上的基本应用展开讨论。
磁共振成像;脑连接组;弥散张量成像;图论分析
专栏——脑连接组方法在健康老年人大脑认知中的研究
编者按:医学影像学、计算机技术和用于网络分析的数学工具近年来的飞速发展,使得我们可以在系统级别研究大脑的组成。Sporns 和Hagmann于2005年分别独立提出了脑连接组这个概念。所谓脑连接组是指从宏观(大脑脑区)到微观(单个神经元)各个层次上,与大脑结构连接或功能连接有关的(信息)汇集、映射和分析,可广泛用于大脑神经组织之间的相互作用的研究中。总投资4000万美元,用于研究1200名健康成年人的人脑连接组项目被2012年的《科学》杂志誉为2013年最值得关注六大科学领域之一。人脑的不同区域具有相对不同的功能,但要完成任何一项,哪怕是最简单的任务,也总是需要人脑多个不同的功能区域相互作用、互相协调,共同构成一个网络来发挥其功能。因此,从网络的角度来研究人脑的功能是极为必要的。现代脑成像技术和统计物理学,尤其是复杂网络理论的发展为人脑连接组的研究提供了必要的工具和分析的手段。本期专栏通过介绍DTI影像在大脑连接组研究中的进展,探究不同分析尺度对脑连接组分析结果的影响,建立大脑结构网络,从而分析年龄、疾病对大脑连接的影响等问题,并近一步探讨脑连接组方法在健康老年人大脑认知中的应用。

栏目主编:林岚
林岚,北京工业大学生物医学工程系副教授。从事运用神经影像学方法,研究与年龄相关的大脑认知退化方面的研究工作。2006年于美国亚利桑那州立大学获得生物工程博士学位。2006~2011年在美国亚利桑那州立大学和亚利桑那大学从事神经影像学方面的研究工作。运用现代神经图像处理与分析方法对健康人大脑的认知储备及阿兹海默症的发生、发展过程进行研究。2012年加入北京工业大学生物医学工程系。共发表科技论文60余篇,其中14篇文章被SCI/EI检索收录。现系[美]神经科学学会会员、[美] McKnight大脑研究学会会员。多年来还作为课题负责人和主要参与者完成了一项北京市自然科学基金,两项亚利桑那州基金,多项NIA(美国国家老年研究院基金)项目和NIH(美国国家卫生研究院基金)项目。
0 前言
在人类大脑的老化过程中,可能会受到各种类型的神经退行性疾病的伤害。不同类型的神经退行性疾病的病变部位和病因虽各不相同,但它们或多或少会导致脑组织的病变,并可以通过改变髓鞘或轴突变性对轴突的连接造成影响。对于此类相关疾病损伤的分析,一般可以通过感兴趣区的分析或者基于体素的形态学分析等方法,来对损伤的轴突区域进行确定,但这些方法无法确定疾病对脑白质网络的影响。人类大脑是宇宙中最为复杂的物质结构之一,它是由上百亿个神经元和与之相对应的更多的神经突触构成,想要了解它的微观连接与构造是十分困难的。Hagmann[1]和Sporns等[2]分别于2005年独立提出了脑连接组的概念。这一概念的提出,为人类探索大脑奥秘的过程提供了一个必不可少的基础。
目前,人脑连接组可以在三个不同的空间尺度上进行研究。它们分别是微尺度:指单独的神经元和突触;中尺度:指神经元集群和它们的连接模式;大尺度:指大脑脑区和它们的连接路径。虽然人的基因组在一出生就被决定了,但是人脑的连接组在人的整个生命周期中却在不断发生着变化。大脑连接组可以看作是由众多神经元、神经元集群或者多个脑区相互连接构成的复杂网络,并通过它们之间的相互作用完成各种认知功能。我们对于大脑神经系统疾病的研究不再仅仅局限于发病的具体脑区,而是逐渐开始关注神经纤维的连接通路、子网络和网络社区的连接以及大脑网络拓扑结构等问题与相关疾病的联系。大脑的认知基础是通过不同的神经网络相互交互构成的,所以从网络角度对各类疾病进行研究,可以帮助我们更好地认识各类大脑神经系统疾病的本质。
弥散张量成像(Diffusion Densor Imaging,DTI)是以水分子的弥散在不同的传播介质中呈现不同的方向和速率的原理为成像基础的成像方法[3]。它可定性定量地分析神经纤维的细微变化,直观地显示颅内病变与白质纤维之间的关系,在研究脑区间的连接以及白质纤维束的病理状态方面具有较大优势[4]。由于在脑组织内,水分子沿白质纤维走行方向的弥散速度快于垂直于白质的方向。基于此原理的DTI纤维追踪技术,可以无创性地显示出完整的大脑白质纤维束。
本文从弥散张量成像的基本原理出发,结合脑区分割和纤维追踪技术进行脑网络的构建,并进一步阐述了DTI脑连接组技术在多种脑疾病中的临床应用。
1 方法与技术
1.1 DTI影像
弥散是分子等微观颗粒由高浓度区向低浓度区的随机微观移动。在均匀介质中,分子可以自由弥散,这种弥散方式被称为各向同性。如图1所示,在脑脊液及大脑灰质中,由于组织结构的阻碍较少,水分子的弥散近似各向同性,向量分布轨迹成球形。但在大脑白质中,弥散各向异性,即垂直于神经纤维束走行方向的弥散最弱,而平行于神经纤维束的方向上的弥散是最强的,向量分布轨迹成椭球形。DTI就是基于此原理,通过测量生物组织结构中水分子的扩散速率,进而有效观察和追踪脑白质纤维束。目前常用的DTI成像技术是在自旋回波序列中180°脉冲两侧对称地各施加弥散敏感的梯度磁场。对于静止的水分子,第一个梯度脉冲所致的质子自旋散相会被第二个梯度脉冲重新汇聚,信号不降低。而当水分子沿梯度场进行弥散运动时,由于其自旋频率发生改变,相位分散不再被聚焦,信号降低。用相同的成像参数两次成像,分别使用和不用对弥散敏感的梯度脉冲,两次相减就剩下做弥散运动的质子在梯度脉冲方向上引起的信号下降的成分。
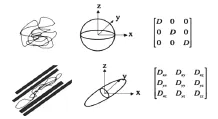
图1 灰质和白质的弥散描述(上图为灰质,下图为白质,从左到右分别为弥散轨迹、弥散椭圆和弥散张量)
张量是一个椭球形数学结构,有三维空间,各向异性有3×3个二级分量。弥散张量公式为:
2018年8月24日,中汽公益联盟爱心代表团队一行14人,自费前往“吉林省四平市梨树县林海镇王局子村希望小学”参加希望小学落成剪彩仪式。这是中汽公益联盟捐助的第四所中汽公益联盟希望小学。

A为敏感梯度施加方向上的图像强度,A0为未施加敏感梯度的图像强度,b为弥散敏感系数,D为弥散张量。通过反解(1)式可以求出弥散张量D的9个分量(3个分量是相同的,对称性)。对张量矩阵对角化可以获得3个特征值以及特征值对应的特征向量。特征值反应出椭球形的外形,大小与方向无关。主向量方向通常被作为张量所在体素的纤维走向。
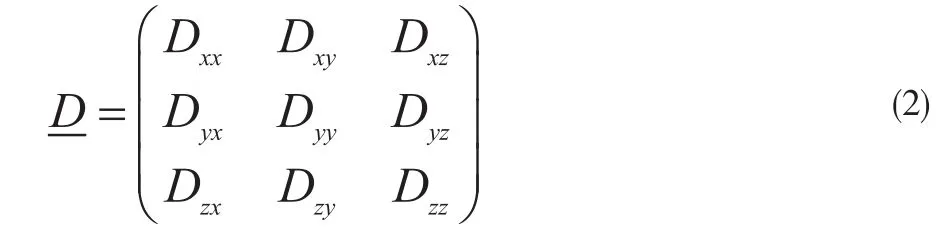
这个张量是对称的(Dij=Dji,i, j=x, y, z)
此时:
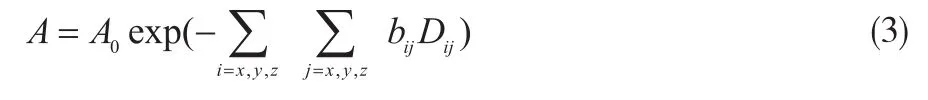
bij为弥散敏感系数矩阵中的元素。
DTI的影像研究需要我们了解磁共振成像采集技术、产生的伪影以及如何对它们进行处理。DTI数据采集中产生的伪影主要与梯度硬件系统、脉冲序列、采集策略和头部运动有关。DTI信号具有低信噪比和低分辨率和对头部运动敏感的特征。为了减少运动伪影的影响,需要减少扫描时间。常用的采集序列包括单次回波平面成像、快速自旋回波序列、线扫描扩散张量成像等,当然它们还存在各自的问题。由于张量元素对称性的特点,只需要六个不共线方向上的组织弥散系数,就可以求出张量的元素值。但在实际应用中,为了保证数据的可靠性,往往会选择更多不共线的梯度方向,然后使用最小二乘法求解。研究显示30个弥散梯度方向的编码图像在图像质量和采集时间上提供了一个较好的平衡[5]。采集过程中产生的伪影一般通过DTI图像预处理消除。预处理过程随所使用的处理流程不同而存在一定差异,但一般包括格式转换、头动和涡流校正、非脑组织去除和张量估计等。
定量计算可以从张量矩阵D中导出表示脑白质形态结构的标量信息。这些信息的定义和描述均是基于张量矩阵的特征值。主要包括:弥散张量轨迹、平均弥散率、相对各项异性、各向异性分数(Fractional Anisotropy,FA)、容积比等。根据主特征向量方向的不同,可将各个像素点赋予不同的颜色。彩色强度代表异向性的程度,颜色代表方向性。红色代表左右方向,绿色代表前后方向,蓝色代表上下方向的白质纤维(图2)。
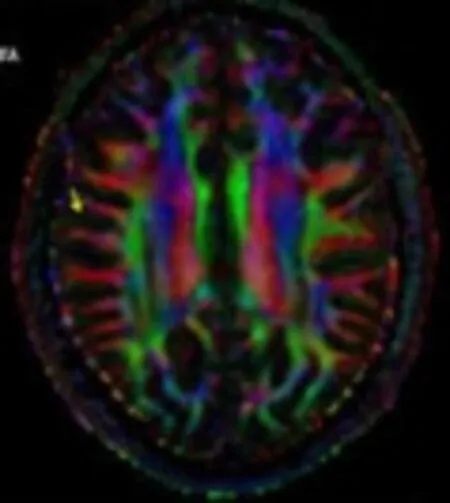
图2 DTI的颜色编码图
1.2 DTI脑网络构建
神经元间的结构性连接是脑功能连接的物质基础。通过高分辨率T1加权成像和DTI成像,我们可以构建大脑的结构连接网络,这种网络是一种宏观尺度的网络。脑网络构建中最基本的两个问题是如何定义网络节点以及如何定义边连接这些节点。大脑网络的节点往往根据脑功能区的划分确定。边一般为这些功能区间的相互关联程度[6]。各个功能区间的连接强度往往通过计算皮层厚度(或体积)的相关矩阵[7]或采用DTI纤维追踪算法提取连接各个脑区的神经纤维束[8]来确定。构建完成后的脑网络可以采用复杂网络的基本原理,通过两类度量指标(针对局部节点属性和针对总体组织属性的网络指标)分析,以期发现网络基本属性及节点间潜在的拓扑关系。
节点是网络模型中非常重要的组成部分,目前网络模型分析主要采用的是大尺度的脑网络。在大脑连接组的研究中,目前主要的方法就是利用一些比较成熟的大脑解剖或者功能图谱,如自动解剖标定(AAL)[9]、Harvard-Oxford 图谱(HOA)[10]、LONI 概率脑图谱(LPBA40)[11]等图谱进行感兴趣区分割,将该感兴趣区定义为网络的节点,它更多表现了节点间的关联性。然而,这种节点定义方法存在的问题是尽管多种方法被用于脑区划分,但还不存在金标准。不同脑区划分所取得的网络分析结果存在难以相互比较的问题[12],见图3。另一种定义节点的方法是抛开先验的结构信息,在不同的空间尺度上进行定义节点。它保持节点总体覆盖全脑,并定义具有相同体素数量的节点集合。该方法的关键问题为网络节点的数目。大量研究结果显示网络节点的数目会直接影响脑网络拓扑结构的描述,特别是和小世界相关的各种特性[13-14]。这种节点定义方法更多的体现了节点的独立性。
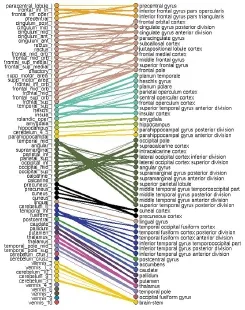
图3 二分图用于比较不同模板划分的高阶空间关系(左边为AAL模板,右边为HOA模板)
与网络中节点的定义一样,网络中边的定义也会对网络产生影响。在脑网络分析中,对于边的定义也有多种选择,连接的定义有有向和无向、有权和无权等多种方法。基于不同种类的影像数据,其边的定义方式也不同。从结构的角度来看,通过DTI可以重建不同脑区之间的白质纤维束,根据白质纤维的连接数量、长短、密度、强度以及局部特征(如FA等)可以定义连接的权重。纤维追踪算法通过挖掘DTI数据集中的张量信息来完整准确地追踪出纤维的走向。目前纤维追踪算法主要有确定性算法和概率性算法两大类。确定性算法主要通过局部张量信息进行纤维追踪来描绘白质纤维的走行方向。最初的纤维追踪是以种子点为起始点开始跟踪,根据该点的弥散信息确定纤维走向,沿该方向以一定步长进行延伸,以轨迹上另一点为种子点进行追踪,重复该步骤,直到满足终止条件。目前常用的确定性算法有纤维联络连续追踪算法[15]、张量弯曲算法[16]等。这些算法计算量小,主要不同点在于纤维延伸方向的确定。但由于使用的是不连续的张量域,经过不断积累,容易造成较大误差,出现追踪偏离纤维的真实走行方向。而且由于一个体素里面只有一条纤维,只能以一个弥散方向进行延伸,不能处理纤维分叉的问题。与确定性算法不同,概率纤维束跟踪算法[17]是在信号模型的基础上,将一个张量看作是各向异性与各向同性模型的合成形式,通过引入相关的概率算法完成张量求解。纤维束分叉计算的精确度取决于概率密度函数、体素是否相连等因素以及追踪模型。概率性算法的优点是其精度高于确定性算法,可以减少噪声和部分容积效应的影响,进行纤维束分叉的计算。其缺点为计算量大,不可避免地产生伪连接,在交叉上还需要进一步研究,而且数据获取的方式对交叉纤维束的追踪结果有一定影响。近几年来,随着数据采集新方法和图像处理新理论的出现,基于高角分辨率弥散成像(High Angular Resolution Diffusion Imaging,HARDI)[18-19]数据的跟踪算法成为该领域新的研究热点。HARDI 模型假设水分子弥散位移服从高斯分布,体素内水分子位移过程被描述为混合高斯模型,即不同成分的水分子弥散过程可由各自的张量表示,通过计算得到各成分弥散张量的本征方向和本征值。HARDI技术利用更多的成像时间来获取更精细的空间角度信息,它的突出特点是多梯度(至少40个以上的梯度)、大b值(实验室常用3000 s/mm3),成像时常采用多张量模型和Q-ball imaging技术。HARDI技术可选多个方向,并采用现有的各种算法进行追踪,能够对诸如交叉、分叉、扇型等复杂结构的纤维束较准确成像。
图论分析为大脑网络分析提供了一个强大的工具。通过图论,复杂的大脑系统可以被抽象成节点以及节点之间的关系。小世界模型是理解大脑结构组织机制的第一步,越来越多的定量网络拓扑分析指标被引入到脑网络的研究之中。脑网络拓扑指标主要包括整体和局部属性。整体属性主要有:最短路径长度、全局效率、聚类系数、模块性、网络弹性、大脑核心节点等;而局部节点的属性主要有节点中心度、度、介数中心度等。
2 DTI连接组在神经和精神疾病中的临床研究
2.1 轻度认知障碍和阿尔茨海默病
阿尔茨海默病(Alzheimer’s disease, AD)是一种起病隐匿的进行性发展的神经退行性疾病,临床表现为记忆、注意力、语言能力和一些高级认知功能下降及不断恶化。特征性病理改变为β淀粉样蛋白沉积形成的细胞外老年斑和τ蛋白过度磷酸化形成的神经细胞内神经原纤维缠结,以及神经元丢失伴胶质细胞增生等。在老龄化日趋显著的今天,AD已成为严重的社会公共卫生问题。在AD发病前,常会出现以记忆力丧失为特征的轻度认知障碍(Mild Cognitive Impairment,MCI)。MCI被认为是正常衰老和AD间的中间阶段。Lo等[20]认为,AD患者的白质网络具有小世界特征。相对于健康人,AD患者脑网络的特征路径长度增加,全局效率下降。同时,在AD患者的额叶区,网络的节点效率下降。AD患者脑区间特征路径长度的增加被认为是由于较远脑区间通讯效率降低造成的。而这种网络拓扑结构的大规模改变会损害人脑的高级认知功能。Shu等[21]通过对MCI患者的大脑网络进行分析,发现网络的拓扑特征和认知功能间存在显著相关。这表明认知功能的下降可能与特征路径长度的增加和网络拓扑结构的改变有关。Bai等[22]的研究表明,MCI患者的脑网络呈现出网络强度降低、全局效率下降、最短路径增加等一些特征。Prescott等[23]一项针对DTI脑网络的研究表明,AD患者脑网络拓扑结构的改变和大脑内β淀粉样蛋白的增加高度相关,并且这种相关早在AD的临床前阶段就出现了。总之,DTI脑网络分析技术可以作为传统临床诊断的一种重要补充,提高对早期AD的诊断率。
2.2 精神分裂症
精神分裂症(Schizophrenia,SCHZ)是一种常见的重性精神病,它的病因较为复杂,多起病于青壮年,终身患病率大概为3.8‰~8.4‰。患者一般意识清楚,智能基本正常,临床上往往表现为感知、思维、情感、意志行为等多方面障碍,精神活动与周围环境和内心体验不协调。基于SCHZ的大脑失连接假说被提出已有一个世纪了[24],神经影像学的不断发展,为证明这一假说提供了可能性。大脑的主要脑区都被卷入SCHZ的病理学中[25],应用脑连接组方法对其进行研究可进一步揭示疾病的发病机理。van den Heuvel等[26]的研究发现,SCHZ会影响额叶和颞叶脑区间的网络连通性。此外,病人额叶中心脑区的中央枢纽功能显著降低。Wang等[27]发现SCHZ会改变病人脑网络的拓扑结构属性,表现为网络的全局效率下降。在额叶联合皮层区、大脑的边缘系统和旁边缘系统区域以及皮层下结构脑区的中心脑区都出现局部网络效率下降。这些结果都可以支持失连接假说,表明疾病对大脑信息处理能力的损伤。
2.3 多发性硬化症
多发性硬化症(Multiple sclerosis,MS)[27]是一种慢性、炎症性、脱髓鞘的中枢神经系统疾病。MS逐渐造成大脑和脊髓的斑块性的脱髓鞘,影响神经轴突的信号传递,导致多部位的僵硬或功能丧失。MRI影像对于MS疾病管理非常有效[28]。Shu等[29]的研究显示MS患者的脑网络表现出节点强度、全局和局部网络效率的下降。网络效率的下降和白质损伤的程度以及病程显著相关。脑网络的损伤在感觉运动区、视觉区、默认模式网络区和语言区域更为明显。Li等[30]的研究发现MS患者和健康人在信息传输效率上的变化规律。其中左丘脑、壳核、胼胝体和扣带的信息传输效率的上升可能是大脑网络对疾病的一种补偿作用。
2.4 其它疾病
DTI脑连接组分析还被运用到多种其它疾病的研究之中。癫痫是大脑神经元突发性异常放电,导致短暂的大脑功能障碍的一种慢性疾病。脑电图一般在癫痫的诊断中起着重要的作用。图论分析结果显示癫痫病人的功能与结构的连接网络失去了最佳拓扑结构[31]。肌萎缩侧索硬化(Amyotrophic Lateral Sclerosis,ALS)也叫运动神经元病,是一种严重的神经退行性疾病。它有选择性地影响上运动神经元和下运动神经元,导致包括球部、四肢、躯干、胸部、腹部的肌肉逐渐无力和萎缩。研究发现ALS患者的聚类系数和全局效率呈现减小的趋势,疾病主要针对运动神经的连接[32]。抑郁狂躁型忧郁症患者脑部运作方式和精神分裂类似,以分散无连续性的思维为主要症状之一。研究显示抑郁狂躁型忧郁症患者具有较长的特征路径长度、较低的聚类系数和全局效率[33]。对外伤性脑损伤的研究发现,病人的节点中心度、特征路径长度上升,而网络局部效率下降[34]。
3 结论
DTI成像和图论分析方法的最新进展,使得我们可以从复杂网络这个新的角度分析和理解大脑。本文讨论了DTI连接组的发展现状和存在的一些问题,DTI连接组可以帮助我们从一个新的视角理解多种神经疾病的病理和生理机制。人脑是一个高效复杂的“小世界”网络,不同的状态或疾病都会导致网络属性异常。通过对多种疾病的比较,我们发现它们都有着相似的全局网络特性,如网络全局效率的下降和特征路径长度的加长。而这往往也代表着认知能力的下降。各类神经疾病与脑网络的异常拓扑结构变化间,存在着广泛的联系。脑网络作为一种重要的分析手段,为神经疾病的诊断提供了新的视脚。当然,DTI脑连接组是一个仍然在发展的科学领域,分析方法和分析结果还存在一些不够成熟的地方。包括节点及边的合理定义、脑网络的可解释性以及脑网络的比较等。目前,脑功能和结构网络之间关系的研究结果表明,存在结构连接的脑区间存在功能连接的概率也比较高,但是反过来,存在功能连接的脑区间同时存在结构连接的概率则不那么高。那么结构脑网络是如何塑造功能网络的?未来,我们认为DTI大脑连接组可以用来进一步分析疾病对脑局部网络、功能区域的影响,并作为一种重要的影像标志物用来监控疾病的严重程度、治疗效果以及早期预测。
[1] Hagmann P.From Diffusion MRI to Brain Connectomics[D].Lausanne:Ecole Polytechnique Fédérale de Lausanne (EPFL),2005.
[2] Sporns O,Tononi G,Kötter R.The human connectome:a structural description of the human brain[J].PLoS Comput Biol,2005,1(4): e42.
[3] Le Bihan D,Mangin JF,Poupon C,et al.Diffusion Tensor Imaging:Concepts and Applications[J].J Magn Reson Imaging, 2001,13(4):534-546.
[4] 陈美玲,许秀峰,程宇琪等弥散张量成像在神经科学领域的应用[J].国际精神病学杂志,2009,(3):171-174.
[5] Jones DK.The effect of gradient sampling schemes on measures derived from diffusion tensor MRI:a Monte Carlo study[J].Magn Reson Med,2004,51(4):807-815.
[6] Bullmore E,Sporns O.Complex brain networks:graph theoretical analysis of structural and functional systems[J].Nat Rev Neurosci, 2009,10(3):186-198.
[7] He Y,Chen ZJ,Evans AC.Small-world anatomical networks in the human brain revealed by cortical thickness from MRI[J].Cereb Cortex,2007,17(10):2407-2419.
[8] Jones DK.Studying connections in the living human brain with diffusion MRI[J].Cortex,2008,44(8):936-952.
[9] Tzourio-Mazoyer N,Landeau B,Papathanassiou D,et al.Automated Anatomical Labeling of activations in SPM using a Macroscopic Anatomical Parcellation of the MNI MRI single-subject brain[J].NeuroImage,2002,15(1):273-289.
[10] Desikan RS,Ségonne F,Fischl B,et al.An automated labeling system for subdividing the human cerebral cortex on MRI scans into gyral based regions of interest[J].Neuroimage,2006,31(3): 968-980.
[11] Shattuck DW,Mirza M,Adisetiyo V,et al.Construction of a 3D probabilistic atlas of human cortical structures[J].Neuroimage, 2008,39(3):1064-1080.
[12] Bohland JW,Bokil H,Allen C B,et al.The Brain Atlas Concordance Problem:Quantitative Comparison of Anatomical Parcellations[J].PLoS One,2009,4(9):e7200.
[13] Romero-Garcia R,Atienza M,Clemmensen LH,et al.Effects of network resolution on topological properties of human neocortex[J].Neuroimage,2012,59(4):3522-3532.
[14] Zalesky A,Fornito A,Harding IH,et al.Whole-brain anatomical networks:does the choice of nodes matter?[J].Neuroimage, 2010,50(3):970-983.
[15] Mori S,Crain BJ,Chacko VP,et al.Three-dimensional tracking of axonal projections in the brain by magnetic resonance imaging[J].Ann Neurol,1999,45(2):265-269.
[16] Chou MC,Wu ML,Chen CY,et al.Tensor deflection (TEND) tractography with adaptive subvoxel stepping[J].J Magn Reson Imaging,2006,24(2):451-458.
[17] Yamada K,Sakai K,Akazawa K,et al.MR tractography:a review of its clinical applications[J].Magn Reson Med Sci,2009,165-174.
[18] Xie S,Zuo N,Shang L,et al.How Does B-Value Affect HARDI Reconstruction Using Clinical Diffusion MRI Data?[J].PLoS One,2015,10(3):e0120773.
[19] Dudink J,Pieterman K,Leemans A,et al.Recent advancements in diffusion MRI for investigating cortical development after preterm birth-potential and pitfalls[J].Front Hum Neurosci,2015,8:1066.
[20] Lo CY,Wang PN,Chou KH,et al.Diffusion tensor tractography reveals abnormal topological organization in structural cortical networks in Alzheimer's disease[J].J Neurosci,2010,30(50): 16876-16885.
[21] Shu N,Liang Y,Li H,et al.Disrupted topological organization in white matter structural networks in amnestic mild cognitive impairment:relationship to subtype[J].Radiology,2012,265(2): 518-527.
[22] Bai F,Shu N,Yuan Y,et al.Topologically convergent and divergent structural connectivity patterns between patients with remitted geriatric depression and amnestic mild cognitive impairment[J].J Neurosci,2012,32(12):4307-4318.
[23] Prescott JW,Guidon A,Doraiswamy PM,et al.The Alzheimer structural connectome:changes in cortical network topology with increased amyloid plaque burden[J].Radiology,2014,273 (1):175-184.
[24] Friston KJ.The disconnection hypothesis[J].Schizophr Res, 1998,30(2):115-125.
[25] Shenton ME,Dickey CC,Frumin M,et al.A review of MRI findings in schizophrenia[J].Schizophr Res,2001,49(1):1-52.
[26] van den Heuvel MP,Mandl RC,Stam CJ,et al.Aberrant frontal and temporal complex network structure in schizophrenia:a graph theoretical analysis[J].J Neurosci,2010,30(47):15915-15926.
[27] Wang Q,Su TP,Zhou Y,et al.Anatomical insights into disrupted small-world networks in schizophrenia[J].Neuroimage, 2012,59(2):1085-1093.
[28] Compston A,Coles A.Multiple sclerosis[J].Lancet,2008,372 (9648):1502-1517.
[29] Shu N,Liu Y,Li K,et al.Diffusion tensor tractography reveals disrupted topological efficiency in white matter structural networks in multiple sclerosis[J].Cereb Cortex,2011,21(11): 2565-2577.
[30] Li Y,Jewells V,Kim M,et al.Diffusion tensor imaging based network analysis detects alterations of neuroconnectivity in patients with clinically early relapsing-remitting multiple sclerosis[J].Hum Brain Mapp,2013,34(12):3376-3391.
[31] Zhang Z,Liao W,Chen H,et al.Altered functional-structural coupling of large-scale brain networks in idiopathic generalized epilepsy[J].Brain,2011,134(Pt 10):2912-2928.
[32] Verstraete E,Veldink JH,Mandl RC,et al.Impaired structural motor connectome in amyotrophic lateral sclerosis[J].PLoS One,2011,6(9):e24239.
[33] Leow A,Ajilore O,Zhan L,et al.Impaired inter-hemispheric integration in bipolar disorder revealed with brain network analyses[J].Biol Psychiatry,2013,73(2):183-193.
[34] Caeyenberghs K,Leemans A,De Decker C,et al.Brain connectivity and postural control in young traumatic brain injury patients:a diffusion MRI based network analysis[J].Neuroimage,2012,1(1): 106-115.
Recent Advances in DTI Connectomes of Brain Diseases
LIN Lan, FU Zhen-rong, ZHANG Bai-wen, Bin Guang-yu, GAO Hong-jian, WU Shui-cai
College of Life Science and Bioengineering, Beijing University of Technology, Beijing 100124, China
Analyzing the DTI (Diffusion Tensor Imaging) connectomes in vivo has become feasible through the integration of DTI imaging techniques, image processing, and network theory, which brings DTI brain imaging closer to the topology of brain network and helps us to learn more about the relationship among the brain structure, human behavior and cognition. In this review, the basic elements for the brain network are fi rstly discussed: DTI data acquisition and processing, the de fi nition of network nodes and edges, as well as the network analysis method. Then, application of DTI connectomes in several clinical brain diseases (Alzheimer’s disease, schizophrenia, multiple sclerosis, etc) are explored.
MRI; connectomes; diffusion tensor imaging; graph theory
R197.39
A
10.3969/j.issn.1674-1633.2015.06.001
1674-1633(2015)06-0001-06
2015-03-05
北京市自然科学基金(7143171)资助。
林岚,副教授 。
通讯作者邮箱:lanlin@bjut.edu.cn

