三结构域包含蛋白29对鼻咽癌细胞生长和迁移的影响*
龙璐,王堃,陈贞,朱乐攀,易斌
(中南大学湘雅医院 检验科,湖南 长沙410008)
鼻咽癌(nasopharyngeal carcinoma,NPC)是我国南部最常见的恶性肿瘤之一,由于其早期病灶小,症状不典型,易忽略及误诊[1],具有恶性程度高及易发生浸润转移的特点,病死率很高,严重威胁人们的身体健康和生命安全。侵袭和转移是恶性肿瘤致死的根本原因。因此,筛选NPC转移相关蛋白(基因),早期判断NPC的转移是降低死亡率的关键所在。
本课题组前期采用定量蛋白质组学技术研究发现,三结构域包含蛋白29(tripartite motif-containing protein 29,TRIM 29)、死骨片蛋白-1(sequestosome-1,SQSTM 1)、根蛋白(radixin,RDX)在高转移潜能鼻咽癌细胞5-8F中和低转移潜能鼻咽癌细胞6-10B中均表达上调。大量研究证实[2-5],这3个基因与肿瘤的发生和转移密切相关,但其在鼻咽癌研究中尚未见报道。因此,本文采用5-8F和6-10B两株不同转移潜能的鼻咽癌细胞系,检测其TRIM 29、SQSTM 1、RDX基因的mRNA和蛋白表达水平,并在该基础上进一步研究TRIM 29对5-8F细胞增殖及迁移能力的影响,为以后深入研究其与NPC转移的关系提供理论和实验依据。
1 材料与方法
1.1 材料
1.1.1 细胞系 高转移潜能鼻咽癌细胞系5-8F和低转移潜能鼻咽癌细胞系6-10B,由卫生部肿瘤蛋白质组学重点实验室提供。
1.1.2 主要试剂 小牛血清和流式单染试剂碘化丙锭(PI)购自Gibco公司,RPMI 1640购自Hyclone公司,脂质体2000和G418购自Invitrogen公司,PVDF膜和Luminata Crescendo Western HRP Substrate发光液购自Millipore公司,四甲基噻唑蓝(MTT)购自Sigma公司,鼠抗人SQSTM 1抗体和鼠抗人TRIM 29抗体购自Santa Cruz公司,兔抗人RDX抗体、HRP标记的羊抗鼠IgG抗体和HRP标记的羊抗兔IgG抗体购自Abcam公司,鼠抗人β-actin抗体购自Auragene公司,TRIM 29、SQSTM 1、RDX基因及内参GAPDH引物均由上海吉凯公司合成。
1.2 方法
1.2.1 细胞培养 5-8F细胞和6-10B细胞用含12%小牛血清的RPMI 1640培养基,于37℃、5%二氧化碳恒温培养箱中培养。
1.2.2 qRT-PCR 检测TRIM 29、SQSTM 1、RDX基因的mRNA 表达水平 TRIM 29上游引物5'-T GCGAGCTGCATCTCAAGC-3',下游引物5'-GGTGC TATGATTCTTGTGCTCC-3',扩增片段长度为189 bp;SQSTM 1上游引物5'-GACTACGACTTGTGTAGCGT C-3',下游引物5'-AGTGTCCGTGTTTCACCTTCC-3',扩增片段长度为139 bp;RDX上游引物5'-GAGATGAAACCAAGAAAACAC-3',下游引物5'-CTCACAT TGCTTCAAACTCA-3',扩增片段长度为138 bp;内参GAPDH上游引物5'-TGACTTCAACAGCGACACC CA-3',下游引物5'-CACCCTGTTGCTGTAGCCAAA-3',扩增片段长度为121 bp。反应条件:95℃3min,95℃30 s,53℃20 s,72℃30 s,47个循环。
1.2.3 Western blot 检 测TRIM 29、SQSTM 1、RDX 蛋白表达水平 上样量30μg。10%SDS-PAGE电泳,60 V电泳40min,待样品进入分离胶后电压调至120 V继续电泳约90min,100 V转膜60min,5%脱脂奶粉封闭2 h,一抗(TRIM 29 1︰200、SQSTM1 1︰100、RDX1︰2 500、β-actin 1︰2 500)4℃孵育过夜,二抗1︰12 000孵育90min,加适量发光液,用Chem-iDocTMXRS+System with Image LabTMSoftware进行自动发光成像。
1.2.4 s iR NA 的设计与合成 根据NCBI GenBank中TRIM 29基因(NM_012101)信息,按照siRNA干扰片段设计原则设计siRNA序列,由上海吉凯公司合成。上游引物:5'-GATCCCCCATCGCTATGTGAAC AACTACTCGAGTAGTTGTTCACATAGCGATGGTTT TTGGAT-3',下游引物:5'-AGCTATCCAAAAACCAT CGCTATGTGAACAACTACTCGAGTAGTTGTTCACA TAGCGATGGGG-3';空白质粒表达载体序列:TTCT CCGAACGTGTCACGT。BLAST序列分析证明所设计的序列与人其他编码序列无同源性。
1.2.5 细胞转染、分组及筛选阳性细胞 设对照组(只加脂质体)、空白质粒对照组及TRIM 29特异性siRNA组。转染步骤按脂质体2000转染试剂盒说明书进行。转染结束后挑取克隆,Western blot验证是否为阳性细胞。
1.2.6 MTT 检测细胞增殖能力 将各组细胞以2 000个/孔的浓度接种于96孔板,MTT检测7 d。490 nm处测定各孔吸光度值,绘制细胞生长曲线。实验重复3次。
1.2.7 流式细胞仪检测细胞周期 收集各组细胞1瓶,PBS洗涤3次,用预冷的70%乙醇充分混匀细胞,4℃固定24 h,制成细胞悬液,与Tris-HCl缓冲液(含20μg/ml RNA酶)混匀,37℃孵育30min,加50μg/m l碘化丙锭(PI)染液染色细胞DNA。实验重复3次。
1.2.8 细胞划痕实验检测细胞体外迁移能力 5×105个细胞接种于6孔板,常规培养,待细胞生长至90%左右汇合时,吸弃培养基,用200μl的Tip头在皿底画4条平行线,PBS清洗3遍,加入无血清培养基培养,于0、24和48 h倒置显微镜观察拍照。利用Image J 1.46软件对缩窄距离进行分析,按照以下公式计算细胞的迁移率。迁移率=(初始划痕宽度值-相应点划痕宽度值)/初始划痕宽度值×100%。实验重复3次。
1.3 统计学方法
采用SPSS 17.0统计软件进行数据分析,实验数据以均数±标准差(±s)表示,两样本比较用两独立样本t检验,多组样本比较用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 qRT-PCR检测5-8F和6-10B中TRIM 29、SQSTM 1、RDX基因的m RNA表达水平
以5-8F细胞为参照,根据PCR各样本的Ct值,运用2-ΔΔCt法,相对于参照基因表达倍数为2-ΔΔCt,根据2-ΔΔCt做两组细胞的基因相对折合表达量分析(见图1)。结果显示,TRIM 29、SQSTM 1 mRNA表达水平在5-8F细胞中显著高于6-10B细胞,RDX mRNA表达水平在5-8F细胞中显著低于6-10B细胞,差异均有统计学意义(P<0.05)。
2.2 Western blot检测5-8F和6-10B中TRIM 29、SQSTM 1、RDX基因的蛋白表达水平
5-8F细胞中TRIM 29、SQSTM 1的蛋白表达水平明显高于6-10B细胞,差异有统计学意义(P<0.05),结果不仅证实了课题组前期的定量蛋白质组学研究结果,也提示TRIM 29、SQSTM 1与NPC细胞的侵袭转移相关;但两种细胞中RDX的蛋白表达水平差异无统计学意义(P>0.05),与本研究前期的定量蛋白质组学结果不一致,见图2。
2.3 TRIM 29特异性siRNA质粒表达载体抑制TRIM 29蛋白表达

图1 TRIM 29、SQSTM 1、RDX在5-8F和6-10B细胞中的mRNA表达水平

图2 TRIM 29、SQSTM 1和RDX在5-8F和6-10B细胞中的蛋白表达水平
根据3种基因在不同转移潜能鼻咽癌细胞系中的表达水平检测结果,课题组对TRIM 29做进一步研究。构建TRIM 29特异性siRNA质粒表达载体并将其转染5-8F,使TRIM 29表达沉默,Western blot验证转染效果。与未转染的5-8F及转染空白载体的5-8F细胞比较,转染了干扰质粒的5-8F细胞TRIM 29表达水平明显降低;未转染的5-8F和转染空白载体的5-8F细胞比较,TRIM 29表达水平差异无统计学意义,证明转染成功。见图3。细胞增殖能力结果见表1及图4。由结果可见,各组细胞第0天的吸光度值基本一致(P>0.05),从第1天开始,5-8F/Si-TRIM 29细胞的吸光度值与5-8F细胞、5-8F/NC细胞比较,差异均有统计学意义(P<0.05),提示从第1天起5-8F/Si-TRIM 29细胞增殖速度明显减慢;5-8F细胞与5-8F/NC细胞的MTT吸光度值比较差异均无统计学意义(P>0.05)。

图3 Western blot检测TRIM 29蛋白表达水平
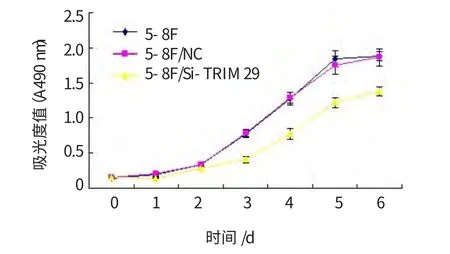
图4 MTT检测3种细胞增殖
2.4 MTT检测细胞增殖能力
MTT检测5-8F、5-8F/NC和5-8F/Si-TRIM 29
表1 MTT检测3种细胞增殖的吸光度值(A490 nm) (±s)

表1 MTT检测3种细胞增殖的吸光度值(A490 nm) (±s)
注:†与5-8F和5-8F/NC比较,P<0.05
细胞株 第0天 第1天 第2天 第3天 第4天 第5天 第6天5-8F 0.145±0.011 0.190±0.028 0.337±0.014 0.772±0.049 1.277±0.093 1.842±0.119 1.876±0.065 5-8F/NC 0.150±0.009 0.206±0.028 0.340±0.035 0.790±0.054 1.287±0.080 1.749±0.129 1.863±0.121 5-8F/Si-TRIM 29 0.155±0.014 0.148±0.004†0.287±0.037†0.407±0.046†0.777±0.076†1.220±0.074†1.380±0.062†
2.5 流式细胞仪检测细胞周期
流式细胞仪检测3种细胞周期结果见图5及表2。结果显示,与5-8F细胞、5-8F/NC细胞相比,5-8F/Si-TRIM 29细胞表现为明显的G0/G1期细胞增加,而S期细胞减少,差异有统计学意义(P<0.05);5-8F细胞与5-8F/NC细胞相比,各周期细胞数差异无统计学意义(P>0.05)。结果提示TRIM 29低表达有抑制鼻咽癌细胞增殖的作用。见图5。
2.6 划痕实验检测细胞迁移能力
3种细胞0和48 h迁移情况见图6。培养48 h后,与5-8F细胞、5-8F/NC细胞相比,5-8F/Si-TRIM 29细胞迁移能力明显降低(P<0.05);5-8F细胞和5-8F/NC细胞相比,迁移率差异无统计学意义(P>0.05)。5-8F细胞的迁移率为(0.733±0.012),5-8F/NC细胞的迁移率为(0.700±0.017),5-8F/Si-TRIM 29细胞的迁移率为(0.325±0.039),各组细胞迁移率比较见图7。

图5 5-8F、5-8F/NC和5-8F/si-TRIM 29细胞周期的分布
表2 5-8F、5-8F/NC和5-8F/Si-TRIM 29细胞周期的分布 (%,±s)

表2 5-8F、5-8F/NC和5-8F/Si-TRIM 29细胞周期的分布 (%,±s)
注:1)与5-8F比较,P<0.05;2)与5-8F/NC比较,P<0.05
细胞株 G0/G1期 S期 G2/M期5-8F 50.723±6.630 39.753±4.660 9.527±2.175 5-8F/NC 50.983±5.275 36.700±4.192 12.317±1.703 5-8F/Si-TRIM 29 69.530±5.1251)2) 23.313±4.9211)2) 7.157±1.3162)

图6 划痕实验检测5-8F、5-8F/NC和5-8F/Si-TRIM 29细胞的迁移能力

图7 5-8F、5-8F/NC和5-8F/Si-TRIM 29细胞的迁移率比较
3 讨论
同位素标记相对和绝对定量(isobaric tags for relative and absolute quantitation,iTRAQ)技术是一种新的、功能强大的可同时对4种或8种样品进行绝对和相对定量研究的蛋白质组学技术,它具有高通量、高重复性、高敏感性和高精确性等特点。本课题组前期以5-8F和6-10B为模型,应用iTRAQ标记结合二维液相色谱质谱联用技术(multi-dimensional liquid chromarography-mass spectrometry/mass spectrometry,2DLC-MS/MS)筛选出鼻咽癌转移相关的差异蛋白190个,TRIM 29、SQSTM 1、RDX是其中3个在5-8F中较6-10B中表达上调的差异蛋白。
RDX是ERM(ezrin/radixin/moesin/merlin)家族成员,ERM家族为细胞骨架连接蛋白,ERM家族参与细胞生理状态下的许多基本生命活动如细胞表面结构伪足及微绒毛等的形成、细胞间及细胞与基质间的黏附、信号传导和细胞运动等[6]。本课题组前期研究结果发现RDX在5-8F中较6-10B中表达上调,提示RDX可能与肿瘤的转移相关。但本研究中qRT-PCR结果显示RDX在6-10B中表达较5-8F中高,差异有统计学意义,Western blot结果也显示6-10B表达较5-8F中高,但差异无统计学意义。这种结果前后矛盾,因此课题组未对其与鼻咽癌转移的关系进行下一步研究。出现这种情况的原因可能是iTRAQ为高通量地筛选细胞间差异表达蛋白的技术,影响因素很多,存在一定误差。
SQSTM 1,也称p62,是一种含有多种结构域的蛋白,有一些相互作用的结构域,包括PB1二聚化结构域、TRAF6结合位点和泛素相关结构域等,因此是一种多功能的泛素化结合的折叠蛋白,其在自噬调控[7]、凋亡[8]、蛋白酶体通路[9]、NF-κB[10]、Wnt等[11]信号通路中起重要的作用,从而与多种肿瘤密切相关。研究报道[13],其高表达促进乳腺癌细胞的侵袭转移[12],低表达降低恶性胶质瘤细胞的侵袭性。本研究发现,SQSTM 1的表达水平在5-8F中较6-10B中明显上调,这与前期定量蛋白质组学结果一致,再次证明SQSTM 1与鼻咽癌转移有关,可能是预测鼻咽癌转移和预后的一个重要的分子标志物,关于它的促转移作用及其具体机制将另文报告。
TRIM 29基因,又称为共济失调性毛细血管扩张D组相关基因(ataxia telang-iectasia group D-associated protein,ATDC),位于11q23,属于TRIM蛋白家族,由588个氨基酸组成,其蛋白结构含有多个锌指结构基序和1个亮氨酸拉链基序,可能是一种转录调控因子[14]。文献报道TRIM29在许多肿瘤中过表达,如肺癌[15]、胃癌[16]、膀胱癌等[17]。RU等[18]研究发现TRIM 29不仅促进癌细胞体外增殖,而且加快胰腺肿瘤的生长及体内扩散转移。本研究发现,高转移潜能的鼻咽癌细胞系5-8F中TRIM 29的表达水平明显上调,与低转移潜能鼻咽癌细胞系6-10B相比,差异有统计学意义,这与课题组前期定量蛋白质组学结果一致,说明TRIM29与鼻咽癌转移有关。通过进一步利用siRNA干扰技术下调5-8F细胞中TRIM 29的表达水平,发现TRIM 29低表达后5-8F细胞的增殖能力降低,G0/G1期细胞增加,而S期细胞减少,说明TRIM 29可能是通过调节G0/G1期到S期细胞的变化来影响细胞周期的变化,从而影响细胞增殖。划痕实验显示TRIM 29低表达后5-8F细胞的迁移能力下降,再次证明TRIM 29在鼻咽癌细胞中的促转移作用。有研究报道[19],TRIM 29促进非小细胞肺癌、结肠癌、宫颈鳞癌等肿瘤细胞的增殖与P53相关,其与P53相互作用,使P53驻留在细胞核外,并且抑制P53调节基因(P21和NOXA)的表达,从而促进肿瘤细胞的增殖和迁移。WANG等[20]发现TRIM29促进肿瘤细胞的增长和转移是通过Wnt/β-catenin信号通路中的一个糖原合成酶激酶3β 抑制剂稳定β-catenin而实现的。而TRIM 29促进鼻咽癌转移的机制目前尚未见报道,本课题组将进行后续研究。
综上所述,siRNA干扰TRIM 29表达能明显抑制鼻咽癌5-8F细胞的生长和迁移,说明TRIM 29在鼻咽癌细胞的生长和迁移中起重要作用。SQSTM 1也已证实与鼻咽癌转移有关,因此TRIM 29、SQSTM 1有望成为鼻咽癌转移的分子标志物,但其分子机制及临床应用价值有待课题组进一步深入研究。
[1]ADHAM M,KURNIAWAN AN,MUHTADI AI,et al.Nasopharyngeal carcinoma in Indonesia:epidemiology,incidence,signs,and symptoms at presentation[J].Chin J Cancer,2012,31(4):185-196.
[2]WANG L,YANG H,PALMBOS PL,et al.ATDC/TRIM29 phosphorylation by ATM/MAPKAP kinase 2 mediates radioresistance in pancreatic cancer cells[J].Cancer Res,2014,74(6):1778-1788.
[3]周志毅,杨国仪,孙荣超,等.TRIM 29基因表达在非小细胞肺癌临床病理诊断中的意义[J].中国现代医学杂志,2011,21(25):3143-3145.
[4]INOUE D,SUZUKI T,MITSUISHI Y,et al.p62/SQSTMl accumulation is associated with poor prognosis of lung adenocarcinoma patients[J].Cancer Sci,2012,103(4):760-766.
[5]CUI Y,WU J,ZONG M,et al.Proteomic Profiling in pancreatic cancer with and without lymph node metastasis[J].Int J Cancer,2009,124(7):1614-1621.
[6]BRETSCHER A,EDWARDS K,FEHON RG,et al.ERM proteins and merlin:integrators at the cortex[J].Nat Rev Mol Cell Biol,2002,3(8):586-599.
[7]MIZUSHIMA N,KOMATSU M.Autophagy:renovation of cells and tissues[J].Cell,2011,147(4):728-741.
[8]JIN Z,LI Y,PITTI R,et al.Cullin 3-based polyubiquitination and p62-dependent aggregation of caspase-8 mediate extrinsic apoptosis signaling[J].Cell,2009,137(4):721-735.
[9]WEIDBERG H,SHVETS E,ELAZAR Z.Biogenesis and cargo selectivity of autophagosomes[J].Annu Rev Biochem,2011,80:125-156.
[10]MATHEW R,KARP CM,BEAUDOIN B,et al.Autophagy suppresses tumorigenesis through elimination of p62[J].Cell,2009,137(6):1062-1075.
[11]GAO C,CAO W,BAO L,et al.Autophagy negatively regulates Wnt signalling by promoting Dishevelled degradation[J].Nat Cell Biol,2010,12(8):781-790.
[12]ROLLAND P,MADJD Z,DURRANT L,et al.The ubiquitin-binding protein p62 is expressed in breast cancers showing features of aggressive disease[J].Endocr Relat Cancer,2007,14(1):73-80.
[13]GALAVOTTI S,BARTESAGHI S,FACCENDA D,et al.The autophagy associated factors DRAM1 and p62 regulate cell migration and invasion in glioblastoma stem cells[J].Oncogene,2013,32(6):699-712.
[14]REYMOND A,MERONI G,FANTOZZI A,et al.The tripartite motif family identifies cell compartments[J].EM BO J,2001,20(9):2140-2151.
[15]HAWTHORN L,STEIN L,PANZARELLA J,et al.Characterization of cell type specific profiles in tissues and isolated cells from squamous cell carcinomas of the lung[J].Lung Cancer,2006,53(2):129-142.
[16]KOSAKA Y,INOUE H,OHMACHI T,et al.Tripartite motif containing 29 (TRIM 29)is a novel marker for lymph node metastasis in gastric cancer[J].Ann Surg Oncol,2007,14(9):2543-2549.
[17]DYRSKJOT L,KNIHOFFER M,THYKJAER T,et al.Gene expression in the urinary bladder:a common carcinoma in situ gene expression signature exists disregarding histopatolo-gical classification[J].Cancer Res,2004,64(1):4040-4048.
[18]CHEN R,YI EC,DONOHOE S,et al.Pancreatic cancer proteomerthe proteins that underlie invasion,metastasis,and immunologic escape[J].Gastroenterology,2005,129(4):1187-1197.
[19]YUAN ZG,VILLAGRA A,PENG LR,et al.The ATDC(TRIM 29)protein binds p53 and antagonizes p53-mediated functions[J].Mol Cell Biol,2010,30(12):3004-3015.
[20]WANG L,HEIDT DG,LEE CJ,et al.Oncogenic function of ATDC in pancreatic cancer through Wnt pathway activation and beta-catenin stabilization[J].Cancer Cell,2009,15(3):207-219.

