甘肃高山细毛羊和小尾寒羊DQB1 基因第2 外显子多态性及其与乳房炎相关性
宋晓育, 张小丽, 马小军,2, 李发弟, 张 晨, 张 欣
(1.甘肃农业大学动物医学院,甘肃 兰州730070;2.甘肃省草食动物生物技术重点实验室,甘肃 兰州730070;3.甘肃农业大学动物科学技术学院,甘肃 兰州730070)
随着甘肃全舍饲养羊模式的推广应用,母羊的乳房炎疾病发生逐渐增多,危害极大[1]。母羊患有乳房炎不仅影响羔羊的健康发育,导致羔羊死亡率上升,而且大量患病母羊因其失去饲养价值而淘汰,给养殖户造成较大经济损失。
MHC 是能编码、诱导迅速排斥反应抗原的基因群,呈高度多态性紧密连锁不平衡并呈单体型遗传的一种基因[2]。这些连锁的免疫应答基因编码的MHC 抗原,调控细胞间的相互识别,控制机体对抗原产生免疫应答的能力[3]。绵羊的MHC 又称绵羊白细胞抗原基因(Ovine lymphocyte antigen,OLA),绵 羊OLA 基 因 分 为3 类,即OLA-Ⅰ、OLA-Ⅱ和OLA-Ⅲ。研究结果表明,与动物抗病性有着密切关系的是OLA-Ⅱ中可以在蛋白质水平上表达的DR-B 和DQ-B 基因,其外显子2 编码抗原肽的结构功能区,是绵羊MHC-II类分子功能的重要组成部分,被作为疾病抗性和易感性研究的重要基因,且其组成、结构以及与疾病之间的关系成为抗病育种研究的一个重要部分[4]。目前国内外有关绵羊OLA 基因的研究报道多见于对其性状、绵羊白血病、肺腺癌,以及抗包虫病、线虫病等。国内外学者对绵羊OLA 基因与肉羊乳房炎的研究很少。本研究拟以编码OLA-Ⅱ类分子主要功能区的DQB1 基因外显子2为研究对象,通过对甘肃高山细毛羊和小尾寒羊DQB1 基因外显子2 多态性以及乳房炎发病情况分析,探究其与肉羊乳房炎间的关联性,建立肉羊乳房炎抗性分子标记检测方法,为筛选乳房炎抗性的肉羊群体提供基础数据。
1 材料与方法
1.1 材料
本试验采集甘肃地区412 只绵羊血样,其中甘肃高山细毛羊乳房炎阳性43 只,阴性157 只;小尾寒羊乳房炎阳性48 只,阴性164 只。颈静脉采集血液10 ml,装入含有1 ml 灭菌ACD 抗凝剂的离心管,并用冰盒带回实验室置于-20 ℃冰箱冻存备用。
1.2 方法
1.2.1 基因组DNA 提取 采用常规实验室的酚/氯仿提取法[5],从血样中提取DNA 并溶解于TE 缓冲液,在1%琼脂糖凝胶电泳检测后,放于-20 ℃冰箱保存备用。
1.2.2 引物设计及PCR 扩增 参照文献[6],根据绵羊MHC-DQB1 基因核苷酸全序列Z28523 设计第2 外显子的核苷酸序列引物(上游引物:5'-CCCCGCAGAGGATTTCGTG-3',下 游 引 物 5'-ACCTCGCCGCTGCCAGGT-3'),扩增目的片段约为280 bp,引物由上海生工生物工程技术有限公司合成。
PCR 扩增采用25 μl 的优化体系:上、下游引物各1.0 μl,模板DNA 2.0 μl,灭菌双蒸水8.5 μl,2*TAQ 预混酶12.5 μl。PCR 反应条件:预变性95 ℃5 min;变性95 ℃30 s,退火63 ℃40 s,延伸72 ℃40 s,35 个循环;最后延伸72 ℃10 min。4 ℃保存,PCR 产物用1.5%的琼脂糖凝胶电泳检测。
1.2.3 PCR 产物的SSCP 检测 取2.0 μl PCR 产物,8.0 μl 变性剂[98%去离子甲酰胺、0.030%二甲苯青、0.025% 溴酚蓝、0.5 mol/L EDTA (PH =8.0)],95 ℃变性10 min,然后迅速放于冰上10 min。12%非变性聚丙烯酰胺凝胶(丙烯酰胺∶ N,N-亚甲基双丙烯酰胺=39∶ 1),4 ℃、180 V 条件下,电泳20 h,银染显色法结束后拍照。
1.2.4 OLA-DQB1 外显子2 测序 单链构象采用多态性分析方法(SSCP)分析后,选取不同基因型个体的PCR 扩增胶回收产物克隆,阳性菌液送至金唯智生物科技有限公司测序。
1.2.5 乳房炎的判定 采集的乳汁送至中国农业科学院兰州畜牧与兽医研究所,采用小型体细胞自动计数仪检测,以1 ml 4 ×105为阈值,体细胞数大于1 ml 4 ×105的则判定为隐性乳房炎。
1.3 数据统计分析
采用SPSS17. 0 计算甘肃地区绵羊各个基因型的频率、等位基因频率、相对危险值;用POPGNE计算纯合度(Ho)、杂合度(He)和有效等位基因数(Ne);用PIC 软件计算多态信息含量(PIC);用MEGA5.05 软件进行核苷酸序列及氨基酸序列比对;用DNAMAN 软件进行NJ 进化树构建;用Dnansp5.0 进行核苷酸和氨基酸多态位点分析。
2 结果与分析
2.1 PCR 扩增结果
对采集的412 只绵羊DQB1 基因外显子2 进行PCR 扩增,1.5%琼脂糖凝胶电泳检测,目的条带清晰,无杂带(图1),片段大小为280 bp,可以进行下步SSCP 检测。
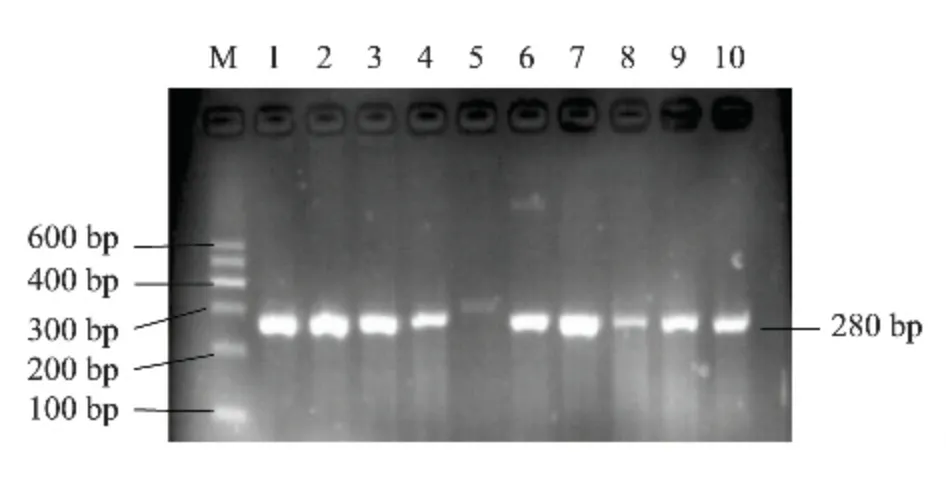
图1 绵羊MHC-DQB1 外显子2 的PCR 结果Fig.1 PCR amplification of MHC-DQB1 gene exon 2 in sheep
2.2 PCR-SSCP 检测结果
PCR 扩增产物进行SSCP 检测发现,412 头甘肃地区绵羊个体中,共检测到14 个等位基因,其电泳条带从1 条到3 条不等,分别命名为等位基因A、B、C、D、E、F、G、H、I、J、K、L、M、N(图2)。
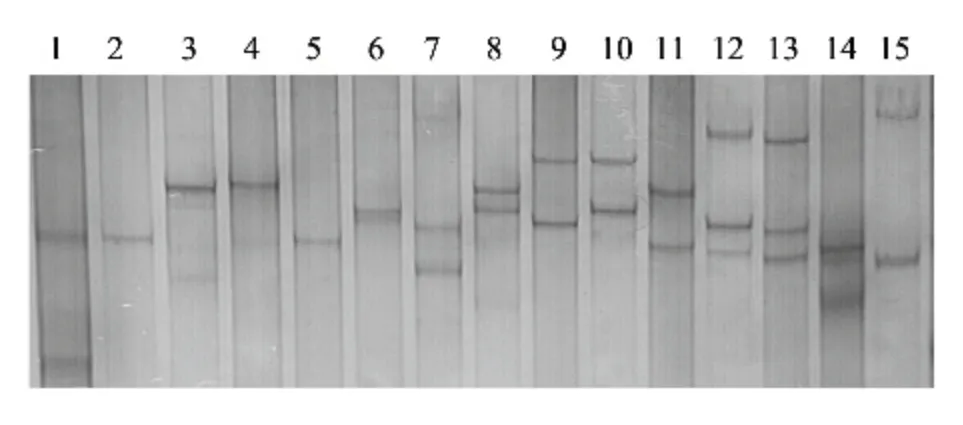
图2 绵羊MHC-DQB1 第2 外显子SSCP 检测结果Fig.2 Detection of MHC-DQB1 gene exon 2 in sheep by PCRSSCP
2.3 DQB1 基因第2 外显子核苷酸变异类型
通过对412 只绵羊DQB1 第2 外显子基因克隆测序,发现了14 个等位基因(图3)。除去引物序列对14 个DQB1 基因第2 外显子243 bp 单倍型序列进行比对分析,在分析序列中共有58个变异位点,占分析位点的23. 87%。其中转换位点22 个,占核苷酸变异位点的37. 93%,包括A/G 转换和C/T 转换各11 个;颠换位点30 个,占变异位点51. 71%,其中A/C 颠换6 个、A/T颠换8 个、G/C 颠换13 个、G/T 颠换3 个;转换和颠换共存位点6 个,占变异位点10. 35%。还发现2 个特殊位点,即第17 和145 位点出现碱基突变T↔C↔G↔A。
核苷酸位点的碱基突变导致氨基酸发生了大量改变(图4),包括175 bp 处的T/A 突变导致等位基因A、N 所编码的氨基酸由F(苯丙氨酸)↔I(异亮氨酸);212 bp 处的C/A 突变和213 bp 处的G/C 突变导致等位基因N 所编码的氨基酸由S(丝氨酸)↔C(半胱氨酸)等。120 bp 处的C/G 突变、129 bp处的G/C 突变、147 bp 处的A/C突变、234 bp 处的T/A 突变未导致氨基酸发生改变。
2.4 甘肃高山细毛羊和小尾寒羊DQB1 基因第2外显子遗传信息
2 个绵羊群体DQB1 基因第2 外显子的遗传多态性如表1 所示,其杂合度均大于0.9,且PIC >0.5,均为高度多态。
2.5 甘肃高山细毛羊和小尾寒羊DQB1 第二外显子与乳房炎相关性分析
PCR-SSCP 方法共检出14 个单倍型,分别将乳房炎阴性和阳性的2 个绵羊品种等位基因频率进行差异显著性分析和相对危险值计算(表2、表3)。结果显示,2 个绵羊品种阳性中均没有等位基因A、D、N,而等位基因I 仅在甘肃高山细毛羊阳性中存在;等位基因B (P <0. 01,RR =0. 158)与甘肃高山细毛羊乳房炎的抗性有较强相关性;等位基因F(P <0. 01,RR =3. 513)和L(P <0. 01,RR =10. 197)与甘肃高山细毛羊乳房炎易感性具有较强相关性。等位基因A(0. 01 <P <0. 05,RR =0. 878)与小尾寒羊乳房炎抗性有相关性,等位基因E (P <0. 01,RR =3. 333)和M(P <0. 01,RR =8. 000)与小尾寒羊乳房炎易感性具有较强相关性。

图3 DQB1 外显子2 等位基因核苷酸序列比对结果Fig.3 Nucleotide sequences alignment of DQB1 gene exon 2 alleles
2.6 DQB1 第2 外显子NJ 进化树的构建
为了研究这2 个绵羊种群DQB1 基因第2 外显子的等位基因与其他相应等位基因之间的遗传关系,利用DNAMAN 软件对其DQB1 第2 外显子序列进行NJ 树构建(图5),所用序列包括本研究的14 个单倍型,基因库下载的AH001247. 2、AJ238942、Z28422、GU191457、HQ728686、HQ728668、HQ728669、Z28425,还有4 条牛的DQB1 第2 外显子序列:AY444363、EU294404、DQ092798、U62321。图5 显示,所有DQB1第2 外显子的同源性都很高,其中牛和羊的同源性很高且最终汇聚为一支,2 个绵羊品种的等位基因A、G、C 分别与HQ728669、HQ728686、AH001247 同源性高达99%以上,且等位基因J 和K 聚合为一类,遗传距离(同源性)为100%。

图4 OLA-DQB1 基因第2 外显子等位基因编码的氨基酸序列比对结果Fig.4 Amino acid sequences alignment of DQB1 gene exon 2 alleles

表1 DQB1 基因第2 外显子遗传多态性分析Table 1 The genetic polymorphisms of DQB1 gene exon 2

表2 乳房炎阴性和阳性甘肃高山细毛羊DQB1 基因第2 外显子等位基因频率Table 2 Allele frequencies of the DQB1 gene exon 2 gene in mastitis-infected and healthy Gansu alpine fine-wool sheep
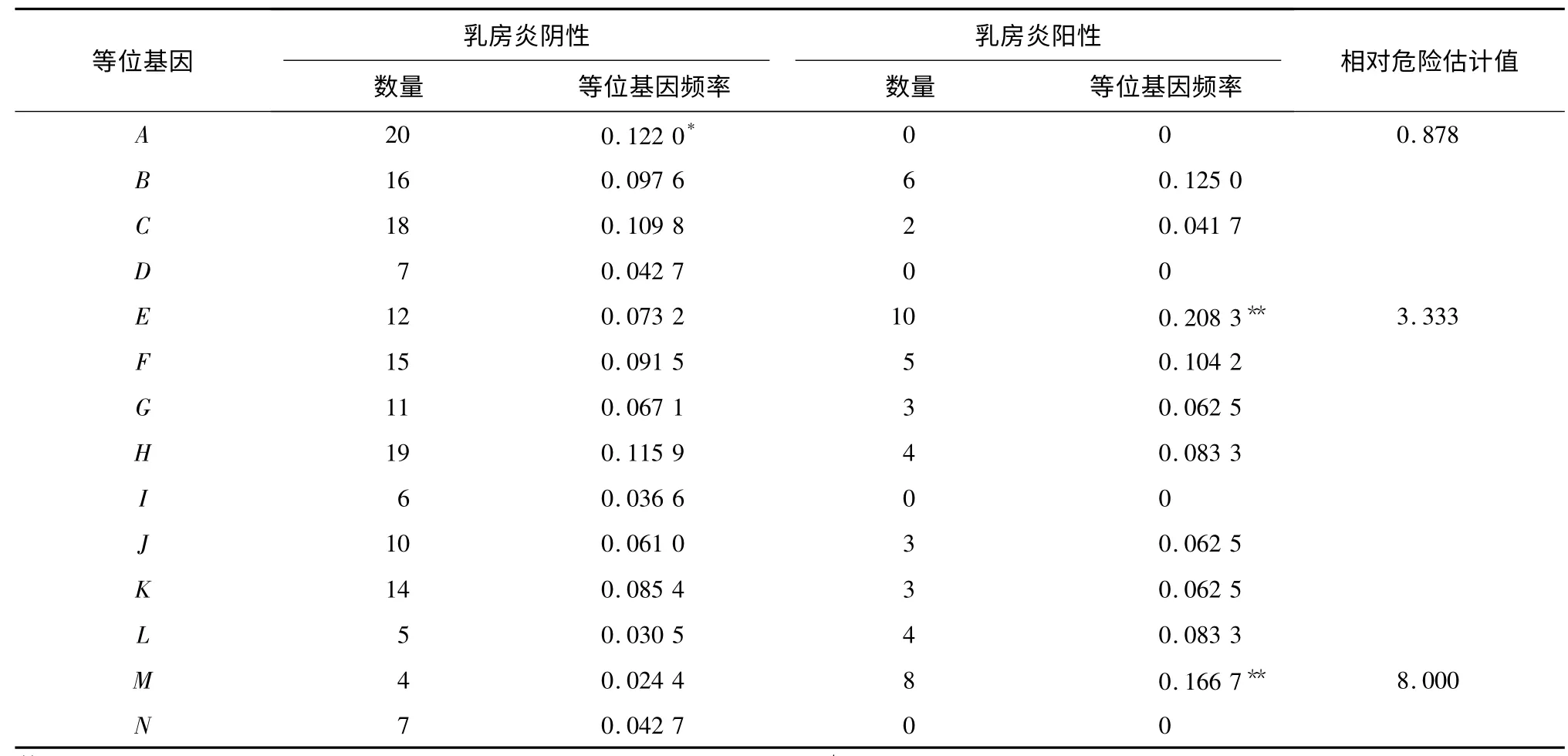
表3 乳房炎阴性和阳性小尾寒羊DQB1 基因第2 外显子等位基因频率Table 3 Allele frequencies of DQB1 gene exon 2 gene in mastitis-infected and healthy small tail Han sheep

图5 OLA-DQB1 基因第2 外显子核苷酸序列的NJ 树Fig.5 Phylogenetic tree based on the OLA-DQB1 gene nucleotide sequences by Neighbor-joining
3 讨论
3.1 DQB1 基因第2 外显子的多态性
核苷酸的变异是形成MHC 基因高度多态性的原因[7],MHC-DQB1 基因外显子2 作为抗原结合位点,其多态性和重要性成为近年来家畜抗病育种研究的一个热点。Amills 等[8]在萨能奶山羊DQB1 基因外显子2 中发现了5 个等位基因;刑凤等[9]利用PCR-RFLP 方法从莱芜黑山羊、波尔山羊、鲁波山羊的DQB 基因外显子2 检测到4 个等位基因,7 个基因型。申红等[10]利用PCR-RFLP 方法,在中国美利奴羊MHC-DQB1 基因外显子2 的酶切检测中,共检测到了20 种等位基因。本研究针对甘肃高山细毛羊和小尾寒羊的MHC-DQB1 基因外显子2 的多态性进行了初步研究,共发现了14 个单倍型序列,具有高度多态性。这可能与甘肃高山细毛羊和小尾寒羊生存的恶劣环境等因素有关。作为评价群体遗传变异的重要指标包括遗传杂合度(He)、有效等位基因数(Ne)、多态信息含量(PIC)等,它们的高低反应群体均质度,其数值越高,遗传变异越大,遗传多样性越丰富,遗传潜力就越大。本研究2 个绵羊种群的PIC 含量均大于0.5,且各等位基因之间存在大量的多态性位点,表明该基因为多碱基突变,表现高度多态性,表明该群体具有丰富的遗传多态性和较高的遗传价值。将检测到的单倍型克隆测序结果与GenBank 上已有的序列进行比对,表明为新发现的等位基因。
3.2 DQB1 基因第2 外显子与乳房炎的关联性分析
采用免疫遗传标记开展选育工作,可以提高畜禽抗病能力[11-12]。在动物抗病育种中,MHC 基因已被证实为重要的候选基因[13]。国内外学者通过对人类[14]、牛[15]、猪[16-17]、羊[18]、家禽等MHC 基因的多态性和抗病性研究分析,确立了与抗病育种相关的遗传位点。Sharif 等[19]报道BoLA-DRB3 第2 外显子与牛奶中的体细胞数和奶牛乳房炎的发病率极显著相关。张千夫等[20]用PCR-RFLP 方法在对Bo-LA-DRB3 基因分别被RsaⅠ和Hae Ⅲ酶切后不同基因型对牛体细胞评分的影响研究中,发现RsaⅠAD型的体细胞数显著高于RsaⅠEG 型。杨冬英等[21]利用PCR-RFLP 技术对南阳黄牛、秦川黄牛BoLADRB3 基因第2 外显子多态性进行研究,结果表明,BoLA-DRB3 基因第2 外显子经限制性内切酶BstUⅠ酶切后表现多态性且奶牛AA 型个体显著高于黄牛品种,并认为BoLA 等位基因A 可能为母牛乳房炎易感性的基因。高树新等[22]采用PCR-SSCP 技术,检测到2 种兼用型牛BoLA-DQB 基因外显子2的多态性与牛乳房炎发生存在关联性,但其关联因品种不同而不同。目前在绵羊MHC-DQB 与疾病相关性研究中,大多是其与包虫病相关性的研究[23]。本研究采用PCR-SSCP 方法检测了甘肃高山细毛羊和小尾寒羊的MHC-DQB1 基因第2 外显子多态性,并与乳房炎的抗病和易感性进行了关联性分析,发现2 个绵羊品种DQB1 基因外显子2 的多态性与乳房炎发生存在关联性。在甘肃高山细毛羊中等位基因B 在阳性中出现较少,相对危险估计值(RR=0.158 <1)较低,初步判断可能为乳房炎的抗性等位基因;而等位基因F 和L 在甘肃高山细毛羊的阴性中出现较少,相对危险估计值(RR=3.513,RR=10.197)较高,提示与甘肃高山细毛羊乳房炎易感性具有较强相关性;等位基因A(0.01 <P <0.05,RR=0.878 <1)为小尾寒羊乳房炎抗性等位基因,而等位基因E (P <0.01,RR= 3.333)和M (P <0.01,RR=8.000)为小尾寒羊乳房炎易感性等位基因。种群内不同等位基因在乳房炎阴性、阳性间分布存在差异,可能与不同个体对乳房炎的抗病力或者敏感性上存在差异有关。本研究还发现2 个绵羊阳性种群中均没有等位基因A、D、N ,而等位基因I仅在阳性小尾寒羊中存在,这可能是卡方适合性检验该群体偏离哈德温伯格平衡的原因,也可能与样本含量小以及所选择的群体有相关。
3.3 DQB1 基因第2 外显子基因聚类分析
在DQB1 第2 外显子的序列系统发育分析中,这2 个绵羊群体DQB1 基因序列呈现为明显的两支,最初可能是由2 个等位基因分化来的。系统分析发现这2 个绵羊群体DQB1 基因与下载的牛DQB1 基因序列具有较高的同源性,表明绵羊和牛的DQB1 基因最早可能来自于分化以前的共同祖先的原始序列。这也证明了源于共同祖先的MHC 基因,在环境压力下有着不同演变取向。绵羊与牛的DQB1 基因序列有着较高的同源性,而且绵羊的等位基因与牛的一些等位基因之间的遗传距离比绵羊自身之间的遗传关系还要近,可能是绵羊DQB1 基因与牛的DQB1 基因在特定抗原的刺激下,发生的免疫应答反应具有相似性[24]。
[1] 白玉光,王永军.青海高原全舍饲母羊乳房炎治疗和预防措施[J].黑龙江畜牧兽医,2012,2(13):91-92.
[2] 高树新,许尚忠,李金泉,等. BOLA-DQA、DRB3* exon2 多态性及其与奶牛乳房炎的关联分析[J]. 畜牧兽医学报,2006,37(4):317-320.
[3] BALLINGALL K T,FARDOE K,MCKEEVER D J. Genomic organization and allelic diversity within coding and non-coding regions of the Ovar-DRB1 locus[J]. Immunogenetics,2008,60(2):95-103.
[4] SAYERS G,GOOD B,HANRAHAN J P,et al . Major histocompatibility complex DRB1 gene:its role in nematode resistance in Suffolk and Texel sheep breeds [J]. Parasitology,2005,131(3):403-409.
[5] JESEPH S,DAVID W R. Molecular cloning:A laboratory manual[M]. Cold Spring Harbor Laboratory Press,2001.
[6] AMILLS M,SULAS C,SANCHEZ A,et al. Structural characterization of the caprine major histocompatibility complex class ⅡDQB1(Cahi-DQB1)gene [J]. Molecular Immunology,2004,41:843-846.
[7] 陈芳芳,潘 玲,耿照玉,等. MHC 分子多态性的起源、演变与抗病机理[J]. 畜牧兽医学报,2010,41(9):1061-1067.
[8] AMILLS M,SULAS C,SANCHEZ A,et al. Structure characterization of caprine major histocompatibility complex class ⅡDQB1 gene[J]. Molecular Immunology,2004,418:43-846.
[9] 刑 凤,李培培,李 钰,等. GOLA-DQB1 基因外显子2 多态性与免疫性状的相关分析[J].遗传,2008,7(30):870-876.
[10] 申 红,贾 斌,陈玉林,等.中国美利奴羊MHC-DQB1 基因多态性与包虫病的抗性分析[J].2008,30(9):682-688.
[11] KONNAI S,TAKESIMA S,TAJIMA S,et al. The influence of ovine MHC class II DRB1 alleles on immune response in bovine leukemia virus infection[J]. Microbial Immunology,2003,47:223-232.
[12] 晏光荣,马海明.分子标记在动物抗病育种中的研究进展[J].国外畜牧科技,2001,28(6):32-34.
[13] RAADSMA H W. Flcecc rot and body strike in Merino sheep V heritability of liability to body strike in weaner sheep under flywave conditions [J]. Australian Journal of Agricultural Research,1991,42 :279-293.
[14] 刘 辉,苏冠芳,魏世辉,等. Eales 病与人类白细胞抗原HLADRB、DQB 基因位点的关联[J]. 中华眼底病杂志,2006,22(2):90-93.
[15] 高树新,许尚忠,李金泉,等.中国荷斯坦奶牛BOLA-DRA,DQB基因外显子2 多态性及其与乳房炎的关联分析[J].黑龙江畜牧兽医,2007(11):27-28.
[16] 张国华.合作猪SLA-DQA 第2、4 外显子多态性分析[D]. 兰州:甘肃农业大学,2014.
[17] 包文斌,吴圣龙,国 宏,等.苏太猪SLA-DQB 基因外显子2 多态性及其与繁殖性能的关联分析[J].畜牧兽医学报,2007,38(7):636-640.
[18] 刘 秀,胡 江,罗玉柱.藏绵羊基因OLA-DQA2 第二外显子多态性分析[J].中国农业科学,2009,42(8):2930-2936.
[19] SHARIF S ,MALLARD B A ,WILKIE B N ,et al. Associations of the bovine major histocompatibility complex DRB3 (BoLADRB3)alleles with occurrence of disease and milk somatic cell score in Canadian dairy cattle[J]. Animal Genetics,2002,29(3):185-193.
[20] 张千夫,郑小敏,唐大伟,等. 荷斯坦牛BOLA-DRB3 基因多态性及其与乳房炎抗性关系分析[J]. 畜牧兽医学报,2007,38(2):115-119.
[21] 杨冬英,陈 宏,张良志,等. 牛BOLA-DRB3 基因多态性与乳房炎相关性初探[J].中国兽医杂志,2006,42(7):7-9.
[22] 高树新,许尚忠,李金泉,等.2 种兼用型牛BoLA-DQB* exon2基因的多态性与奶牛乳房炎的相关性[J].西北农林科技大学学报,2008 ,36(3):8-12.
[23] 申 红,杜迎春,贾 斌,等.多浪羊MHC-DQB1 基因多态性与包虫病的抗性分析[J]. 中国人兽共患病学报,2009,25(1):17-22.
[24] 成述儒,罗玉柱,胡 江,等. 藏绵羊DQA1 基因多态性分析[J].中国农业科学,2011,44(10):2146-2153.

