3D 打印技术及在组织工程领域的研究进展
田冶 曾庆慧 胡相华 任雅清 何晓帆
1 广东省医疗器械质量监督检验所 (广州 510663)
2 广州市生物医用血液净化材料研究与开发重点实验室 (广州 510663)
3 暨南大学材料科学与工程系 (广州 510632)
生物支架是组织工程研究的重要组成部分,是一种能够模仿天然组织功能,适合种子细胞生长和发挥生物学功能的生物活性材料,是影响组织重建成功与否的关键因素之一[1]。作为种子细胞的生物学载体,理想的支架需具有良好的生物相容性、生物可降解性和适宜的力学强度等生物理化性质[2]。通过材料的选择、配比以及相应的改性处理,可较为容易地实现对该性能的控制[3~5]。但需注意的是,支架的设计最终是以临床应用为目的的。对于不同的患者及不同的缺损组织部位,其外形和微观结构必然存在差异。而以冻干法、静电纺丝法、超临界法等为代表的传统的组织工程支架制备方法[6,7],难以制备这种在结构特点上存在差异的个性化特性明显的支架。
3D 打印技术的出现为解决这一问题提供了新的途径。利用3D 打印技术,可根据患者缺损 /病变部位的成像数据,快速、精确的制造个性化组织工程支架。该技术不仅能够实现支架与患者缺损/病变部位的完美匹配,能够在形态上模仿天然组织的微观结构,甚至能携带细胞与材料一起打印,通过控制细胞的排列促进细胞在支架上的生长与分化以获得理想的组织修复效果。因此,3D 打印技术在组织工程领域的应用获得了越来越广泛的关注并取得了显著的研究成果[8~10]。本文主要介绍3D 打印技术的原理和打印方式并综述近年来3D 打印技术在制备组织工程支架方面的研究进展以及目前存在的问题和未来发展方向。
1.3D打印的基本原理

图1. 3D 支架的CAD 设计图和打印支架。a)外部结构;b)内部结构;c)打印支架[12]
3D 打印是20 世纪80 年代末兴起的一门新技术,其打印原理简单来说是采用分层加工、迭加成型的技术,即通过逐层增加材料来形成3D 实体[11]。3D 打印原理和打印方式与普通喷墨打印机十分相似,最大的不同在于:3D 打印机的喷头不仅能在平面上移动,还能够垂直移动。对于组织/器官的3D 打印,其基本步骤是:首先获取患者病变/缺损组织的断层扫描(CT)、磁共振成像(MRI)数据,利用计算机辅助设计(CAD)建立图像模型(图1),根据各种参数将扫描图像按一定的厚度进行虚拟“切片”,然后将相关数据输送到3D 打印机中,打印机按照这些极薄的“切片”,用合适的生物材料逐层打印并堆积起来,最终形成与组织一致的三维支架[13]。3D 打印的最大优点在于其能够精确、快速实现支架复杂的宏观外形与内部微细结构的一体化构建,可以实现针对特定患者、特定组织器官的个性化生产,这是其他的传统支架成型方法所不可企及的[14]。
2.3D打印技术及适用材料
目前,应用较多的3D 打印技术包括光固化立体印刷(Stereolithography, SLA),熔融沉积成型(Fused Deposition Modeling, FDM)、选择性激光烧结(Selective Laser Sintering,SLS)和材料-细胞同时打印的3D 生物打印等[15, 16]。每种打印技术均有其优缺点和适用的材料。
2.1 光固化立体印刷[17~19]
SLA 是最早,也是现今应用最广泛的3D 打印技术。SLA 主要使用的原料为光敏性树脂,包括光敏分子修饰的高分子,如聚乳酸(PLA)、聚己内酯(PCL)以及蛋白质和多糖等,也可加入其他材料形成复合材料[20,21]。它是通过紫外激光束在光敏树脂表面进行逐层扫描,被扫描区域的树脂层发生光聚合反应而固化形成一个薄层,一层固化完毕后,工作台下降一个凝胶层厚度,在固化好的树脂表面再覆盖上一层新的液态树脂,然后进行下一层的扫描加工,新固化层牢固黏在前一层上,经过逐层扫描固化,最终获得三维支架。光固化立体印刷技术具有高精度、性能稳定、支架力学强度高等优点,但其缺点是成型后需要清洗除去杂质,且仅适用于具有光敏性的高分子材料。
2.2 熔融沉积成型[22~24]
FDM 是通过热熔喷头将熔融态的材料按计算机控制路径挤出、沉积并凝固成型,经过逐层沉积、凝固得到所需的三维产品。FDM 所使用的原料通常为热塑性高分子,包括聚酰胺、聚酯、聚乙烯等。该技术的优点是成型精度高,支架强度好,因为其没有使用溶剂或其他添加剂,所以成型无需后续的除杂质步骤;其缺点是打印温度较高,易造成高分子材料的降解且会对生物大分子的活性造成影响。
2.3 选择性激光烧结[25~27]
SLS 是利用激光束将粉末状的原料表面熔融、粘结固化,经过逐层扫描、熔融、粘结、固化后获得三维材料。与SLA 通过紫外光粘结固化不同,SLS 是通过激光产生高温使粉末状原料表面熔融实现粘合,因此,其适用的原料更为广泛,除了高分子材料,无机非金属、金属粉末等也可用作打印材料。但相比于SLA,其打印产品的表面较粗糙,并且激光的高温作用也会造成高分子材料的降解。
2.4 与细胞结合的3D 生物打印[28~30]
以上几种打印方式,均是单独采用材料作为打印原料,支架成型后再引入细胞构建细胞-支架复合物。但采用这种方式往往存在支架内生长的细胞密度较低且分布不均,细胞在支架表面生长良好,而在支架内部尤其是在支架的中心区域极少细胞能够进入的问题。3D 生物打印技术则以活体细胞、营养物质和液态生物材料的共混物作为打印“墨水”,直接打印材料-细胞的一体化支架,是目前3D 打印技术中最引人关注的一种打印方式。与以上打印技术相比,3D 生物打印的一体化支架可以获得更高且分布均匀的细胞密度,可以在微观尺度上控制细胞的排列分布,这对于调节细胞行为、细胞间和细胞与材料间的相互作用,以及促进细胞最终形成功能组织具有十分重要的意义。需注意的是,由于细胞对生存环境的要求十分苛刻,因此适用于3D 生物打印的生物材料极为有限。目前使用较为广泛的是各类可聚合的水凝胶材料,如将双键封端的聚乙二醇(PEG)水溶液与含有细胞的培养液混合形成可光聚合的材料-细胞混合液作为打印原料,制备包含有细胞的水凝胶支架[31]。除光聚合反应技术,其他生物相容的原位凝胶成型技术也被广泛应用,如将藻酸盐与细胞混合溶液打印成型后,利用藻酸盐与钙离子的交联作用形成稳定的凝胶支架[32];利用包含细胞的凝血酶溶液作为墨水,喷入纤维蛋白原溶液基质中,通过凝血反应凝固成包含有细胞的纤维蛋白支架[33];利用含细胞的胶原溶液打印后,使其pH 值升高至中性,通过胶原自身的物理凝胶化形成支架等方法[34]。
3.3D打印在组织工程中的应用
近年来,研究者对组织工程支架的设计提出了4F 准则:形状诉求(Form)、性能诉求(Function)、功能诉求(Formation)和可植入性(Fixation)[35]。形状诉求是指支架材料必须能够完全填充复杂的三维缺陷,并且可以诱导组织再生;性能诉求是指支架的力学性能等可以在缺失组织修复前暂时起到缺失组织作用的需求;功能诉求是指材料需具有相应的生物活性,能够为细胞提供适宜的环境以促进组织再生;可植入性是指支架可通过手术植入人体,并起到预期功效。以此为原则,研究者希望利用仿生学等原理,体外构建适合组织细胞生长的显微结构,尽可能地模拟体内环境,从而协调不同细胞的增殖、分化、迁移和凋亡等。利用3D 打印技术制备的个性化支架,能够精确模拟天然组织复杂的三维微观结构,支架形状与缺损组织高度吻合,并能通过支持生长因子、细胞的共同打印赋予支架生物活性,因此在组织工程领域得到广泛应用。
3.1 骨组织工程
骨组织是一种由无机纳米羟基磷灰石颗粒与胶原及少量非胶原蛋白等基质自主装形成的多孔复合材料。与其他组织相比,骨组织的结构与功能相对较简单,因此,骨组织工程获得广泛关注并取得飞速发展[36,37]。研究者希望骨组织工程支架的设计能尽量模仿天然骨的复杂的多孔微观结构,因为微环境不仅会对细胞的增殖分化行为,也会对支架材料的力学性能、渗透性/扩散性造成影响。研究认为,具有较大孔径的材料能获得较高的细胞密度,而高渗透性、多孔通道和力学强度的支架能明显促进成骨细胞的信号表达[38,39]。3D 打印技术能够准确控制微孔的分布、空间走向和相互连通等结构特征[40]。Das 等以聚己内酯(PCL)为原料制备了可降解支架,其压缩模量和屈服强度分别为52~67MPa 和2.0~3.2MPa,该强度达到或接近了人松质骨的力学性能范围,并且获得的支架能与缺损部位的骨组织紧密结合,具有良好的生物相容性[41]。Inzana 则以磷酸钙为原料打印支架,并利用胶原对支架进行改性,植入鼠腿骨缺损处9 周后发现,支架具有骨传导特性,随着支架的降解,缺损部位逐渐被新生骨组织填充[42]。为进一步增强打印支架的生物活性,Pati 等首先在PCL/PLGA/β-TCP 复合支架中引入hTMSCs 细胞,培养一段时间后去除细胞,则支架表面被一层细胞外基质(ECM)所覆盖,将其植入小鼠体内缺损部位并培养一段时间后发现,未加支架的缺损部位仅有较薄的一层纤维化组织(图2c),植入PCL/PLGA/β-TCP 支架的,其缺损部位被一层厚厚的纤维化组织所填充,而植入了覆盖ECM 的复合支架的缺损部位有大量的类骨组织形成,缺损部位几乎完全被修复,显示复合支架具有较好的修复能力[43]。

图2. 3D 打印骨支架和植入缺损部位后的修复情况。a) PCL/PLGA/β-TCP支架; b)覆盖ECM 的PCL/PLGA/β-TCP 复合支架;c)未植入支架的缺损部位;d)植入PCL/PLGA/β-TCP 支架的缺损部位;e)植入覆盖ECM 的PCL/PLGA/β-TCP 复合支架的缺损部位[43]
3.2 软骨组织工程
由于软骨组织无血液供应和神经支配,并且软骨细胞的低代谢活性以及高密度的细胞外基质限制了软骨细胞向缺损区域移行,在受损后无法自行修复[44],因此组织工程在软骨修复中具有极大的应用前景。软骨基质的化学成分主要为嗜碱性软骨粘蛋白,它以长链的透明质酸分子为主干,干链上以许多较短的蛋白质链连接硫酸软骨素A、C 和硫酸角质素。这种羽状分支的大分子结合着大量的水,大分子又相互结合,并和胶原原纤维结合在一起形成凝胶结构。Woodfield 等利用3D打印技术制成的PEGT/PBT 支架,其模量和刚度分别在0.05~2.50MPa 和0.16~4.33MPa 之间,与天然软骨组织(模量0.27MPa,刚度4.10MPa)的力学性能相似,植入裸鼠皮下具有明显的成软骨作用[45]。Lima 等以聚乙二醇异丁烯酸酯(PEGDMA)/软骨细胞混合液为墨水,通过紫外光聚合打印软骨凝胶支架(图3a,b),细胞通过层层打印聚合方式能够在凝胶支架内均匀分布并保持了较好的细胞活性(图3c),支架与周围组织能够较紧密的结合,在植入物和天然软骨组织界面上有大量蛋白多糖沉积并有大量的粘多糖分泌[46]。需注意的是,这种对于软骨的单一修复仍存在与受损部位结合不牢固等问题。在正常骨软骨组织中,软骨与软骨下骨通过钙化层相连,此外钙化层也将软骨与软骨下骨分隔在不同的生存环境中。由于软骨缺损时,其下的软骨下骨常出现硬化、退变,而新生软骨是无法与病变的软骨下骨进行整合的,所以在修复软骨的同时,必须还要重视软骨下骨的修复。目前的解决方法是采用分层结构材料来促进关节软骨/骨组织的协同一体化修复[47]。如Teoh 等以 PCL 为原料,利用3D 打印制备了骨软骨一体化支架,并将成骨细胞与软骨细胞分别种植于支架的两部分,2 种细胞在支架中分泌出不同的细胞外基质,在成骨细胞种植区出现了较高的骨钙分泌,而在软骨细胞种植区测得了较高的碱性磷酸酶,该结果表明这种复合支架可应用于骨-软骨的一体化修复[48]。
3.3 血管组织工程
血管组织具有独特的三层结构,即内壁面是一层内皮细胞、中层主要是由弹性纤维组织、胶原和平滑肌组成,最外层包围着疏松的结缔组织,这种结构决定了天然血管具有良好的抗凝血和弹性。理想的血管支架要求能够具有或模拟天然血管的三层结构,不易产生血栓,具有血管的粘弹性及能够承受一定压力的力学特性等特点。Boland 等应用喷墨打印技术将牛血管内皮细胞与藻酸盐水凝胶同步打印,形成内皮细胞-水凝胶三维复合物,发现黏附于水凝胶支架内部的内皮细胞存活时间较长并具有良好的细胞活性[49]。MILLER 等首先将碳水化合物玻璃打印成网格状模板,用浇注法复合载细胞水凝胶形成管道状血液通路,并证实这些血管通路能够有效的保持工程化组织中肝细胞的新陈代谢功能[50]。Kolesky等则利用3D 打印构建了由多种类型细胞和细胞外基质组成的三维支架,支架内存在复杂的充满了内皮细胞的血管网络(图4),该支架可以用于药物筛选模型以及考察伤口愈合和血管形成的基础性研究[51]。
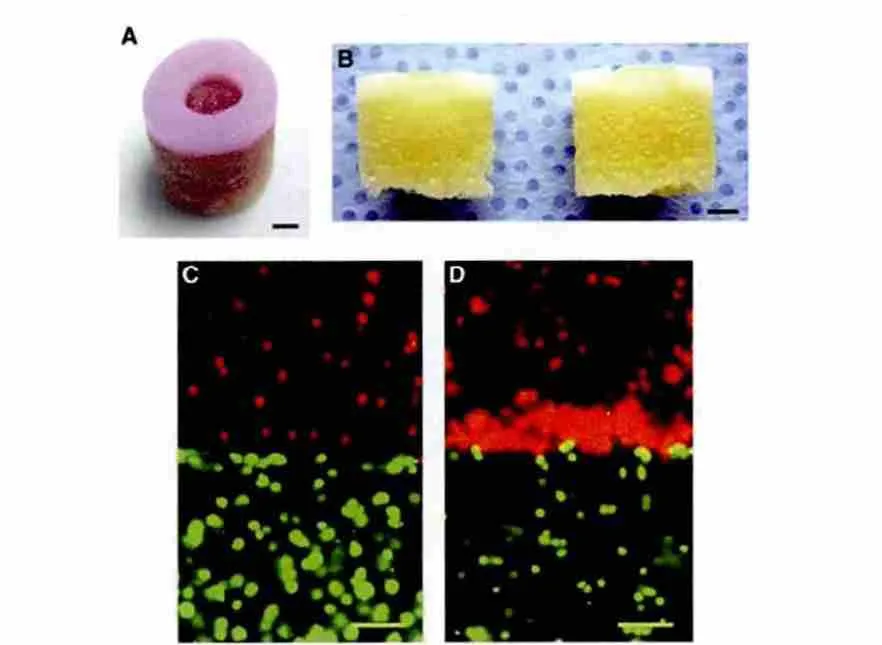
图3. 3D 打印PEGDMA/软骨细胞凝胶复合支架. a,b)复合支架; c)软骨细胞在层层打印-聚合支架内的均匀分布; d)细胞在打印后再聚合支架内的不均匀分布[46].

图4. 3D 打印灌注有内皮细胞的血管网络[51]
4.3D打印存在的技术难点及展望
相对于其他组织工程学的体外构建技术,3D打印技术特别适合复杂结构支架的成型,在制造具有多孔和复杂微观结构的复合植入物方面具有独特优势,但同时也存在着不少技术难题:首先,对于各种3D 打印方式尤其是携带细胞的3D 生物打印,理想的“墨水”除了需具有一般生物材料良好的生物相容性和可降解性外,还需具有可打印成型及在成型后支架能保持适宜的力学强度和生物活性等性能,而目前能够同时满足这些要求的生物材料的选择性较少。其次,理想的支架内需含有一定密度和功能性的细胞,利用细胞与材料同时打印,需注意“墨水”的粘滞性、密度、表面张力等参数会影响细胞的生存能力[52]。同时打印前,打印过程中均要求“墨水”为液态,而打印后又要求其立即凝固,这种由液态到固态的变化必须能够保证不引起细胞、生物活性因子及其他微粒的损失。最后,目前利用3D 打印技术构建的支架,大多只是一个简单的细胞层叠的堆积体,没有相应的组织功能,如何实现支架内细胞间的相互信号传导以及支架内血管的长入,以实现打印器官的最终功能化仍有很长的一段路要走。
尽管如此,3D 打印尤其是与细胞结合的3D生物打印仍具有其他成型方法无可比拟的优势,这也决定了在今后很长的一段时间内将会是组织工程研究的热点之一。国内外不少研究中心及实验室已经利用3D 打印技术构建各种个性化支架,其在骨与软骨组织工程领域的部分研究成果已进入临床试验。相信随着对支架材料、干细胞技术以及细胞与微环境相互作用机制研究的不断深入和突破,利用3D 打印技术构建个性化并具有功能性的人工器官将不再是遥不可及的目标。
[1] Credi C, Biella S, De Marco C, et al. Fine tuning and measurement of mechanical properties of crosslinked hyaluronic acid hydrogels as biomimetic scaffold coating in regenerative medicine. J Mech Behav Biomed Mater, 2013, 29C: 309-316.
[2] Ku KC, Lee MW, Kuo SM, et al. Preparation and evaluation of collagen I/ gellan Gum/β-TCP microspheres as bone graft substitute materials. Conf Proc IEEE Eng Med Biol Soc, 2013, 2013: 6667-6670.
[3] Sano H, Orbay H, Terashi H, et al. Acellular adipose matrix as a natural scaffold for tissue engineering. J Plast Reconstr Aesthet Surg, 2014, 67: 99-106.
[4] Shimomura K, Moriguchi Y, Murawski CD, Yoshikawa H, et al. Osteochondral tissue engineering with biphasic scaffold: current strategies and techniques. Tissue Eng Part B Rev, 2014, 20: 468-476.
[5] Zhang HB, Zhou L, Zhang WJ. Control of Scaffold Degradation in Tissue Engineering: A Review. Tissue Eng Part B: Reviews, 2014, 20: 492-502.
[6] Farokhi M, Mottaqhitalab F, Shokrgozar M, et al. Bio-hybrid silk fibroin/calcium phosphate/PLGA nanocomposite scaffold to control the delivery of vascular endothelial growth factor. Mater Sci Eng C Mater Biol Appl, 2014, 35: 401-410.
[7] Bao M, Lou X, Zhou Q, et al. Electrospun biomimetic fibrous scaffold from shape memory polymer of PDLLA-co-TMC for bone tissue engineering. ACS Appl Mater Interfaces, 2014, 6: 2611-2621.
[8] Gauvin R,Chen YC,Lee JW, et al. Microfabrication of complex porous tissue engineering scaffolds using 3D projection stereolithography. Biomaterials,2012,33(15):3824-3834.
[9] Habibovic P, Gbureck U, Doillon CJ, et al. Osteoconduction and osteoinduction of low-temperature 3D printed bioceramic implants. Biomaterials, 2008, 29: 944-953.
[10] Fedorovich NE, Schuurman W, Wijnberg HM, et al. Biofabrication of osteochondral tissue equivalents by printing topologically defined, cell-laden hydrogel scaffolds. Tissue Eng Part C, 2012, 18: 33-44.
[11] 王雪莹. 3D 打印技术与产业的发展及前景分析.中国高新技术企业, 2012, 26: 3-5.
[12] Cox SC, Thornby JA, Gibbons GJ, et al. 3D printing of porous hydroxyapatite scaffolds intended for use in bone tissue engineering applications. Mater Sci Eng: C, 2015, 47: 237-247.
[13 ]Leong KF, Cheah CM, Chua CK. Solid freeform fabrication of three-dimensional scaffolds for engineering replacement tissues and organs. Biomaterials, 2003, 24: 2363-2378.
[14] 王镓垠, 柴 磊, 刘利彪, 等. 人体器官3D 打印的最新进展. 机械工程学报, 2014, 50: 119-127.
[15] Seol YJ, Kang TY, Cho DW. Solid freeform fabrication technology applied to tissue engineering with various biomaterials. Soft Matter, 2012, 8: 1730-1735.
[16] 贺超良, 汤朝晖, 田华雨, 等. 3D 打印技术制备生物医用高分子材料的研究进展. 高分子学报, 2013, 6: 722-732.
[17] Kumar S, Hofmann M, Steinmann B, et al. Reinforcement of stereolithographic resins for rapid prototyping with cellulose nanocrystals. ACS Appl Mater Interfaces, 2012, 4: 5399-5407.
[18] Linnenberger A, Bodine MI, Fiedler C, et al. Three dimensional live cell lithography. Opt Express, 2013, 21: 10269-10277.
[19] Shin JH,Lee JW,Jung JH,et al.Evaluation of cell proliferation and differentiation on a poly(propylene fumarate) 3D scaffold treated with functional peptides, J Mater Sci, 2011, 46: 5282-5287.
[20] Jansen J, Melchel FPW, Grijpma DW, et al. Fumaric Acid Monoethyl Ester-Functionalized Poly(d,l-lactide)/N-vinyl-2-pyrrolidone Resins for the Preparation of Tissue Engineering Scaffolds by Stereolithography, Biomacromolecules, 2009, 10: 214-220.
[21] Matsuo A, Chiba H, Takahashi H, Toyoda J,et al. Clinical application of a custom-made bioresorbable raw particulate hydroxyapatite/poly-L-lactide mesh tray for mandibular reconstruction. Odontology, 2010, 98: 85-88.

