脂肪乳注射液对一次性使用输液连接管产品中邻苯二甲酸二(2-乙基)己酯的溶出作用
张虹 杨凤敏 李风月 沈刚 杨月阳 王晓杰 张淼 唐亚林
1 中国科学院化学研究所 (北京 100190)
2 北京康健源科技有限公司 (北京 100055)
3 北京国医械华光认证有限公司 (北京 100011)
4 新乡市驼人医疗器械有限公司 (新乡 463400)
0.前言
聚氯乙烯(PVC)类材料在医疗设备中有着 广泛的应用。通常所使用的PVC 类产品中都含有邻苯二甲酸二(2-乙基)己酯(DEHP)增塑剂。DEHP 可以提高塑料的柔软性和耐寒性,降低软化温度,改善加工性能。DEHP 的急性毒性很小,但其亚急性毒性动物试验显示能导致体重减轻、白细胞计数增高、血红蛋白值下降、血尿等,特别是对肝肾功能与生殖功能具有不良影响。另外,DEHP 可导致胎儿死亡率及胎儿畸形率明显增加。因此,需要对PVC 医疗器械中DEHP 的溶出量进行检测,用以确保PVC 医疗器械产品在临床应用中的安全性。
近期研究表明,脂溶性药液可以导致PVC 产品中DEHP 的溶出[1~3]。脂肪乳注射液是由精制大豆油、甘油、精制卵磷脂等制成的静脉输注药液。目前,脂肪乳注射液已广泛应用于手术前后、肿瘤、长期昏迷等不能进食或大面积烧伤等需要补充脂肪营养的病人或婴儿。脂肪乳注射液属于脂溶性药液,对于DEHP 具有较强溶出效果。但因脂肪乳的成分较为复杂,在进行分析检测时难度较大,所以至今还鲜有关于脂肪乳注射液对于DEHP 溶出量的检测报道[4]。鉴于此,我们利用高效液相色谱(HPLC),建立了脂肪乳注射液的DEHP 溶出量检测方法。并利用上述方法,在模拟临床最恶劣使用条件下,考察了PVC 产品在脂肪乳注射液中DEHP 的溶出情况。
1.材料与方法
1.1 试剂与仪器
乙醇(色谱纯,百灵威),纯水(MiLLiQ 超纯水),DEHP 标准物质(Fluka,批号:SZB8301XV,编号:36735-1G),脂肪乳注射液(规格:250mL: 25g;生产厂家:成都科仑药液股份有限公司),分析天平(METTLER TOLEDO AB135-S),高效液相色谱(Shimadzu 20A),一次性使用输液连接管(新乡市驼人医疗器械有限公司,批号:101212)。
1.2 浸提液的制备
1.2.1 DEHP 的浸提实验
脂肪乳注射液在临床使用过程中,一次滴注250~500mL,一日一次。按照临床的最大给药剂量,我们量取500mL,采用循环泵系统,在模拟临床自然滴注的最慢流速(约为1mL/min)的情况下,对一次性使用输液连接管产品中的DEHP 进行浸提。
1.2.2 浸提液的萃取因脂肪乳成分比较复杂,无法将浸提后的样品直接进入 HPLC 进行检测,需要前期进行萃取处理。萃取时,精密吸取浸提后的脂肪乳溶液250 mL,置于分液漏斗中,分别用不同体积的正己烷溶剂进行萃取,并对萃取效果进行对比,确定浸提液的萃取实验参数。萃取后的溶液,合并后放入真空干燥箱中干燥,干燥完全后用乙醇溶解,利用HPLC 进行DEHP 浸出量的检测。
1.3 色谱条件
检测器:紫外/可见光检测器;检测波长n = 272 nm;色谱柱:Sunfire C18, 5μm, 4.6 mm×250 mm;柱温:室温;流动相:甲醇-水(95-5);流速:1.0 mL/min;进样量:20 μL。
1.4 方法学研究
1.4.1DEHP 特征吸收波长的测定
精密称取 DEHP 标准品0.2 mg,用乙醇稀释至4 mL,配制成约含50 μg /mL 的溶液,用紫外-可见分光光度计在200~400 nm 波长范围内进行波谱扫描,根据吸收光谱曲线确定DEHP 的HPLC 检测波长(n)。
1.4.2 DEHP 保留时间的确定
考虑到所用浸提液中也可能含有一定量的 DEHP,因此,对浸提液进行检测,在测定样品时扣除这部分的干扰,将空白的溶剂作为空白溶液。
称取DEHP 适量,用乙醇稀释配置得到100 μg/mL 的溶液作为对照品溶液。在1.3 色谱条件下分别将空白溶液、对照品溶液与测试溶液注入高效液相色谱,记录色谱图,得到DEHP 的出峰保留时间。
1.4.3DEHP 标准曲线的绘制
准确称取 DEHP 对照品适量,置于容量瓶中,以乙醇为溶剂,配制浓度约为2 mg/mL 的DEHP乙醇溶液,取此溶液5 mL 置于50 mL 量瓶中,用乙醇稀释至刻度作为储备液。精确量取此溶液适量,置于容量瓶中,用乙醇稀释分别配制成浓度为200 μg/mL~0.020 μg/mL 的溶液作为供试品溶液。按照1.3 中色谱条件进样测定,得到各个浓度的峰面积值。以样品浓度(C)为横坐标,以相应的峰面积(A)为纵坐标,进行线性回归。
1.4.4 溶液稳定性的测定
量取 DEHP 对照品适量(约10 mg),置10 mL 量瓶中,用乙醇溶解并稀释至刻度。取此溶液1 mL 置10 mL 量瓶中用浸提液稀释定容,分别在0h、4h、8h、12h、24h 小时,按照1.3 色谱条件对此溶液进行测定,考察峰面积的变化。
1.4.5 进样精密度
取溶液稳定性样品,按照1.3 的色谱条件连续测定5 次,得到其峰面积,计算变异系数(RSD),考察实验结果的重复性。
1.4.6 回收率
精密量取 DEHP 对照品适量(约相当于DEHP 8 mg、10 mg 和12 mg),各3 份,分别置于10 mL 量瓶中,用乙醇溶解并稀释至刻度。取此溶液1 mL 置10 mL 容量瓶中用浸提输液器24 h 的供试品溶液稀释定容,作为80%、100%、120%的供试溶液;另取DEHP 对照品适量(约10 mg),置10 mL 量瓶中,用乙醇溶解并稀释至刻度。取此溶液1 mL 置10 mL 量瓶中用乙醇稀释定容,作为对照溶液;以乙醇溶液作为空白溶液,以9 mL 浸提输液器24 h 的溶液和1 mL 的乙醇溶液作为样品溶液。分别取上述四种溶液,分别取上述四种溶液,按照1.3 的色谱条件进行测定,计算3 种不同浓度溶液的回收率(%)。
2.结果与讨论
2.1DEHP 特征吸收波长的确定
DEHP 的紫外吸收光谱图,如图1 所示。从图中可以看出DEHP 在274 nm 处有最大吸收,选定274 nm 为检测波长。
2.2 浸提液萃取次数的确定
精密吸取浸提后的脂肪乳溶液 250 mL,置于分液漏斗中,分别精密加入250mL、500 mL(分两次萃取)和750 mL(分三次萃取)的正己烷溶剂进行萃取。萃取后,合并上清液后放入真空干燥箱中干燥,干燥完全后用乙醇溶解后取此溶液进样,按照1.3 的药效液相色谱方法,对比不同体积下的DEHP 的浸出量,结果如表1 所示。结果表明,随着萃取次数和萃取溶液体积的增加,浸提出的DEHP 量也有所增加,等体积萃取两次和等体积萃取三次的时候结果接近,因此选择等体积萃取两次作为浸提液的后处理方法。
2.3 DEHP 的出峰保留时间

图1. DEHP 的紫外吸收光谱
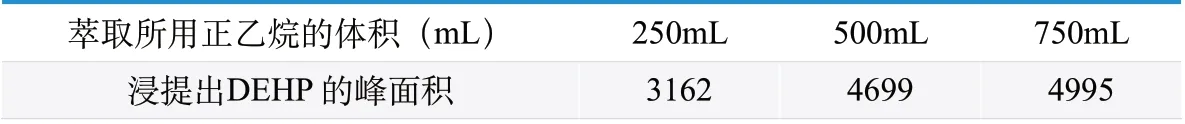
表1. 浸提液萃取结果
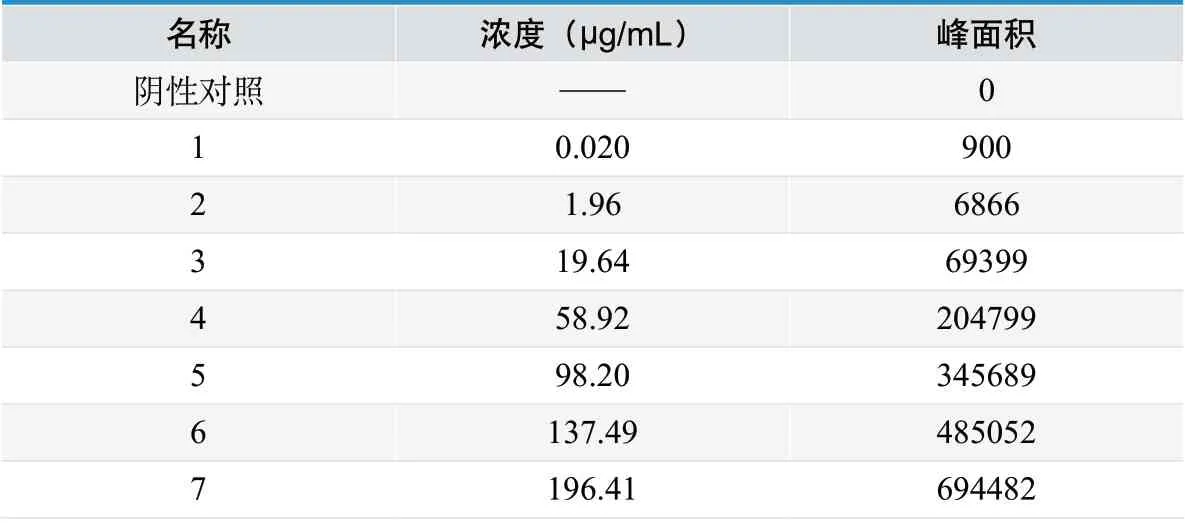
表2. DEHP 溶液浓度及对应的峰面积

表3. 溶液稳定性实验结果

图2. DEHP 的HPLC 保留时间。A:空白溶液;B:DEHP 对照品;C:样品

图3. DEHP 的标准曲线
称取 DEHP 对照品适量约(10 mg),用乙醇超声溶解定容,配制成约100 μg/mL 的溶液作为对照品溶液。取3 套样品和玻璃烧瓶连成一循环系统,加入500mL 脂肪乳注射液并保持在37˚C±1˚C,通过一蠕动泵作用于一段尽可能短的易用硅胶管上,使浸提液以1mL/min 的流量循环,经24 h 分别收集浸提液并冷却至室温后用脂肪乳定容到500 mL,取250 mL 浸提液用正乙烷萃取。将萃取液在真空干燥箱中干燥后,用250 mL 乙醇溶解,作为供试品溶液。在同样的条件下,将脂肪乳注射液利用上述萃取的方法进行萃取,萃取后的溶液作为空白溶液。
在1.3 色谱条件下分别将空白溶液、对照品溶液与测试溶液注入高效液相色谱,记录色谱图,得到DEHP 的出峰保留时间,如图2 所示。
实验结果表明,空白溶液对DEHP 的测定无干扰,DEHP 对照样品溶液的主峰保留时间为10.505 min,供试品溶液的主峰保留时间为 10.563 min,两峰的保留时间基本一致,说明供试品溶液的主峰为DEHP 的色谱峰,DEHP 的峰与邻近的杂质峰分离度良好。
2.4 标准曲线的测定
准确称取 DEHP 对照品适量,置于量瓶中,以乙醇为溶剂,配制浓度约为2 mg/mL 的DEHP 乙醇溶液,取此溶液5 mL 置于50 mL 量瓶中,用浸提液稀释至刻度作为储备液。分别精确量取此溶液适量,分别置于量瓶中,用浸提液稀释分别配制成浓度为200 μg/mL 、140 μg/mL 、100 μg/mL、60 μg/mL、20 μg/mL、2 μg/mL 和0.020 μg/mL 的溶液作为供试品溶液。按照1.3 的色谱条件,量取空白溶液和7 个浓度的供试品溶液各20μL 注入液相色谱仪,以样品浓度(C)为横坐标,以相应的峰面积(A)为纵坐标,进行线性回归。 实验结果表明,DEHP 在0.020~200 μg/mL 浓度范围内,线性方程的R 值为1.000,其浓度与峰面积呈良好的线性关系。
2.5 溶液稳定性
取 DEHP 对照品适量(约10 mg),置10 mL 量瓶中,用乙醇溶解并稀释至刻度。取此溶液1 mL 置10 mL 量瓶中用浸提液稀释定容,分别在0h、2h、4h、6h、8h、12h、24h 用1.3 所述方法对溶液进行测定,考察峰面积的变化,实验结果见表3。实验结果表明,溶液在室温条件下放置24 小时,溶液稳定性试验中溶液峰面积的RSD 值为0.35%,小于2%,说明溶液稳定性良好。
2.6 精密度
取溶液稳定性下样品,按照1.3 的色谱方法进行检测,连续进样5 次,计算RSD 值,结果见表4。实验结果表明,按此方法重复测定样品的峰面积, RSD 值为0.26%,小于2%,说明测定方法重复性良好。

表4. 进样精密度实验结果

表5. 脂肪乳注射液的回收率对照实验结果
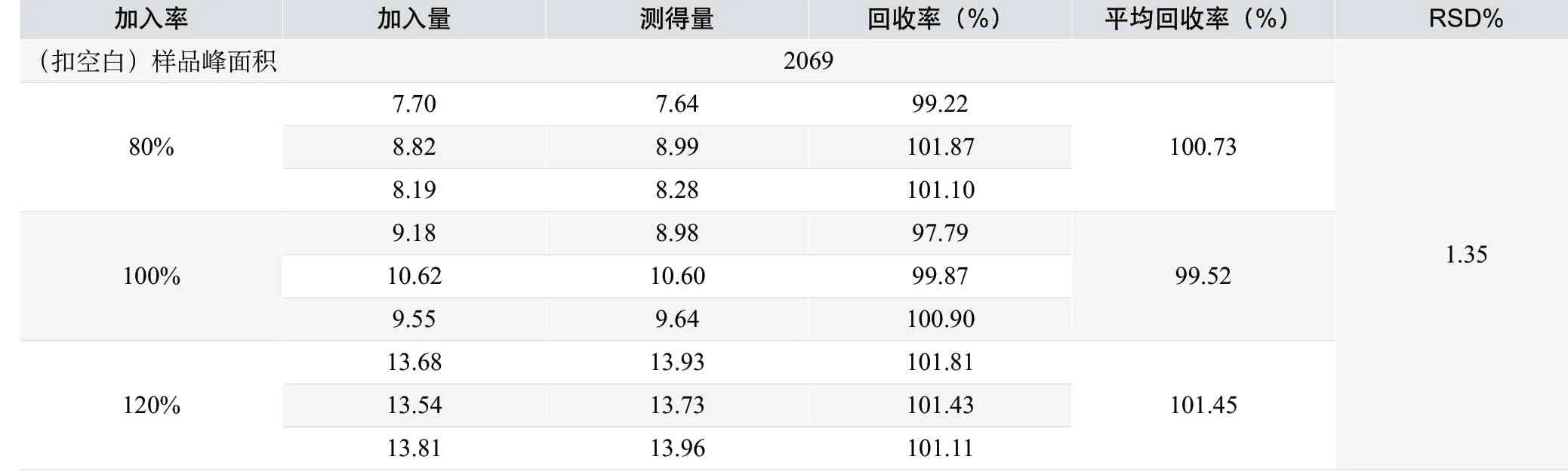
表6. 脂肪乳注射液的回收率实验结果

表7. 脂肪乳注射液对一次性使用输液连接管中DEHP 的对照品实验结果

表8. 脂肪乳注射液对一次性使用输液连接管中DEHP 的溶出实验结果
2.7 回收率结果
回收率结果见表 5 和表6。9 份样品溶出度的回收率平均值分别为100.73%、99.52%、101.45%,均在90.0%~110.0%之间,RSD 值为1.35%,回收率良好,表明本实验采用的测量方法准确度高,精确度好。
2.8 产品DEHP 溶出量的检测
利用 1.3 色谱方法,以脂肪乳注射液为浸提液对一次性使用输液连接管产品中的DEHP 溶出量进行测定,结果见表7 和表8 所示。1#样品和2#样品的DEHP 溶出量分别为0.12 mg/套(样品1)和0.10 mg/套(样品2),均值为0.11mg/套。
3.结论
美国食品与药品管理局(FDA)在2002 年7 月12 日发表了关于DEHP 增塑PVC 医疗器械安全性评价的研究报告,在研究报告的通告中提出要重视和监控医疗器具中DEHP 的释放[5]。脂肪乳注射液是由精制的植物油(大豆油、棉子油、麻油等)与乳化剂等组成的静脉输注脂溶性药液,现已广泛应用于临床。考虑到DEHP 具有一定的脂溶性,并根据化合物相似相溶的原理可知,脂肪乳注射液对于DEHP 具有一定的溶出作用。同时,因为脂肪乳注射液成分较为复杂,所以利用高效液相色谱(HPLC)无法直接进行DEHP 溶出量的检测。本文中,我们首先采用萃取的方法,对脂肪乳浸提液进行萃取,并对萃取参数进行了摸索。而后利用HPLC 对萃取液中的DEHP 进行含量测定。同时,为了尽可能模拟出脂肪乳注射液在临床使用过程中DEHP 的最大溶出量,选用了该药液在临床使用过程中的最大使用剂量(500mL/天),并在37˚C 条件下,进行浸提。
实验结果表明,将脂肪乳浸提液萃取后的溶液,在以甲醇-水(95:5)为流动相,流速1.0 mL/min,检测波长为274nm 的色谱条件下,DEHP 的保留时间为10.563 min,DEHP 的出峰时间与邻近杂质峰分离度良好,可以直接进行检测。按照上述实验参数,本次实验测定的一次性使用输液连接管产品,在脂肪乳注射液中DEHP 的溶出量为0.11mg/套。该方法可以较为快捷的检测脂肪乳注射液中的DEHP 溶出量。同时通过精密度、线性、回收率等实验也证实,该实验方法准确度高、精密度好,可确保实验数据的准确可靠。
[1] Kim J H,Yun J,Sohng J K,et a1.Di(2-ethylhexyl)phthalate leached from medical PVC devices serves as asubstrate and inhibitor for the P glycoprotein[J].Environ Toxicol Pharmacol,2007,23(3):272-278.
[2] 张恩娟,陈琳,曹健.紫杉醇注射液配套输液器中邻苯二甲酸二辛酯的溶出性考察.中国药房,2008,19(9):698-700.
[3] 奚延斐,王春仁,邻苯二甲酸辛酯增塑聚氯乙烯医疗器械的安全性评价,中国医疗器械信息,2005,11(2):27-30.
[4] 辛凤鲜,朱东方,马才,王晓伟,李慧娟,李娜,PVC 静脉营养袋DEHP 溶出量及风险评估,中国医疗器械信息,2012(9):18-23.
[5] US Food and Drug Administration: safety assessment of di(2-ethyLhexyL) phthaLate (DEHP ) released from PVC medical devices. 2002.

