通解口服液对MO D S模型大鼠回肠P P A R-γ、A P-1、N F-κB表达的影响
沈宇清 贾典荣 曹 云 顾志林
(南京中医药大学附属姜堰中医院,江苏姜堰225500)
多器官功能障碍综合征 (multiple organ dysfunction syndrome,MODS)是目前创伤、感染、休克等疾病最重要的死亡原因,目前医学界普遍认为胃肠道是MODS发病过程中受累较早的器官,胃肠黏膜缺血炎症反应是其重要的病理机制之一。近年有研究报道过氧化物酶体增殖物激活受体(PPAR-γ)是调节缺血炎症反应的重要作用靶点,而中药通过干预炎症反应的各个环节发挥着胃肠功能的保护作用。本院研发的通解口服液具有通里攻下、活血化瘀等作用,临床发现其对MODS患者急性胃肠损伤有防治作用[1]。为进一步研究通解口服液防治MODS急性胃肠损伤的机理,本实验通过建立MODS大鼠模型,观察通解口服液对MODS模型大鼠回肠组织PPAR-γ、激活蛋白-1(AP-1)、核转录因子 κB(NF-κB)表达的影响,探索MODS新的防治途径。
1 实验材料
1.1 动物 清洁级SD雄性大鼠48只,体重(190±20)g,由浙江省实验动物中心提供,合格证号:SCXK(浙)2008-0033。
1.2 药物 通解口服液(处方:大黄、蒲黄、败酱草、枳实、茜草各等份,药物浓度0.85g/mL)由泰州市姜堰中医院药剂科提供,批号:20130917,250mL/瓶。氨苄西林 (珠海联邦制药股份有限公司中山分公司),0.25g/粒,批号:30100304,以蒸馏水配成药液。兔抗鼠AP-1抗体(aN-20),美国Santa Cruz公司,批号:sc-12629;兔抗鼠NF-κB p65抗体,武汉博士德生物工程有限公司,批号:bs-0465R;兔抗鼠PPAR-γ抗体,武汉博士德生物工程有限公司,批号:bs-0530R;总蛋白试剂盒,中生北控生物科技股份有限公司,批号:20131117。
1.3 仪器 MP100型16导生理记录仪及其附件,美国BIOPAC公司;Synergy HT型紫外荧光酶标仪,美国Biotek公司;Olympus光学显微镜;瑞典产LKB-V超薄切片机;H-600日立型透射电镜;S-450型日立扫描电镜;HH数显恒温水浴锅,江苏金坛金城国胜实验仪器厂;ALC-MPA2000m型4导生理记录仪及其附件,上海奥尔科特仪器公司;R-911型全自动放免计数仪,中国药科大学实业总公司;7160型日本日立全自动生化分析仪。
2 实验方法
2.1 分组与给药 SD雄性大鼠随机分为6组:空白对照组、模型组(生理盐水 0.018g·kg-1·d-1)、阳性药物组 (氨苄西林0.4g·kg-1·d-1)和通解口服液低(8.5g·kg-1·d-1)、中 (17g·kg-1·d-1)、高 (34g·kg-1·d-1)剂量组,各组间体重无显著性差异。预先分别灌胃生理盐水或药物,连续给药2d,每日2次,最后一次灌胃给药48h后开始禁食不禁水,禁食12h后再灌胃给药1次后造模。
2.2 造模 给药后腹腔注射10%水合氯醛(3.0mL/kg)麻醉,舌下静脉注射脂多糖 (LPS)8mg/kg复制MODS急性胃肠损伤大鼠模型[2]。符合临床实际的MODS实验模型应具备的标准是:(1)损伤因素与临床MODS常见诱因基本一致;(2)发病在致伤24h以后;(3)有 SIRS 的临床表现;(4)有 2 个以上器官或系统的功能障碍;(5)有足够的发病率和死亡率。实验动物MODS的诊断依据与人类基本一致,即:诱因+SIRS+多器官功能障碍[3]。我们实验中大鼠出现生命体征变化,严重肝肾功能损伤,符合MODS诊断[4]。
2.3 指标检测 免疫组化法对回肠进行PPAR-γ、AP-1、NF-κB蛋白表达检测,建模6h后,各组大鼠麻醉后予脱颈处死,迅速取出回肠沿系膜缘剖开,去除内容物,PBS液漂洗,取上段回肠置于4%多聚甲醛固定,固定后的组织在PBS中漂洗5min×3次,上行脱水,将组织块放入二甲苯中5~30min,石蜡包埋,用石蜡切片机切片,厚度为5μm,进行免疫组化染色,显微镜下胞浆呈棕黄色颗粒视为阳性表达。每组取8个标本检测,应用Image-ProPlus6.0分析软件,每个标本选取肌层区域,计算所选区域的面积(area)和所选区域内免疫组化阳性信号总的灰度值的乘积,最后以每组均值进行比较。
2.4 统计学方法 使用SPSS13.0统计软件进行数据分析。计量资料以(±s)表示,采用 t检验。 P<0.05,P<0.01为差异有统计学意义。
3 实验结果
与空白对照组比较,模型组大鼠回肠组织PPAR-γ表达显著降低(P<0.01),AP-1 表达显著升高 (P<0.01),NF-κB 也表现增加趋势。与模型组比较,通解口服液低剂量组与阳性药物组大鼠PPAR-γ的改变不明显(P>0.05),通解口服液中、高剂量可显著增加模型大鼠 PPAR-γ 的表达(P<0.05,P<0.01);各给药组均可明显降低 AP-1、NF-κB 的表达(P<0.05,P<0.01)。与阳性药物组比较,通解口服液中、高剂量对于上述指标的改善更具优势(P<0.05,P<0.01)。 通解口服液各剂量组间比较,体现出一定的量效关系。见表1。
空白对照组大鼠回肠组织可见PPAR-γ阳性(呈棕黄色)表达,模型组、阳性药物组、通解口服液低剂量组大鼠PPAR-γ表达不显(呈浅黄色),通解口服液中剂量组大鼠PPAR-γ表达明显 (呈深黄色),高剂量组可见PPAR-γ阳性(呈棕黄色)表达。见图1。
空白对照组大鼠回肠组织未见AP-1阳性表达,模型组大鼠见AP-1阳性表达(呈棕黄色),阳性药物组和通解口服液低、中剂量组大鼠AP-1表达不明显(呈浅黄色),通解口服液高剂量组大鼠回肠组织未见AP-1阳性表达。见图2。
空白对照组大鼠回肠组织未见NF-κB阳性表达,模型组大鼠见NF-κB阳性表达(呈棕黄色);阳性药物组和通解口服液低、中剂量组大鼠NF-κB阳性表达不明显(呈浅黄色),通解口服液高剂量组大鼠回肠组织未见NF-κB阳性表达。见图3。
表 1 各组大鼠回肠组织 PPAR-γ、AP-1、NF-κB 表达比较(±s)
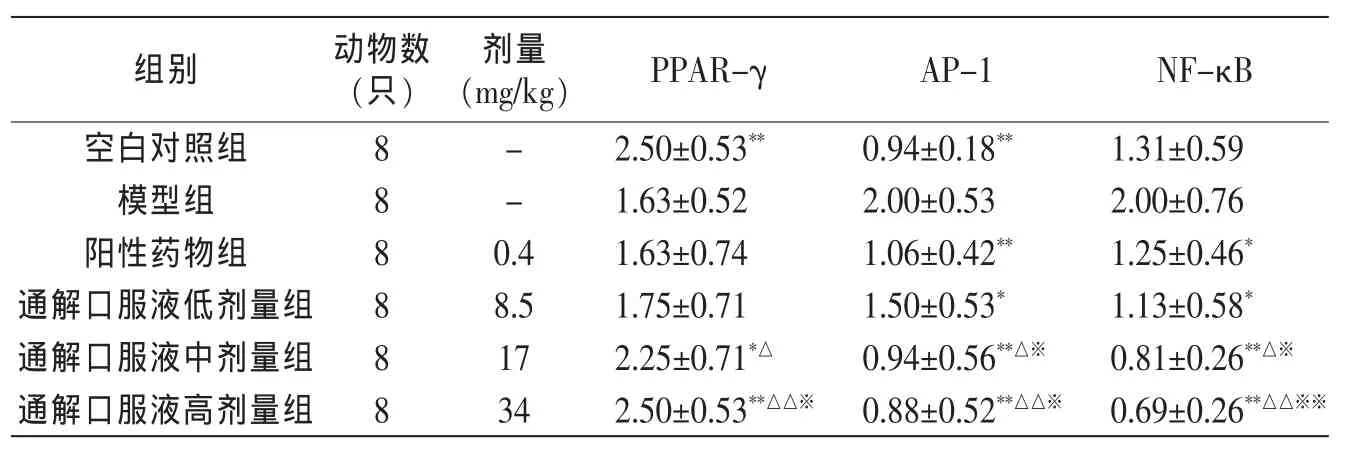
表 1 各组大鼠回肠组织 PPAR-γ、AP-1、NF-κB 表达比较(±s)
注:与模型组比较,*P<0.05,**P<0.01;与阳性药物组比较,△P<0.05,△△P<0.01;与通解口服液低剂量组比较,※P<0.05,※※P<0.01。
组别 动物数(只)阳性药物组 8 1.06±0.42** 1.25±0.46*通解口服液低剂量组 8 1.50±0.53* 1.13±0.58*通解口服液中剂量组 8 0.94±0.56**△※ 0.81±0.26**△※剂量(mg/kg)PPAR-γ空白对照组通解口服液高剂量组 8 0.88±0.52**△△※ 0.69±0.26**△△※※- 2.50±0.53**- 1.63±0.52 0.4 1.63±0.74 8.5 1.75±0.71 17 2.25±0.71*△34 2.50±0.53**△△※AP-1 8 NF-κB 0.94±0.18**1.31±0.59模型组82.00±0.53 2.00±0.76

图1 各组大鼠回肠组织PPAR-γ表达的病理图片(HE,×400)
4 讨论
MODS是指机体遭受严重急性损伤后,由于失控的全身炎症反应,使机体在短时间内(>24h)同时或序贯出现两个或两个以上系统器官功能障碍的临床综合征,而医学界普遍认为胃肠道是促发MODS的始动器官和靶部位。胃肠功能状态被认为是判断危重病人预后的一项重要指标。胃肠运动功能的恢复有助于有效阻断MODS的进一步发展。目前针对MODS胃肠功能损伤尚无特效药,临床上主要采用肠内营养、抑酸、改善肠动力等治疗,但疗效并不理想,因此采用中医药干预成为当前研究的热点。我们既往研究发现,通瘀解毒法有助于改善MODS患者胃肠功能,因此设计本实验做一次机理探索。
PPAR-γ是一类依赖配体激活的核转录因子,参与许多生理反应的调节,其生物学功能复杂多样,包括调控脂肪和糖代谢、脂肪细胞终末分化、抗肝纤维化作用,减轻细胞氧化应激损伤,保护脏器功能等。近年来研究发现,PPAR-γ及其激动剂在抗缺血再灌注损伤方面起着重要作用,是细胞炎症及缺血反应的重要调节因子[5]。PPAR-γ被其天然与合成配体激活后,可抑制炎性细胞因子白介素-1(IL-1)、IL-6及肿瘤坏死因子-α(TNF-α)等的分泌,抑制黏附因子ICAM-1及P-选择素、E-选择素等的表达,同时也能减少诱导型一氧化氮合酶(iNOS)的表达,从而发挥抑制炎症反应、改善血管内皮功能的作用。上述炎性因子的表达均依赖于转录因子:激活蛋白-1(AP-1)、核转录因子 κB(NF-κB)的活性而发挥作用,而活化的PPAR-γ可以抑制二者的活性。临床研究表明,MODS患者PPAR-γ活性明显下调[6]。脓毒血症及肠炎患者体内PPAR-γ表达减少,IL-1、IL-6及 TNF-α 表达水平较高[7-8],特别是MODS患者。因此上调PPAR-γ的表达在MODS急性胃肠损伤的防治中有重要的意义。

图2 各组大鼠回肠组织AP-1表达的病理图片(HE,×400)
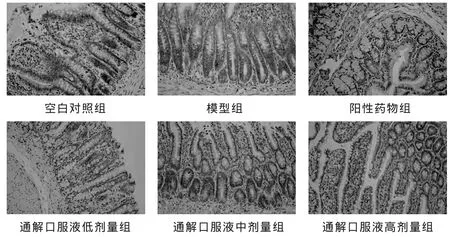
图3 各组大鼠回肠组织NF-κB表达的病理图片(HE,×400)
我们经过长期临床观察,发现MODS起病急骤,病情重笃,发生变证时多有毒,伤血动血败血甚者必有毒,病情顽固缠绵者常蕴毒,症见秽浊者则有毒。MODS的临床特点和病理演变符合中医学“毒”的特性,而急性胃肠功能损伤则是“热从毒化,变从毒起,瘀从毒结”的结果之一。我们抓住MODS急性胃肠损伤“毒瘀互结”的病理中心,以“六腑以通为用”之要义,确立了通瘀解毒的治疗大法,并研制出通解口服液应用于临床。通解口服液中大黄、败酱草解毒通瘀,既能清解热毒,又能化瘀通腑,共为君药;配伍枳实、蒲黄、茜草,达到疏与通合,清与散配,化瘀而不动血,止血而不留瘀的效果。既往研究发现通解口服液可改善MODS患者胃肠功能[9],对MODS大鼠炎症反应具有明显的抑制作用[4]。本研究以回肠PPAR-γ、NF-κB和AP-1蛋白的表达为观察指标,评估通解口服液对PPAR-γ、NF-κB和AP-1调控作用。结果显示,各剂量的通解口服液均可上调MODS模型大鼠回肠组织PPAR-γ的表达,降低NF-κB和AP-1的表达,且以中、高剂量组改善程度更明显,认为通解口服液对MODS模型大鼠回肠组织 PPAR-γ、AP-1、NF-κB 表达的影响与其剂量有一定的相关性。通解口服液可能是通过激活抗氧化系统、抗炎、保护血管内皮等作用防治MODS。下一步我们将更深入地研究PPAR-γ、炎症因子与肠平滑肌细胞之间的相关性,从微观角度探讨通解口服液防治MODS胃肠损伤的作用靶点。
[1] 郑小丹,沈宇清,曹云,等.通瘀解毒法防治MODS急性胃肠损伤的临床研究.中医药临床杂志,2014,26(4):356
[2] 乔万海,屈莉,师猛,等.MODS大鼠外周血中PPAR-γ与TNF-α和IL-10动态变化的研究.第四军医大学学报,2009,30(8):690
[3] 胡森,盛志勇,周宝桐.MODS动物模型研究进展.中国危重病急救医学,1999,11(8):504
[4] 郑小丹,沈宇清,曹云,等.通瘀口服液对多器官功能障碍综合征大鼠模型IL-6、TNF-α的影响.上海中医药杂志,2015,49(1):87
[5] Kapadia R,Yi JH,Vemuganti R.Mechanisms of antiinflammatoryand neuroprotective actionsofPPAR-gamma agonists.Front Biosci,2008,13:1813
[6] 汤石林,赵正亮,王桥生,等.脓毒症大鼠PPAR-γ与脂联素表达水平的相关性研究.海南医学,2012,23(3):317
[7] 黄晓梅,曾勉,卢桂芳,等.脓毒症大鼠有核细胞PPAR-γ活性变化对TNF-α及IL-4的影响.中山大学学报(医学科学版),2010,31(5):630
[8] 吴钱红,刘喆.过氧化物酶体增殖物激活受体Ⅴ在炎症过程中调控作用的研究进展.广西中医学院学报,2011,14(2):79
[9] 席峰,曹云,沈宇清.通瘀解毒法“治未病”干预MODS的临床疗效评价.中医药临床杂志,2014,26(12):1224

