土壤中6种氯代多环芳烃测定方法的建立及应用
原文婷,高占啟,孙成*
(1.污染控制与资源化研究国家重点实验室,南京大学环境学院,江苏 南京 210023;2.国家环境保护地表水环境有机污染物检测分析重点实验室,江苏省环境监测中心,江苏 南京 210036)
·监测技术·
土壤中6种氯代多环芳烃测定方法的建立及应用
原文婷1,高占啟2,孙成1*
(1.污染控制与资源化研究国家重点实验室,南京大学环境学院,江苏 南京 210023;2.国家环境保护地表水环境有机污染物检测分析重点实验室,江苏省环境监测中心,江苏 南京 210036)
建立了加速溶剂萃取、凝胶渗透色谱(GPC)与气相色谱-质谱联用测定土壤中6种氯代多环芳烃的分析方法。研究证实该法的最佳萃取条件为:10.34 MPa压力,100 ℃萃取温度下,以1∶1(V/V)的正己烷/二氯甲烷为萃取溶剂,静态萃取10 min,循环4次。GPC净化过程用乙酸乙酯和环己烷的混合液1∶1(V/V)做洗脱液,目标物的收集时间为25~35 min。方法对Cl-PAHs在1~500 μg/L范围内线性良好,相关系数R2为0.998 4~0.999 7;LOD和LOQ分别为2.6~25.1 pg/g和8.7~83.6 pg/g;各目标物的低浓度回收率为64.1%~117.6%,RSD<12.05%;高浓度回收率为59.1%~105.3%,RSD<9.81%。研究证实该法满足定量分析的要求,并应用该法对某化工园进行了氯代多环芳烃的检测。
加速溶剂萃取;凝胶渗透色谱;氯代多环芳烃;土壤
氯代多环芳烃(Cl-PAHs)是多环芳烃(PAHs)上的一个或多个氢原子被氯原子取代后生成,从结构上看可以称为二噁英与多环芳烃的杂交体[1]。Cl-PAHs与其母体具有同源性,但其毒性与母体相当甚至高于母体,是一类新型的高风险有机污染物[2-3]。
常见的土壤中有机物的萃取方法包括索氏提取法[4]、微波辅助萃取法(MAE)[5]和加速溶剂萃取法(ASE)[6]等。常见的净化方法有柱层析净化、凝胶渗透色谱(GPC)。目前关于土壤中Cl-PAHs 检测方法的报道较少,Ma等[7]在前人研究基础上,将环境样品经16 h索氏萃取后,先经活化的硅胶柱进行分级分离,然后将分离液经活性炭和硅胶的混合柱净化分离,浓缩净化,用气相色谱-质谱(GC-MS)分析。但这些方法或前处理耗时较长,或需使用高级的分析仪器,限制了其的广泛应用。其中,ASE是可以从各种半固体或固体样品中萃取有机物质的全新萃取方法[8];GPC则是一种体积排阻色谱,只依靠分子尺寸大小不同进行分离的纯化或分子质量分级方法,对去除环境样品中大分子特别有效[9]。
现采用ASE与GPC相结合的前处理方法,与GC-MS分析技术联用,建立了土壤中6种Cl-PAHs 的分析检测方法,并将其应用于某化工园Cl-PAHs的污染测定[10]。
1 实验部分
1.1 仪器及试剂
所用主要仪器及试剂详见表1和表2。

表1 实验所用仪器

表2 实验所用试剂
准确称取6种标准品和内标(氘代菲)各1 mg,用正己烷配制成100 mg/L储备液备用。使用前用正己烷逐级稀释成相应浓度的标准溶液。
1.2 土壤样品采集
根据某化工园区的地形,按照网格布点法(2.3 km×27 km)划分,共设置了17个点位(见图1)。采样时拂去表层的枯枝落叶和石砾,采集5~20 cm的表层土,并立刻冷冻保存。使用时将预冻存的土壤冻干处理7 d左右,研磨后,过200目金属筛,保存于-20 ℃的冰箱待分析。
1.3 土壤样品前处理
1.3.1 ASE萃取
称取2 g去活化硅藻土,与5 g土壤样品混合均匀,以硅藻土、硅藻土与土样混合物、硅藻土的“三明治“形式加到加速溶剂萃取池中。在10.34 MPa压力下,按设定好的萃取溶剂配比、萃取温度、静态萃取时间及循环次数萃取,萃取结束后,将收集的萃取液转移到旋转蒸发瓶中,旋转蒸发至约1 mL,用体积比为1∶1的乙酸乙酯和环己烷混合溶剂定容至10 mL GPC小瓶,待进一步GPC净化。

图1 某化工园区土壤采样点分布
在进行ASE萃取条件的优化时,称取5 g标准土(经测定无目标物检出),加入1 mL 1.0 mg/L的Cl-PAHs的混合标准溶液,即加标量为200 ng/g,参照土壤中PAHs的含量选取加标量,平衡过夜,然后再按照上述萃取流程进行萃取。
1.3.2 GPC净化
样品通过5.0 mL定量阀进入到装有Biobead S-X3 填料的 GPC 柱,用1∶1(V/V)的乙酸乙酯/环己烷做洗脱液,流速为4.7 mL/min。收集指定时间的流出液至旋转蒸发瓶,蒸发至近干,加入50 μL 质量浓度为1mg/L的氘代菲作为内标,用正己烷定容至1 mL。转移至棕色小瓶待上机检测。
1.4 GC-MS分析条件
色谱柱采用DB-5MS(30 m×0.25 mm×0.25 μm);载气为高纯度氦气(纯度≥99.999%);流速1 mL/min;脉冲不分流进样;色谱柱程序升温:80 ℃保持1 min,25 ℃/min升温至200 ℃,再以 1 ℃/min升温至213 ℃,保持1 min;进样口温度280 ℃;电子轰击离子源(EI);电子加速电压 70 eV;离子源温度250 ℃;传输线温度280 ℃; Cl-PAHs的GC-MS保留时间和特征离子见表3。

表3 6种Cl-PAHs及内标phe-d10的色谱保留时间和 SIM 定量离子
2 结果与讨论
2.1 ASE条件的优化
2.1.1 萃取温度
在固液萃取过程中,提高温度能增加目标物在溶剂中的溶解度,同时加快分子运动速度,提高萃取的速率;但在高温下,当萃取溶剂发生气化时,气体的溶解效率小于液体,反而会降低萃取效果。ASE不仅可以在高温下进行萃取,同时提供了较高的压力,使溶剂的沸点升高,确保溶剂在萃取过程中一直保持液态。现通过设定萃取温度为80,100,120和140 ℃,比较不同萃取温度下的萃取效果,结果见图2。
由图2可见,9-ClFle在100 ℃时萃取率为71.79%,优于其他温度,但其重复测定的回收率RSD较大,实验重现性较差,推测可能是9-ClFle在萃取过程中结构不稳定易发生变化;其他的5种Cl-PAHs 在120 ℃下萃取效果最好,100 ℃时的回收率略低于120 ℃时的回收率。由于9-ClFle 在120 ℃时回收率只有47.21%,综合考虑各Cl-PAHs的萃取效率,确定100 ℃为最终的萃取温度。

图2 不同萃取温度对Cl-PAHs 的回收率影响
2.1.2 萃取溶剂
加速溶剂萃取仪常用的萃取溶剂有乙酸乙酯、丙酮、二氯甲烷、正己烷,Cl-PAHs索式提取溶剂则多为正己烷与二氯甲烷,考虑到ASE萃取与索式提取原理相似,选择正己烷与二氯甲烷的混合溶液作为萃取溶剂,并考察正己烷/二氯甲烷(V/V)为4∶1,1∶1,1∶2,1∶4时的萃取效率,不同溶剂配比的萃取结果见图3。从图中看出,正己烷/二氯甲烷(V/V)为1∶1时萃取效果最佳,6种Cl-PAHs都有较高的萃取回收率,故选择萃取溶剂的配比正己烷/二氯甲烷(V/V)为1∶1。

图3 不同萃取溶剂配比对Cl-PAHs 的回收率影响
2.1.3 萃取时间
相比索式提取,ASE可在几十分钟内完成索式提取十几个小时的萃取工作,不仅大大缩短了前处理的工作时间,而且减少了前处理的工作量。ASE萃取的时间会对萃取效率产生一定的影响,静态萃取时间过短则萃取不完全,过长既会增加前处理时间,又会导致热不稳定物质发生变化。现通过设定的6,8,10和14 min 4个不同的萃取时长,探究最佳的萃取时间,结果见图4。

图4 不同萃取时间对Cl-PAHs 的回收率影响
由图4可见,对氯代蒽类,10和14 min的萃取回收率相近;对9-ClFle,8 min的萃取回收率最高,随着萃取时间的增长,萃取效率反而降低;对9,9-Cl2Fle和9-ClFle,10 min萃取效率最高,时间继续加长,也会导致回收率的降低。由此可以推测,氯代蒽类物质的热稳定性要高于氯代芴类,前者能够较长时间处于较高萃取温度而不发生结构变化;氯代芴类物质的热稳定性较差,不利于长时间的高温萃取。综合考虑6种Cl-PAHs所需萃取时间和最终的萃取效率,确定最终静态萃取时间为10 min。
2.1.4 萃取循环次数
加速溶剂萃取仪可通过不断补存新鲜萃取溶剂实现循环多次萃取,其萃取效果优于单次大体积的萃取或单次长时间的萃取效果,这也是ASE萃取效率高于其他萃取方法的关键。现通过设定循环次数分别为1,2,3和4次,探究不同循环次数对萃取效果的影响,结果见图5。
循环萃取3次及以上对于大部分的Cl-PAHs就可以达到较为理想的萃取回收率。考虑到增加一次循环,整个萃取时间仅增加10 min,为了追求更好的萃取效果,故确定萃取循环次数为4次。

图5 不同循环次数对Cl-PAHs 的回收率影响
2.2 凝胶渗透色谱净化条件优化
土壤样品中有很多的生物大分子存在,萃取时很容易跟随目标物一起进入有机溶剂,通过GPC可以有效地除去这类杂质。
现用体积比为1∶1的乙酸乙酯和环己烷混合溶剂,配置5 μg/mL的Cl-PAHs混合标液于10 mL GPC小瓶中,过GPC,出峰时间见图6。由图6可知,Cl-PAHs的出峰时间为25~35 min。由文献可知,油脂类、蛋白质等大分子出峰时间在2~10 min之间,故确定Cl-PAHs经GPC净化的收集时间为25~35 min。
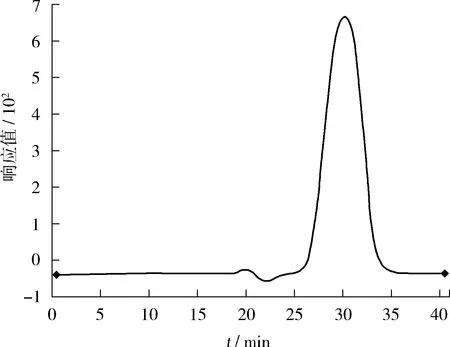
图6 Cl-PAHs标准物质在 GPC 柱上的流出曲线
2.3 方法的质量控制
将100 mg/L的Cl-PAHs储备液用正己烷逐级稀释成500,200,100,50,20,10,5,2和1 μg/L,内标物氘代菲质量浓度为50 μg/L,用内标法进行定量。结果显示,在1~500 μg/L范围内,方法线性良好,6种Cl-PAHs的线性相关系数R2均>0.995。
为评价建立的ASE-GPC-GC-MS分析土壤中Cl-PAHs方法的可行性,测定了方法的检测限(LOD)、定量限(LOQ)、准确度和精密度。LOD是在S/N=3时得出的浓度,即测定低浓度样品时从仪器中得出S/N,不断减小浓度,使得S/N不断地接近3,进而得到LOD;定量限按LOQ=3.3LOD计算,结果见表4。由此可知该分析方法满足定量分析的要求。
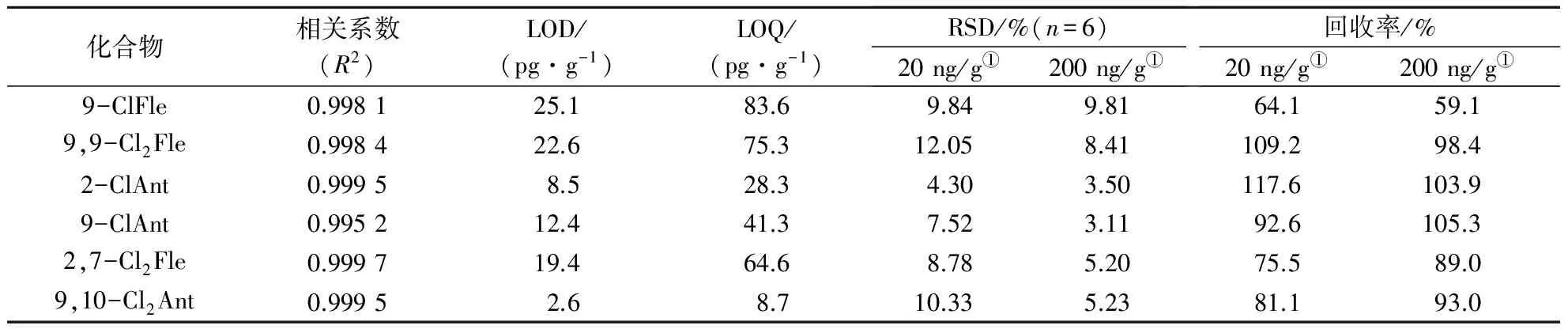
表4 土壤中 Cl-PAHs的加标回收率、精密度和灵敏度
①代表不同的加标量
2.4 方法的实际应用
按照文中建立的方法对某化工园区17个采样点进行检测,结果见表5。
由表5可知,各点位Cl-PAHs 的总质量比为12.78~60.98 ng/g,质量比均值为30.84 ng/g;其中9,9-Cl2Fle、2-ClAnt、9-ClAnt、9,10-Cl2Ant在所有点位均有检出,9,9-Cl2Fle质量比最高,为2.80~22.16 ng/g,为主要污染物;9-ClFle虽只在S3、S7~S12这7个点位有检出,但其检出质量比较高,中值为12.92 ng/g,即 9-ClFle 的污染范围虽较小,但相对集中,且污染水平较高。3种氯代蒽虽在各采样点均有检出,但检出水平较低,由此推测氯代蒽污染在化工园区及其周边普遍存在,但积累水平比较低。

表5 南京化工园区及周边采样点Cl-PAHs浓度水平 mg/g
结合化工园区区位与采样点位,综合分析得到污染比较集中的点位在北部区域,此处主要集中发展石油天然气、有机和精细化工生产。S8和S9位于一个国家级石化企业区域内,故其Cl-PAHs浓度较高。在化工区外的土壤中Cl-PAHs污染程度较低,由此可以推测化学产品加工是产生Cl-PAHs,的来源之一。从化工园区周边污染情况分析来看西北方向污染程度较高,东边相比污染程度稍低。西南方向为江心洲,当地主要以农业旅游为主,污染程度低。S17为夹江水源地,附近管制严格没有化工厂,分析结果也显示此处的污染程度最低。在S14、S15、S16、S17有较低浓度检出,可以推测Cl-PAHs可以通过颗粒物吸附,水体流动等途径使得污染向周边扩散。
3 结语
实验优化了ASE的萃取条件,建立ASE-GPC-GC-MS联用分析环境土壤中6种Cl-PAHs的方法。该法方便快捷,且实现自动化,具有较强的实际应用价值,可以广泛用于环境介质中Cl-PAHs的检测分析。在实际样品的检测中有一定浓度的目标物检出,因此不可忽视Cl-PAHs在化学工业园的积累和对周边的扩散。
[1] OHURA T,AMAGAI T,MAKINO M.Behavior and prediction of photochemical degradation of chlorinated polycyclic aromatic hydrocarbons in cyclohexane[J].Chemosphere,2008,70 (11):2110-2117.
[2] 孟凡生, 陈晶,王业耀.环境中多环芳烃前处理和分析方法[J].环境监控与预警,2011,3(1):12-16.
[3] FU P P,VON T,LINDA S,et al.Halogenated-polycyclic aromatic hydrocarbons:A class of genotoxic environmental pollutants[J].Journal of environmental science and health part C environmental carcinogenesis and ecotoxicology reviews,1999,17 (2):71-109.
[4] WANG W T,MENG B J,LU X X,et al.Extraction of polycyclic aromatic hydrocarbons and organochlorine pesticides from soils:A comparison between Soxhlet extraction,microwave-assisted extraction and accelerated solvent extraction techniques[J].Analytica chimica acta,2007,602(2):211-222.
[5] ESKILSSON C S,BJORKLUND E.Analytical-scale microwave-assisted extraction[J].Journal of chromatography A,2000,902 (1):227-250.
[6] SUN H W,GE X S,LV Y K,et al.Application of accelerated solvent extraction in the analysis of organic contaminants,bioactive and nutritional compounds in food and feed[J].Journal of Chromatography A,2012,(1237):1-23.
[7] MA J,HORII Y,CHENG J P,et al.Chlorinated and parent polycyclic aromatic hydrocarbons in environmental samples from an electronic waste recycling facility and a chemical industrial complex in China[J].Environmental science & technology,2009,43 (3):643-649.
[8] RICHTER B,COVINO L.New environmental applications of accelerated solvent extraction[J].LC-GC,2000,18(10):1068-1073.
[9] MOORE J.Gel permeation chromatography.I.A new method for molecular weight distribution of high polymers[J].Journal of polymer science part A:general papers,1964,2 (2):835-843.
[10] 周灵辉, 胡恩宇,杭维琦,等.长江南京段重点污染源有机污染物的定性分析[J].环境监控与预警,2010,2(6):39-49.
Method Development and Application for the Determination of Chlorinated Polycyclic Aromatic Hydrocarbons in Soil
YUAN Wen-ting1, GAO Zhan-qi2, SUN Cheng1*
( 1.StateKeyLaboratoryofPollutionControlandResourceReuse,SchooloftheEnvironment,NanjingUniversity,Nanjing,Jiangsu210023,China; 2.StateEnvironmentalProtectionKeyLaboratoryofMonitoringandAnalysisforOrganicPollutantsinSurfaceWater,EnvironmentMonitoringCenterofJiangsuProvince,Nanjing,Jiangsu210036,China)
A method was developed for the determination of 6 chlorinated polycyclic aromatic hydrocarbons (Cl-PAHs) in soil by accelerated solvent extraction (ASE), gel permeation chromatography (GPC) coupled with GC-MS. The optimal ASE efficiency was obtained when using 1:1(V:V) dichloromethane/n-hexane as the extraction solvent, and performing the static extraction under 10.34 MPa pressure for 10 min at 100 ℃ for four times repeatedly. The obtained extract was passed through GPC to clean up and eluted with 1∶1 (V:V) cyclohexane/ethyl acetate. The fraction was collected between 25 and 35 min. Good linearity was observed in the range of 1 to 500 μg/L of Cl-PAHs, with correlation coefficients varying from 0.9984 to 0.9997. The limits of detection and limits of quantification were 2.6~25 pg/g and 8.7~83.6 pg/g, respectively. The recoveries for the studied Cl-PAHs ranged from 64.1% to 117.6% with the relative standard deviations less than 12.05% when the spiked concentration was low. When the spiked concentration was high, the recoveries ranged from 59.1% to 105.3% with the relative standard deviations less than 9.81%. This method was shown to meet the requirement for quantification analysis. It was applied in the determination of Cl-PAHs in the soil of a chemical park.
Accelerated solvent extraction; Gel permeation chromatography; Cl-PAHs; Soil
2015-06-12;
2015-07-31
江苏省环境监测科研基金资助项目(1208)
原文婷(1988—),女,硕士,主要研究方向为环境分析化学。
*通讯作者:孙成 E-mail: envidean@nju.edu.cn
O657.7+1;X833
B
1674-6732(2015)06-0013-05

