光催化还原二氧化碳研究进展
张溪文,程旭东
(浙江大学材料科学与工程学院,杭州 310027)
随着工业的不断发展,人类对能源的需求越来越大,随之而来的是化石能源的消耗越来越大,CO2的排放量与日俱增。根据国际能源署(IEA)统计,2014年全球CO2排放量为323亿t。而CO2是温室效应的主要原因之一。同时,对化石能源的过度依赖使能源短缺的问题愈发突出。而对二氧化碳进行光还原处理则是解决温室效应和能源问题的关键。
CO2是典型的直线型对称三原子分子,电子多集中于两侧的氧原子上,分子结构非常稳定,不易活化,这决定了CO2分子是弱的电子供体和强的电子接受体(电子亲和能3.8 eV)。所以,CO2光催化还原要求CO2分子必须进行预活化,常用的方法有热解活化、电催化活化、配位活化、生物酶活化和还原活化。
CO2光催化技术就是利用光触媒材料产生的光生电子将CO2催还还原为一些具有实际使用价值的有机物,如甲醇、甲烷等。相对于其他CO2处理技术,光催化具有环保污染小、反应条件温和、耗能低等优点。所以,CO2光催化技术在治理CO2及其应用领域拥有潜在的使用价值和广阔的开发前景。
1972年,Fujishima和Honda发现了TiO2分解水的现象[1],从此开辟了光催化研究的新领域。1978年,Halmann报道了采用GaP作为催化剂将CO2还原为HCHO、CH3OH和HCOOH,这拉开了CO2光催化还原为简单有机物的研究序幕[2]。不久,Inoue等[3]报道了利用TiO2、WO3等半导体材料将水溶液中的CO2在光照条件下进行催化还原,得到了HCHO、HCOOH、CH3OH和CH4,并且探讨了光催化还原CO2的反应原理。自此,光催化还原逐渐吸引了科研工作者的注意。
1 光催化还原CO2机理
光催化还原CO2的反应机理是基于对植物光合作用的模拟。绿色植物通过光合作用固定CO2为自然界提供了赖以生存的物质基础,这也为人工模拟光还原CO2提供了启发和借鉴[4-7]。光合成还原CO2的反应实质上是在光子作用下的氧化-还原反应过程。它由以下基本过程构成:1)CO2、H2O等反应物吸附于光催化材料的表面;2)在光照作用下,光催化材料产生电子-空穴对;3)未复合的电子、空穴分别移至光催化材料表面;4)电子和空穴和CO2等反应物之间进行反应;5)产物脱附于光催化材料表面。
所以,要实现光催化还原CO2,必须满足以下2个条件[8]:1)光子能量大于或等于电子从价带跃迁至导带所需要的带隙能量值;2)价带电位比表面电子供体电位更正,导带电位比表面电子受体电位更负。
对于光催化还原CO2反应,具有高产物选择性高和催化产率的催化剂是光催化还原技术的关键,也是科研人员努力的方向。目前,常见的光催化剂有二氧化钛、其他金属氧化物及无机半导体材料等。一些常见的半导体材料的能带位置如图1所示。
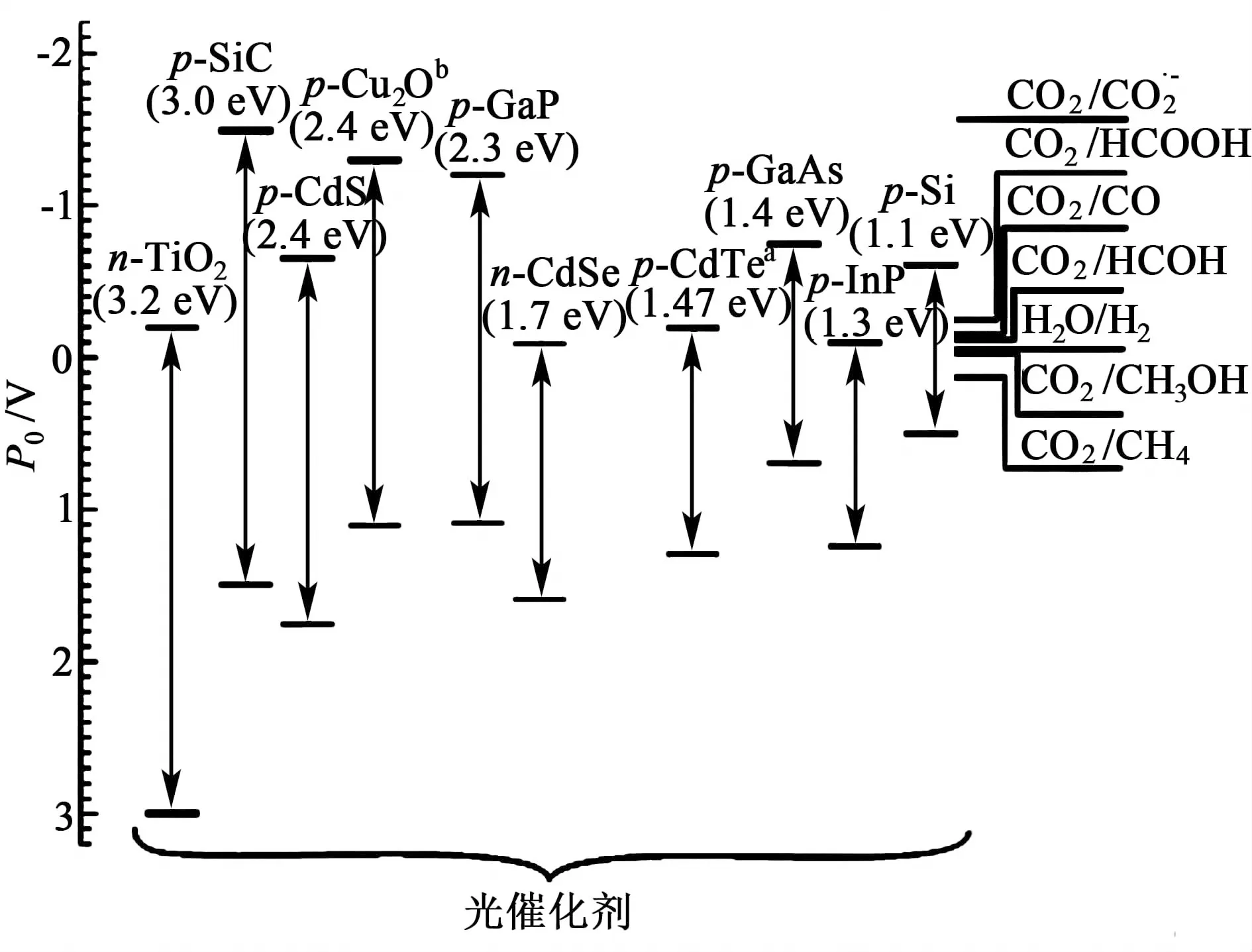
图1 常见半导体能带位置[9]Fig.1 Position of energy bands of semiconductors[9]
2 TiO2基光催化剂
目前TiO2被认为是最具前景的光催化材料,其具有无毒、无害、化学性质稳定、价格低廉等优点。同时,TiO2也存在一些问题,如只对紫外波段产生光响应,光生电子空穴对复合率高等。为解决以上问题,科研人员TiO2基光催化剂进行了大量深入的研究,包括单一TiO2、掺杂型TiO2、金属改性TiO2、半导体复合TiO2、有机光敏化TiO2和黑色TiO2。
2.1 单一TiO2
TiO2有3种不同的晶型:金红石型、锐钛矿型和板钛矿型。板钛矿由于不稳定而较少应用,故CO2光催化的研究主要集中在锐钛矿型和金红石型。虽然相对而言金红石型是更为稳定的晶相,但锐钛矿型的光催化性质更加优越[10-13]。关于TiO2的合成方法,常见的有溶胶-凝胶法[14]、水热法[15]、浸渍法[16],此外还有直流反应磁控溅射法[17]等。
Anpo课题组[18-22]将通过对不同尺寸锐钛矿型TiO2光催化还原CO2的实验,探讨了载体、颗粒分散度、反应温度、CO2和H2O的比例等对光催化还原CO2的影响。在77 K下,通过用电子自旋共振仪揭示了CO2和H2O之间的反应是通过Ti4+和Ti3+之间的电子转移实现的。
Yamashita等[13]通过研究金红石TiO2和锐钛矿TiO2的还原产物发现(100)面作为表面参与反应时的主要产物是CH4和CH3OH,而(110)面参与反应时只有CH3OH。产生这种现象的原因是反应表面的几何结构及Ti/O原子比不同,从而引起表面接触吸附的情况不同,进而最终导致了还原产物的不同。
此外,TiO2的光催化性能与TiO2的形貌和晶粒大小密切相关[10]。
2.2 非金属掺杂
锐钛矿TiO2的禁带宽度是3.2 eV,只能对紫外波段的光产生相应,所以对TiO2进行掺入非金属元素是改变其光谱相应范围的一个有效方法。其中,掺N是一种重要的非金属元素掺杂方法。1986年,Sato[23]报道了通过在TiO2晶格中掺入N会引起可见光响应。而后Asahi等[24]研究了在TiO2中掺N而提高TiO2光催化活性的原因。这是因为N取代了少量O而引起能带尾拖展,减小了带隙值,使TiO2对可见光产生相应。
通过掺杂提高TiO2光催化性能须满足以下条件[24]:1)掺杂后的TiO2能够对可见光产生相应,这要求带隙值至少小于3.1 eV;2)掺杂后,导带位置不能发生大的改变,仍需小于H2/H2O还原电位;3)掺杂元素的能级与TiO2的能带需要有一定程度的重合,以保证电子空穴对能够及时移动到催化剂表面,减小电子空穴对复合率。由于条件2)和3),阴离子相对阳离子来说更适合于TiO2掺杂。
TiO2掺N常用方法是气-固反应法。将TiO2或其前驱体置于NH3/N2或NH3/Ar的混气中焙烧,通过焙烧参数调节含氮量的不同[25-27]。此外,卤素元素、C[28]、B[28]、S[29-30]也是常见的掺杂元素。
除了单元素掺杂以外,还可以对TiO2进行2种或更多元素共掺,这样可以进一步拓宽TiO2光响应波段范围并可以得到更小晶粒尺寸的TiO2,提高比表面积。如,Nukumizu等[31]将TiO2和(NH4)2TiF6混合并在NH3气氛中煅烧得到了TiOxNyFz。
但是,非金属掺杂也存在一些问题[32]:一是掺杂后的光催化反应机理尚不明确,还需要进行理论研究;二是非金属掺杂后,TiO2的稳定性出现了下降。这都是今后研究需要攻克的问题。
2.3 贵金属沉积
对TiO2进行贵金属沉积是基于一般情况下金属的费米能级比半导体低,当两者接触时,光生电子向金属发生转移,直至两者的费米能级相等。这样,金属表面富集了过量的电子,而半导体则富集过量带正电的空穴,形成了Schottky能垒(图2),从而有效抑制了电子空穴对的复合,提高了光催化反应活性。
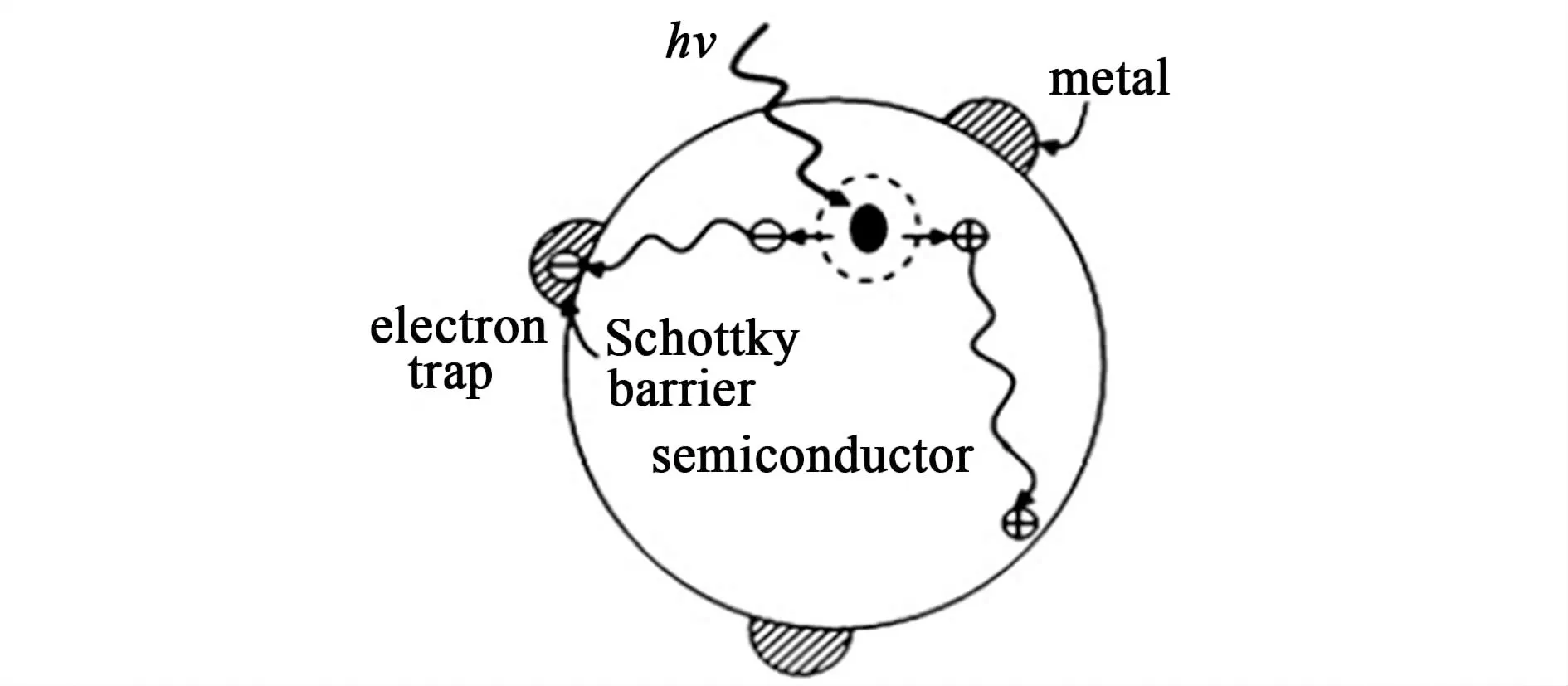
图2 金属在TiO2表面形成Schottky能垒Fig.2 The metal’s Schottky barrier on surface of TiO2
选择沉积的金属种类及沉积量会对光催化效率影响很大。一般来说,沉积的金属量有一个最适宜量,超过这个量会使沉积金属成为新的电子空穴对的复合中心,降低光催化效率。而选用不同的金属进行沉积,催化反应产物和活性也会发生变化,且存在一定的选择性。
2.4 复合半导体
TiO2与半导体进行复合,通过不同半导体能级重合而提高了载流子的迁移率,减小了光生电子空穴对的符合率,从而提高了光催化活性。
由于TiO2禁带宽度较宽,所以需要采用禁带宽度较窄的半导体进行复合。Ⅱ-Ⅵ族二元化合物(如ZnO、Fe2O3、CdS、WO3、CdSe等)禁带宽度范围大(从闪锌矿结构CdSe的1.85 eV到纤锌矿结构ZnS的3.91 eV),所以常用做TiO2复合改性[36-37]。
Serpone[38]对CdS与TiO2复合粒子的研究发现光响应波段向可见光区移动。这是因为虽然光子能量没有达到引起TiO2禁带跃迁,但是却可以通过激发CdS产生光生电子,之后光生电子跃迁至TiO2导带上,而空穴滞留在CdS价带上,从而实现了光生电子空穴对有效分离。Wang等[39]采用CdSe和Pt/TiO2复合用于光催化还原CO2。结果表明,其主要还原产物是CH3OH和CH4,同时产生了微量的CO和H2。
Liu等[40]研究了SiO2/TiO2复合光催化剂的光催化活性。经过SiO2改性,TiO2的光催化还原产物HCOOH和CO产率有了明显的提高。
2.5 敏化
使用劳氏紫、酞菁、玫瑰红、曙红等光敏化材料对TiO2表面进行光敏化处理,就是将上述光敏化材料通过化学吸附或物理吸附固定于TiO2表面,与其形成复合物,实现对TiO2的光敏化。在复合物吸收光子被激发后,只要活性物质的激发态电势比TiO2半导体导带电势更负,就可能将激发产生的电子注入到半导体的导带,扩大了TiO2的激发波长范围,提高光催化活性[41]。
2.6 黑色二氧化钛
2002年时,Diebold指出,高温高压下,氢气和二氧化钛的反应所产生的氧空位会产生特殊的中间吸收能带[42-43]。2011年,Chen Xiaobo将二氧化铁纳米晶在200 ℃,2 000 kPa的H2氛围下处理5 d后,白色的二氧化钛变成了黑色,同时其光催化效果也得到了加强[44]。2011年11月,Danon报道称反应中的容器中含有的Cr引入了二氧化钛才是使得其光催化效果大大增强的重要原因[45],而氢气起到的作用只是使得Cr引入二氧化钛晶格中变得容易了而已。关于黑色TiO2的产生机理,现在仍有一些争议,但都认为是在处理的过程中,晶格结构发生了变化,产生了不同的缺陷从而影响了TiO2的颜色和其催化活性。
3 其他体系光催化剂
南京大学邹志刚课题组采用溶剂热法,合成出数百微米长、厚度仅为7 nm的Zn2GeO4纳米单晶。由于Zn2GeO4所具有的一维结构,有效降低了光生电子空穴对的复合率,提高了光催化效率[46]。Kim等[47]研究了ZrO2还原CO2的催化活性。在不同还原气氛条件下还原产物只有CO,当采用H2气氛时CO产量最大。Zhou等[48]利用Bi2WO6,在可见光照射条件下将CO2催化还原为CH4。多孔Ga2O3在光照条件下可以将CO2还原为CH4[49]。Bi2S3/CdS在可见光照射下可以光催化还原CO2,其中Bi2S3的催化活性相比CdS更好,当两者质量比为15%左右时,其催化活性最高[50]。石墨烯因其良好的导电性,有利于光生载流子的传输,而成为目前光催化剂改性的热点。Wang等[51]研究了Cu2O/还原氧化石墨烯在液相中可见光照射条件下还原CO2为CH3OH。
4 结语
利用光催化材料进行光催化还原CO2为碳氢化合物是解决温室效应以及能源问题的一条有效途径。目前,各国研究人员已经取得了一些进展和突破,但是目前光催化还原CO2依然存在一系列问题:1)光催化剂能量利用率低。对太阳能的转化率低,无法充分利用这一清洁能源。2)量子效率低。光生电子空穴的复合严重影响了光催化效率。3)反应机理不够明确。对于反应过程中的中间产物及动力学问题,虽然已有大量的研究,但是仍未清晰揭示整个光催化还原CO2的过程。4)CO2转化效率偏低。5)还原产物选择性控制差。
以上这些问题是目前光催化领域亟需攻克的难题,同时也指出了光催化未来的发展方向。对光催化剂和反应机理的研究,有助于我们进一步认识整个光催化还原CO2过程。相信通过科研工作者的研究和努力,人工模拟利用太阳能实现光催化CO2转化为有机物这一技术终将获得突破并在未来得到应用。
参考文献:
[1]Fujishima A, Honda K. Electrochemical photolysis of water at a semiconductor electrode [J]. Nature, 1972, 238: 37-38
[2]Halmann M. Photoelectrochemical reduction of aqueous carbon-dioxide on p-type gallium-phosphide in liquid junction solar-cells [J]. Nature, 1978, 275(5 676): 115-116
[3]Inoue T, Fujishima A, Konishi S,etal. Photoelectrocatalytic reduction of carbon-dioxide in aqueous suspensions of semiconductor powders[J]. Nature, 1979, 277(5 698): 637-638
[4]Hoffmann M R, Moss J A, Baum M M. Artificial photosynthesis: Semiconductor photocatalytic fixation of CO2to afford higher organic compounds[J]. Dalton Transactions, 2011, 40(19): 5 151-5 158
[5]Indrakanti V P, Kubicki J D, Schobert H H. Photoinduced activation of CO2on Ti-based heterogeneous catalysts: Current state, chemical physics-based insights and outlook [J]. Energy & Environmental Science, 2009, 2(7): 745-758
[6]Palmisano G, Garcia-Lopez E, Marci G,etal. Advances in selective conversions by heterogeneous photocatalysis[J]. Chemical Communications, 2010, 46(38): 7 074-7 089
[7]Roy S C, Varghese O K, Paulose M,etal. Toward solar fuels: Photocatalytic conversion of carbon dioxide to hydrocarbons[J]. Acs Nano, 2010, 4(3): 1 259-1 278
[8]蓝奔月, 史海峰. 光催化CO2转化为碳氢燃料体系的综述 [J]. 物理化学学报, 2014, (12): 2 177-2 196
Lan Benyue, Shi Haifeng. Review of systems for photocatalytic conversion of CO2to hydrocarbon fuels[J]. Acta Physico-Chimica Sinica, 2014, (12): 2 177-2 196(in Chinese)
[9]Kumar B, Llorente M, Froehlich J,etal. Photochemical and photoelectrochemical reduction of CO2[J]. Annual Review of Physical Chemistry, 2012, 63: 541-569
[10]Koci K, Obalova L, Matejova L,etal. Effect of TiO2particle size on the photocatalytic reduction of CO2[J]. Appl Catal B-Environ, 2009, 89(3/4): 494-502
[11]Li Y, Wang W, Zhan Z,etal. Photocatalytic reduction of CO2with H2O on mesoporous silica supported Cu/TiO2catalysts [J]. Appl Catal B-Environ, 2010, 100(1/2): 386-392
[12]Linsebigler A L, Lu G, Yates J T. Photocatalysis on TiO2surfaces-principles, mechanisms, and selected results [J]. Chem Rev, 1995, 95(3): 735-758
[13]Yamashita H, Kamada N, He H,etal. Reduction of CO2with H2O on TiO2(100) and TiO2(110) single-crystals under uv-irradiation [J]. Chemistry Letters, 1994, (5): 855-858
[14]朱思慧, 樊国栋, 李桂庆. 中国与世界新能源利用概况 [J]. 能源与节能, 2011, (4): 19-20
Zhu Sihui, Fan Guodong, Li Guiqing. Overview of new energy in China and world[J]. Energy and Energy Conservation, 2011, (4): 19-20(in Chinese)
[15]Nowak D J, Crane D E. Carbon storage and sequestration by urban trees in the USA [J]. Environ Pollut, 2002, 116(3): 381-389
[16]李天成, 冯霞, 李鑫钢. 二氧化碳处理技术现状及其发展趋势 [J]. 化学工业与工程, 2002, 19(2): 191-196, 215
Li Tiancheng, Fen Xia, Li Xingang.The current status and the developing trends of carbon dioxide treating technologies[J]. Chemcial Industry and Engineering, 2002,19(2): 191-196, 215 (in Chinese)
[17]Chen L, Graham M E, Li G,etal. Photoreduction of CO2by TiO2nanocomposites synthesized through reactive direct current magnetron sputter deposition [J]. Thin Solid Films, 2009, 517(19): 5 641-5 645
[18]Anpo M, Yamashita H, Ichihashi Y,etal. Photocatalytic reduction of CO2with H2O on various titanium-oxide catalysts [J]. Journal of Electroanalytical Chemistry, 1995, 396(1/2): 21-26
[19]Anpo M, Yamashita H, Ichihashi Y,etal. Photocatalytic reduction of CO2with H2O on titanium oxides anchored within micropores of zeolites: Effects of the structure of the active sites and the addition of Pt [J]. J Phys Chem B, 1997, 101(14): 2 632-2 636
[20]Ikeue K, Nozaki S, Ogawa M,etal. Photocatalytic reduction of CO2with H2O on Ti-containing porous silica thin film photocatalysts [J]. Catal Lett, 2002, 80(3/4): 111-114
[21]Ikeue K, Yamashita H, Anpo M,etal. Photocatalytic reduction of CO2with H2O on Ti-beta zeolite photocatalysts: Effect of the hydrophobic and hydrophilic properties [J]. J Phys Chem B, 2001, 105(35): 8 350-8 355
[22]Yamashita H, Ikeue K, Takewaki T,etal. In situ XAFS studies on the effects of the hydrophobic-hydrophilic properties of Ti-beta zeolites in the photocatalytic reduction of CO2with H2O [J]. Top Catal, 2002, 18(1/2): 95-100
[23]Sato S. Photocatalytic activity of NOx-doped TiO2in the visible-light region [J]. Chemical Physics Letters, 1986, 123(1/2): 126-128
[24]Asahi R, Morikawa T, Ohwaki T,etal. Visible-Light photocatalysis in nitrogen-doped titanium oxides [J]. Science, 2001, 293(5 528): 269-271
[25]Irie H, Watanabe Y, Hashimoto K. Nitrogen-Concentration dependence on photocatalytic activity of TiO2-xNx powders [J]. J Phys Chem B, 2003, 107(23): 5 483-5 486
[26]Miyauchi M, Ikezawa A, Tobimatsu H,etal. Zeta potential and photocatalytic activity of nitrogen doped TiO2thin films [J]. Physical Chemistry Chemical Physics, 2004, 6(4): 865-870
[27]Sakthivel S, Kisch H. Photocatalytic and photoelectrochemical properties of nitrogen-doped titanium dioxide [J]. Chemphyschem, 2003, 4(5): 487-490
[28]熊卓, 赵永椿, 张军营, 等. Ti基CO2光催化还原及其影响因素研究进展[J]. 化工进展, 2013, (5): 1 043-1 052, 1 162
Xiong Zhuo, Zhao Yongchun, Zhang Junying,etal. Research progress in photocatalytic reduction of CO2using titania-based catalysts[J]. Chemical Industry and Engineering Progress, 2013, 32(5): 1 043-1 052, 1 162(in Chinese)
[29]Umebayashi T, Yamaki T, Itoh H,etal. Band gap narrowing of titanium dioxide by sulfur doping [J]. Applied Physics Letters, 2002, 81(3): 454-456
[30]Ohno T, Mitsui T, Matsumura M. Photocatalytic activity of S-doped TiO2photocatalyst under visible light [J]. Chemistry Letters, 2003, 32(4): 364-365
[31]Nukumizu K, Nunoshige J, Takata T,etal. Tinxoyfz as a stable photocatalyst for water oxidation in visible light (<570 nm) [J]. Chemistry Letters, 2003, 32(2): 196-197
[32]Tseng I H, Wu J C S. Chemical states of metal-loaded titania in the photoreduction of CO2[J]. Catalysis Today, 2004, 97(2/3): 113-119
[33]Yamashita H, Nishiguchi H, Kamada N,etal. Photocatalytic reduction of CO2with H2O on TiO2and Cu/TiO2catalysts [J]. Res Chem Intermed, 1994, 20(8): 815-823
[34]Ishitani O, Inoue C, Suzuki Y,etal. Photocatalytic reduction of carbon-dioxide to methane and acetic-acid by an aqueous suspension of metal-deposited TiO2[J]. Journal of Photochemistry and Photobiology a-Chemistry, 1993, 72(3): 269-271
[35]Koci K, Mateju K, Obalova L,etal. Effect of silver doping on the TiO2for photocatalytic reduction of CO2[J]. Appl Catal B-Environ, 2010, 96(3/4): 239-244
[36]Sooklal K, Hanus L H, Ploehn H J,etal. A blue-emitting cds/dendrimer nanocomposite[J]. Advanced Materials, 1998, 10(14): 1 083-1 087
[37]Johne P, Kisch H. Photoreduction of carbon dioxide catalysed by free and supported zinc and cadmium sulphide powders[J]. Journal of Photochemistry and Photobiology A-Chemistry, 1997, 111(1/3): 223-228
[38]Serpone N, Maruthamuthu P, Pichat P,etal. Exploiting the interparticle electron transfer process in the photocatalysed oxidation of phenol,2-chlorophenol and pentachiorophenol: Chemical evidence for electron and hole transfer between coupled semiconductors[J]. J Photochem Photobiol A:1995,(85):247-255
[39]Wang C, Thompson R L, Baltrus J,etal. Visible light photoreduction of CO2using CdSe/Pt/ TiO2heterostructured catalysts [J]. Journal of Physical Chemistry Letters, 2010, 1(1): 48-53
[40]Liu B, Torimoto T, Yoneyama H. Photocatalytic reduction of carbon dioxide in the presence of nitrate using TiO2nanocrystal photocatalyst embedded in SiO2matrices [J]. Journal of Photochemistry and Photobiology A-Chemistry, 1998, 115(3): 227-230
[41]王会香, 姜东, 吴东, 等. TiO2光催化还原CO2[J]. 化学进展, 2012, (11): 2 116-2 123
Wang Huixiang, Jiang Dong, Wu Dong,etal. Photocatalytic reduction of CO2on TiO2catalysts[J]. Progress in Chemistry, 2012, (11): 2 116-2 123(in Chinese)
[42]Diebold U. The surface science of titanium dioxide [J]. Surface Science Reports, 2003, 48(5/8): 53-229
[43]Gopel W, Rocker G, Feierabend R. Intrinsic defects of TiO2(110)-interaction with chemisorbed O2, H2, CO, and CO2[J]. Physical Review B, 1983, 28(6): 3 427-3 438
[44]Chen X, Liu L, Yu P,etal. Increasing solar absorption for photocatalysis with black hydrogenated titanium dioxide nanocrystals [J]. Science, 2011, 331(6 018): 746-750
[45]Danon A, Bhattacharyya K, Vijayan B K,etal. Effect of reactor materials on the properties of titanium oxide nanotubes [J]. Acs Catalysis, 2012, 2(1): 45-49
[46]Liu Q, Zhou Y, Kou J,etal. High-Yield synthesis of ultralong and ultrathin Zn2GeO4nanoribbons toward improved photocatalytic reduction of CO2into renewable hydrocarbon fuel [J]. Journal of the American Chemical Society, 2010, 132(41): 14 385-14 387
[47]Kim J J, Summers D P, Frese K W. Reduction of CO2and CO to methane on Cu foil electrodes [J]. Journal of Electroanalytical Chemistry, 1988, 245(1/2): 223-244
[48]Zhou Y, Tian Z, Zhao Z,etal. High-Yield synthesis of ultrathin and uniform Bi2WO6square nanoplates benefitting from photocatalytic reduction of CO2into renewable hydrocarbon fuel under visible light [J]. ACS Applied Materials & Interfaces, 2011, 3(9): 3 594-3 601
[49]Park H A, Choi J H, Choi K M,etal. Highly porous gallium oxide with a high CO2affinity for the photocatalytic conversion of carbon dioxide into methane [J]. Journal of Materials Chemistry, 2012, 22(12): 5 304-5 307
[50]Li X, Chen J, Li H,etal. Photoreduction of CO2to methanol over Bi2S3/CdS photocatalyst under visible light irradiation [J]. Journal of Natural Gas Chemistry, 2011, 20(4): 413-417
[51]Wang A, Li X, Zhao Y,etal. Preparation and characterizations of Cu2O/reduced graphene oxide nanocomposites with high photo-catalytic performances [J]. Powder Technology, 2014, 261: 42-48

