截断逆挽方对慢加急性肝衰竭大鼠肝细胞超微结构、周期蛋白Cyclin E及转录因子DP1的影响
党泽方 李金霞 张秋云 崔利娟 穆凌云 高连印 杜宇琼
作者单位: 100069北京市,首都医科大学中医药学院首都医科大学络病重点实验室
截断逆挽方对慢加急性肝衰竭大鼠肝细胞超微结构、周期蛋白Cyclin E及转录因子DP1的影响
党泽方李金霞张秋云崔利娟穆凌云高连印杜宇琼
作者单位: 100069北京市,首都医科大学中医药学院首都医科大学络病重点实验室
【摘要】目的观察截断逆挽方对慢加急性肝衰竭(ACLF)模型大鼠肝细胞超微结构,周期蛋白Cyclin E及转录因子DP-1表达的影响,并考察模型24 h病死率和生存时间,从提高疗效、降低死亡、改善肝细胞超微结构损伤和调控肝细胞代偿性增殖的角度,分析该方干预ACLF的部分疗效和作用机制。方法Wistar大鼠61只,随机分为正常组、模型组及截断逆挽方组。采用猪血清免疫诱导大鼠肝纤维化或肝硬化模型,再给予D-GalN/LPS一次性联合腹腔注射进行急性攻击,建立慢加急性肝衰竭大鼠模型。截断逆挽方组在急性攻击后给予水煎液灌胃连续3 d,模型组和截断逆挽方组大鼠分别在4、8、12 h处死,取肝组织,进行电镜超微结构观察,Elisa法测定Cyclin E及其转录因子DP1的表达,运用IPP 6.0软件进行图像分析,自动计算出阳性物质的IOD值。结果截断逆挽方可以延长模型的存活时间,与模型组比较,差异有统计学意义(P<0.05),在一定程度上减轻ACLF大鼠肝细胞超微结构的损伤;截断逆挽方组Cyclin E、DP1 IOD值在8 h时比4 h低,12 h比8 h有增加(P<0.01),而模型组Cyclin E、DP1 IOD则呈持续下降(P<0.05)。结论截断逆挽方可以延长模型大鼠的存活时间,并能改善肝细胞超微结构,对肝细胞代偿性增殖有一定的调控作用。
【关键词】截断逆挽方;肝衰竭,慢加急性;超微结构,Cyclin E; DP-1
项目来源:北京市自然科学基金资助项目(编号: 7112017)
E-mail: zhangqiuyun8202@ yahoo.com.cn
慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)是指在原有肝炎和肝硬化的基础上发生急剧而广泛的肝细胞坏死,主要表现为大块或亚大块坏死,出现以肝功能严重损害为主要特征的一种临床综合征。该病病情进展迅速、病死率高。截断逆挽方是全国名老中医钱英教授治疗慢性乙型肝重型肝炎的经验方,临床研究已证实其有明确的疗效[1]。前期实验研究结果也显示该方对ACLF模型大鼠肝功能、肝组织有保护作用,并能减少肝细胞的凋亡和坏死,降低模型大鼠的死亡率[2-5]。肝细胞异常凋亡减轻的同时,由凋亡引导的代偿性增殖增强是改善肝脏坏死、挽救死亡的重要机制[6-8]。在前期工作基础上,本研究考察该方对肝细胞超微结构、肝细胞周期蛋白E(Cyclin E)及转录因子蛋白1(DP1)的影响,并考察模型24 h死亡率和生存时间,从改善病理变化和调节肝细胞代偿性增殖的角度,进一步阐明截断逆挽方干预ACLF的机制。
1 材料与方法
1.1实验动物Wistar大鼠61只,SPF级,雄性,体重120~150 g,购自中国人民解放军军事医学科学院实验动物中心,动物合格证号: SCXK-(军) 2007-004。饲养于首都医科大学实验动物科学部屏障设施动物实验房,实验室合格证号: SYXK(京) 2005-0022。IVC大鼠自动换气饲养系统,分笼饲养,每笼3只,自由进食饮水。温度(23.0±1.0)℃,相对湿度(45.0±1.0) %,每隔12 h开灯照明。动物垫料和喂养饲料由动物房提供,经高温消毒后传递到实验室,动物饮用水由动物房水处理系统处理成酸化水后给动物饮用。
1.2药品截断逆挽方:由苦味叶下珠30 g、瓜蒌30 g、金钱草30 g、生黄芪30 g、槲寄生30 g、三七6 g、莪术6 g、丹参20 g、生地20 g、黑附片15 g(先煎)组成。所有药材均购自北京同仁堂中医医院中药房,经过生药鉴定确认后由首都医科大学中医药学院实验中心煎制,含生药量为4.34 g/ml,4℃冰箱冷藏保存备用,使用时微温。
1.3试剂猪血清:北京元亨圣马生物技术研究所,批号: 120308; D-氨基半乳糖(D-galactosamine,DGalN) : 5 g,sigma公司,批号: 070M1194V;脂多糖(lippolysaccharide,LPS ) : 10 mg,sigma公司,批号: 032M4082V;羊血清原液(中杉金桥,批号: 130908)、兔超敏二步法试剂盒(中杉金桥,PV-9001,批号: K143303A)、DAB试剂盒(中杉金桥,ZLI-9018,批号: K146720D) Anti-DP1(santa cruz,sc610,批号: L2309)、Anti-CyclinE(santa cruz,sc-481,批号: E1413)。
1.4方法
1.4.1大鼠ACLF模型建立:①免疫诱导阶段:大鼠适应性喂养1周后,按体重将动物随机分为正常组6只和处理组55只。处理组腹腔注射猪血清,0.5 ml/只,每周2次,共注射13周,整个造模过程中死亡2只,死亡率0.04%。造模结束后,随机抽取3只处理组大鼠处死,取肝右叶经10%甲醛固定后,切片,行苏木素-伊红(HE)染色,光镜下病理观察,均达到肝纤维化/肝硬化标准(肝纤维化程度S3~S4期病理组织学改变[3])。正常组腹腔注射同等体积的0 9%氯化钠溶液。②急性攻击阶段:将处理组存活的50只大鼠,根据体重随机分为模型组25只和截断逆挽方组25只。模型组和截断逆挽方组参照吴其恺等[6]造模方法给予D-GaLN 800 mg/kg和LP 100 μg/kg联合腹腔注射进行急性攻击,一次性造成ACLF模型。
1.4.2给药及分组:截断逆挽方组在急性攻击前取等效剂量水煎剂连续灌胃3 d,每天2次,每次1.75 ml/只(含生药量总计为4.34 g/ml),正常组及模型组给予相同体积的0.9%氯化钠溶液。模型组和截断逆挽方组在急性攻击后,再根据体重随机分为模型4 h组、模型8 h组、模型12 h组、模型24 h组,截断逆挽方4 h组、截断逆挽方8 h组、截断逆挽方12 h组截断逆挽方24 h组。模型24 h组和截断逆挽方24组用于生存时间和死亡率的观察。其中模型4、8、12组及截断逆挽方4、8、12 h组每组均为6只。模型24组和截断逆挽方24 h组每组7只。
1.4.3取材:急性攻击后4、8、12 h点处各组平行取材。各组大鼠均取肝右相同部位的叶组织放入10%甲醛溶液固定24 h,进行包埋、切片。
1.4.4观察指标与方法
1.4.4.124 h病死率及生存时间的观察:记录模型组、截断逆挽方24 h组大鼠在急性攻击后到24 h内的死亡的时间,进行统计分析,24 h后仍存活的生存时间记为24 h,并统计2组大鼠24 h内死亡数量,计算死亡率,进行比较分析。
1.4.4.2肝组织超微结构的观察:置于2.5%戊二醛磷酸缓冲液中的肝组织放入4℃冰箱固定2 h以上之后,经0.1 mol/L冷磷酸缓冲液冲洗3次,每次10 min后将标本置入1%锇酸继续固定2 h。梯度丙酮脱水(70%、95%、100%各30 min,室温),丙烯氧化物室温浸透2次,各30 min,丙烯氧化物与Epon2812树脂混合物浸透过夜,Epon2812树脂包埋,32℃聚合24 h 45℃聚合12 h,60℃聚合24 h。半薄切片经甲苯胺蓝染色后在光镜下定位。玻璃刀70 nm超薄切片,醋酸铀及柠檬酸铅双重染色后,在JEM-1230型透射电镜下观察及拍照。
1.4.4.3Cyclin E及DP1的表达:免疫组化SP法检测肝组织中Cyclin E及DP1的表达,具体步骤按照说明书操作。先分别于400X高倍镜下随机选取8个视野进行观察并照相,其中棕色部分为阳性物质,然后运用IPP6.0软件进行图像分析,选择切片空白区校正并调整光源和灰度,对阳性物质进行标记,由计算机系统自动计算出阳性物质的IOD值,量化描述每个视野中Cyclin E、DP1的表达程度,取8个视野IOD值的平均值进行对比分析。
1.5统计学分析应用SPSS 12.0统计软件,计量资料以±s表示,采用两独立样本t检验,计数资料比较采用独立样本2×2列联表资料的χ2检验,P<0.05为差异有统计学意义。
2 结果
2.12组大鼠24 h死亡率和生存时间比较急性攻击后24 h内多数造模大鼠死于肝衰竭,符合ACLF死亡率高的特点。模型24 h组7只死亡6只,死亡率为85.7%;截断逆挽方24 h组7只死亡5只,死亡率为74.1%,模型组低于截断逆挽方组,但差异无统计学意义(P>0.05)。截断逆挽方组存活时间明显长于模型组(P<0.05)。见表1。
表1 2组大鼠死亡率和生存时间比较n=7,h,±s

表1 2组大鼠死亡率和生存时间比较n=7,h,±s
注:与模型组比较,*P<0.05
组别生存时间模型组15.07±4.06截断逆挽方组 20.30±3.79*
2.2对超微结构的影响
2.2.1正常组肝细胞结构正常,细胞核圆形,位于细胞的中央,糖元丰富,粗面内质网发达,表面分布较多核糖体,肝细胞质内偶见脂滴;线粒体丰富,单位膜结构清晰,嵴稀疏短小;肝窦内皮细胞扁平,有较多窗孔;肝窦内可见到Kupffer细胞,表面有较多的突起,细胞质内可见溶酶体。见图1。
2.2.2模型4 h组肝细胞结构尚正常,细胞核形态不规则,核膜部分凹陷,糖元及粗面内质网较正常组减少,体表核糖体少量脱颗粒。细胞质内脂滴较多;线粒体单位膜仍较清晰,嵴断裂,但仍有部分保留;肝窦内皮细胞窗孔消失,并见基底膜形成; Kupffer细胞内溶酶体丰富,吞噬物较多,细胞体积增大。见图1。
2.2.3截断逆挽方组4 h组肝细胞结构正常,细胞核圆形,位于细胞的中央,未见核膜凹陷,糖元较正常组明显减少,然粗面内质网仍较丰富,体表核糖体部分脱颗粒,细胞质内可见脂滴形成,然较模型4 h组少;线粒体单位膜仍较清晰,少量嵴断裂,大部分仍保留;肝窦内皮细胞窗孔消失,并见基底膜形成; Kupffer细胞内溶酶体丰富,细胞体积较大。见图1。
2.2.4模型8 h组肝细胞结构破坏,胞膜破裂,胞核皱缩,呈虫噬状,内部染色质凝集固缩,糖元与粗面内质网均明显减少,体表核糖体脱颗粒明显,有体积较大的脂肪滴散在分布,细胞质内可见炎性细胞及部分红细胞浸润;线粒体数量较前减少,部分形态发生变化,嵴断裂,多数消失;细胞间连接结构破坏,可见结构不清的坏死灶; Kupffer细胞内溶酶体丰富,因吞噬凋亡小体或坏死物质胞体增大,可见到次级溶酶体。见图1。
2.2.5截断逆挽方组8 h组部分肝细胞膜破裂,胞核因遭挤压移到胞质周边部,核膜较4 h时皱缩,内部染色质凝集固缩,糖元与粗面内质网均明显减少,体表核糖体脱颗粒明显,但较模型8 h组少,脂滴形成较少线粒体数量较前减少,嵴断裂,多数消失,但较模型8组破坏程度轻;出现细胞间连接结构破坏,并可见结构不清的坏死灶; Kupffer细胞内溶酶体丰富,因吞噬凋亡小体或坏死物质胞体增大,可见到次级溶酶体。见图1。
2.2.6模型12 h组肝细胞膜破裂并消失,细胞核崩解,糖元消失,仅有少量粗面内质网保留,体表核糖体脱颗粒严重,脂滴大量形成。坏死灶满视野,内部可见大量炎性细胞及红细胞浸润;线粒体数目明显减少,固缩,嵴断裂,消失; Kupffer细胞吞噬大量坏死物质胞体较前增大,次级溶酶体较多。见图1。
2.2.7截断逆挽方组12 h组肝细胞膜破裂并消失细胞核皱缩,内部染色质凝集固缩,未出现崩解现象糖元消失,仅有少量粗面内质网保留,体表核糖体脱颗粒明显,脂滴大量形成,坏死灶满视野,内部可见炎性细胞及红细胞浸润,但较模型12 h组少;线粒体数目明显减少,少见固缩,多数嵴断裂,消失,Kupffer细胞吞噬大量坏死物质胞体增大,次级溶酶体较多。见图1。

图1 2组大鼠肝脏超微结构变化(肝细胞×3 000,线粒体×30 000)
以上结果提示,截断逆挽方组4 h、8 h、12 h组较相应时间点的模型组肝细胞核、糖元和粗面内质网及线粒体等破坏程度有一定的改善,说明该方对ACLF大鼠肝脏超微结构的损伤有一定的保护作用。
2.3对大鼠肝组织Cyclin E表达的影响
2.3.1正常组大鼠肝组织Cyclin E有少量表达,模型组4 h、8 h、12 h的表达均强于正常组;截断逆挽方组的表达较正常组明显增强,但与对应时间点的模型组比较减轻。见图2。

图2 3组大鼠肝组织Cyclin E表达情况(SP法×400)
2.3.23组不同时点的肝组织Cyclin E表达IOD值在4 h、8 h、12 h时点模型组明显高于正常组,截断逆挽方组虽高于正常组但低于模型组(P<0.05或<0.01)。截断逆挽方组Cyclin E的表达在4 h时降低,8 h时明显降低,而12 h时有所回升。见表2。
表2 3组大鼠肝组织Cyclin E IOD值比较 ×107,±s

表2 3组大鼠肝组织Cyclin E IOD值比较 ×107,±s
注:与正常组比较,*P<0.05,#P<0.01;与模型组比较,△P<0.01;与4 h比较,☆P<0.01;与8 h组比较,▲P<0.01
组别4 h 8 h 12 h正常组(n=5)1.06±1.45 1.06±1.45 1.06±1.45模型组(n=5) 3.20±2.00# 2.48±1.65# 1.14±0.99▲截断逆挽方组(n=4) 1.80±1.54*△ 0.80±0.59△☆ 0.99±0.65☆▲
2.4对大鼠肝组织DP1表达的影响
2.4.1正常组大鼠肝组织DP1有少量表达,模型组4 h、8 h、12 h表达量均显著高于正常组;截断逆挽方组DP1表达量均高于正常组,但与对应时间点的模型组比较明显减弱。见图3。
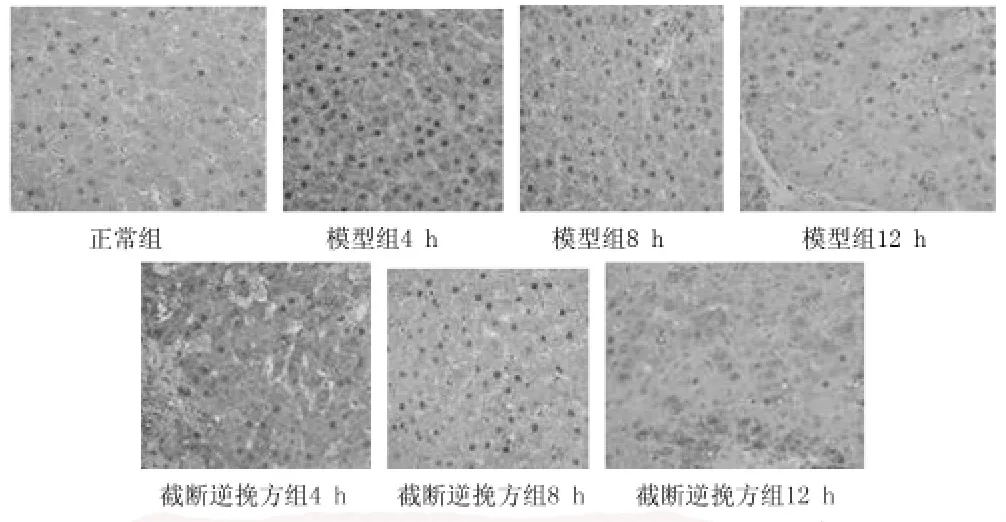
图3 3组大鼠肝组织DP1表达情况(SP×400)
2.4.23组不同时点的肝组织DP1表达IOD值,在4 h、8 h、12 h时点模型组明显高于正常组,截断逆挽方组虽高于正常组但低于模型组(P<0.05)。截断逆挽方组DP1的表达在4 h时降低,8 h时明显降低而12 h时有所回升。见表3。
表3 3组大鼠肝组织DP1 IOD值比较 ×107±s

表3 3组大鼠肝组织DP1 IOD值比较 ×107±s
注:与正常组比较,*P<0.01;与模型组比较,#P<0.01;与4 h比较,△P<0.01;与8比较,☆P<0.01
组别4 h 8 h 12 h正常组(n=5)1.78±2.54 1.78±2.54 1.78±2.54模型组(n=5) 3.85±2.00* 3.53±1.88* 2.52±1.29△截断逆挽方组(n=4) 2.71±0.87# 1.64±0.71#△ 2.06±0.72△☆
3 讨论
死亡率和存活时间观察结果提示:模型组24 h死亡率为85.7%;截断逆挽方组24 h死亡74.1%,两者比较差异无统计学意义(P<0.05),但后者与前者相比有降低的趋势; 2组大鼠的存活时间比较,截断逆挽方组明显长于模型组(P<0.05)。可见本方对延长模型大鼠的存活时间有效。考察肝细胞超微结构的病理变化,发现截断逆挽方组4 h、8 h、12 h组较相应时间点的模型组肝细胞核、糖元和粗面内质网及线粒体等破坏程度有一定的改善,说明该方对ACLF大鼠肝脏超微结构的损伤有一定的保护作用,与前期对肝损伤保护作用研究的结果[2,5]一致。
研究发现,ACLF的发生除肝细胞坏死外,肝细胞的异常凋亡在急性肝衰竭过程中起着重要作用[6,7]而在凋亡的作用下又可以诱导细胞的增殖,这种现象被称为凋亡诱导的代偿性增殖[8]。正常情况下,肝细胞为暂不增殖细胞群,即G0期细胞,在大量肝细胞凋亡的刺激作用下,肝细胞可迅速重新进入细胞周期,进行增殖再生。转录起始因子DP1以及细胞周期蛋白CyclinE都是肝细胞再生的关键蛋白,DP-1可以正反馈调节某些基因的转录,产生细胞进入S期所必需的蛋白产物,如Cyclin A、Cyclin E,其中CyclinE是肝细胞进入细胞周期(G1期)的显著性标志[9]。在本实验中,模型组4 h组大鼠的肝组织中DP-1和Cyclin E的表达量均显著高于正常对照组,推测这是由于ACL大鼠大量肝细胞凋亡激活了代偿性增殖调控相关的通路,从而上调了DP-1和Cyclin E的表达,到了8 h和12 h,随着时间的推移,既往的研究结果显示模型组大鼠肝细胞凋亡逐渐增多[3],而本研究结果则显示,细胞增殖的关键蛋白DP-1和Cyclin E表达则逐渐减少可见细胞增殖不足以代偿细胞过度凋亡,则会引起肝细胞大量坏死,使实验动物最终走向死亡。与模型组比较,截断逆挽方4 h、8 h组DP-1和Cyclin E的表达量低于相对较低,说明其所激活的代偿性增殖相对模型组少,这与课题组前期研究结果一致,因为凋亡程度较轻,所激活的代偿性增殖则相对较少[3];到达12时,截断逆挽方组DP-1和Cyclin E表达与模型组无明显差异,且与正常组比较差异也无统计学意义(P>0.05),然前期研究结果则显示这个时间点凋亡明显增加,可见,这时无论模型组和截断逆挽方组代偿性增殖均不能补偿异常凋亡,截断逆挽方组这个变化考虑与血药浓度下降有关。进一步进行模型组和截断逆挽方组的亚组分析发现,模型组4 h、8 h、12 h时间点Cyclin E、DP1 IOD值呈持续下降趋势,且12 h最低,与4 h、8 h组比较均有统计学意义(P<0.01),而截断逆挽方组的变化趋势则有所不同,Cyclin E、DP1 IOD 值8 h比4 h低,12 h的Cyclin E、DP1 iod值比8 h有所增加(P<0.01)。可见,截断逆挽方干预后,不仅可以减轻模型大鼠的异常凋亡,在12 h时间点肝细胞代偿性增殖相对8 h有回升的趋势,这个结果提示,如果后续继续给药治疗,有可能出现异常凋亡继续减轻,代偿性增殖逐渐增强,改善动物最终走向死亡的不良结局,然其调控代偿性增殖的具体途径及继续给药治疗后的结果尚不确定,值得进一步研究。
课题组前期建立慢性重型肝炎“毒损肝体”的病因病机理论,认为毒瘀与正虚交织是乙型慢性重型肝炎的病机特点[10],截断逆挽方正是针对这个病机特点,同时采用解毒化瘀、扶助正气的法则,运用苦味叶下珠、瓜蒌、金钱草、生黄芪、槲寄生、三七、莪术、丹参、生地、黑附片等药,达到截断病势,扶正祛邪之目的。肠源性内毒素血症对肝脏的“二次打击”是ACLF发病的关键因素之一,内毒素既可以直接损伤肝脏,又可以通过激活Kuffer细胞释放细胞因子、炎性介质(如TNF-α、IL-1、IL-6)等引起肝脏炎症及肝脏微循环障碍,从而造成肝损伤。现代药理发现,生黄芪、黄芪总提取物、黄芪多糖等具有抑制内毒素对肝细胞的直接或间接的损伤[11-13];生地则可以增加细胞免疫功能,有促进网状内皮系统吞噬功能、增加外周血T淋巴细胞的作用,其有效成分水苏糖可以加速肠道内有毒物质排出,减清肠源性内毒素对肝脏的“二次打击”[14];三七则可以增强免疫能力、改善肝脏微循环、减少线粒体内质网等细胞器的损伤[15]。这些药理研究成果也可以作为截断逆挽方减轻ACLF模型大鼠肝细胞超微结构病理变化的佐证。
综上所述,截断逆挽方可以延长模型大鼠的存活时间,并能改善肝细胞超微结构,对肝细胞代偿性增殖有一定的调控作用。
参考文献
1胡建华,钱英,姚乃礼,等.“截断逆挽法”治疗慢性乙型重型肝炎临床疗效观察.中西医结合肝病杂志,2010,20: 200-203.
2崔利娟,党泽方,张秋云,等.截断逆挽方对慢加急性肝衰竭大鼠血清ET、肝组织TNF-а含量及肝组织TNFR1表达的影响.北京中医药,2013,32: 134-138.
3吴文秀,崔利娟,陈煜,等.截断逆挽方对慢加急性肝衰竭大鼠肝细胞凋亡指数及caspase8/3表达的影响.北京中医药,2012,31: 62 64.
4吴文秀,张秋云,崔利娟,等.截断逆挽方降低慢加急性肝衰竭大鼠死亡率的机制探讨.中国医药学导刊,2012,18: 6-8,11.
5崔利娟,党泽方,张秋云,等.截断逆挽方对慢加急性肝衰竭大鼠血清TNF-а、IL-1β及IL-6的影响.中医药导报,2013,19: 8-11.
6吴其恺,杨大国,乐晓华,等.赤芍承气汤对急性肝衰竭大鼠肝细胞凋亡的影响J.中西医结合肝病杂志,2001,11: 24-26.
7Galle PR,Hofmann WJ,Walkza KH,et al.Involvement of CD95(APO-1 Fas) receptor and ligand in liver damage.J Exp Med,1995,182: 1223 1230.
8藏国庆,周霞秋,俞红,等.肿瘤坏死因子-α诱导肝细胞凋亡在暴发性肝衰竭中的作用.中华消化杂志,2000,20: 163-166.
9Nakano K,Chijiiwa K,Tanaka M.Lower activity of CCAAT/Enhance binding protein and expression of cyclin E,but not cyclinD1,activatin protein-1 and p21WAF1,after partial hepatectomy in obstructive jaun dice.Biochem Biophys Res Commun,2001,280: 640-645.
10张秋云,刘绍能,李秀惠,等.慢性病毒性乙型重型肝炎“毒损肝体病因病机及治疗思路探讨.辽宁中医杂志,2005,32: 19-21.
11李晓东,徐建良,姜楠,等.内毒素对大鼠肝细胞线粒体膜电位的影响及黄芪注射液的干预作用.中西医结合肝病杂志,2005,15: 357 58,361
12杨雁,陈敏珠.黄芪总提取物对体外肝细胞损伤的保护作用.中国临床药理学与治疗学,2000,5: 294-297.
13袁媛,孙梅.黄芪多糖对LPS损伤小肠上皮细胞的保护作用.世界华人消化杂志,2008,16: 15-19.
14王朴.生地黄的现代药理研究与临床应用.中国中医药现代远程教育,2008,6: 986.
15冯陆冰,潘西芬,孙泽玲.三七的药理作用研究进展.中国药师2008,11: 1185-1187.
Effects of truncation and inversion prescription on the ultrastructure,Cyclin E and its transcription factor DP-1 in rats with ACLF
DANG Zefang,LI Jinxia,ZHANG Qiuyun et al.
TCM College,Capital Medical University,Beijing 100069, China
【Abstract】Objective To observe the effects of truncation and inversion prescription on the ultrastructure,Cyclin E and its transcription factor DP-1 in liver cells of model rats with acute-on-chronic liver failure (ACLF),to explore 24-hour mortality and survival time of rat models and to analyze the therapeutic effects and action mechanism of the prescription on ACLF.Methods Sixty-one Wistar rats were randomly divided into three groups: normal control group,model group and Chinese traditional medicine group (TCM group).The rat models with hepatic fibrosis or hepatic cirrhosis were established by immune induction of pig serum,then D-GalN/LPS one-time combination intraperitoneal injection was performed to establish the rat models with acute hepatic failure.After the animal models were established,the rats were treated by truncation and inversion prescription decoction through gavage for 3 days,then the rats in model group and TCM group were sacrificed respectively at 4h,8h,12h,and the ultrastructure changes of liver tissues were observed by electron microscopy,and the expression levels of Cyclin E and its transcription factors DP-1 were detected by ELISA.The images were analyzed by IPP6.0 software,and IOD value in positive substance was automatically calculated.ResultsThe survival time in TCM group was significantly longer than that in model group (P<0.05),furthermore,the ultrastructural injury of liver cells in TCM group was relieved at some extent; the IOD vlue and levels of Cyclin E,DP-1 in TCM group at 8h were obviously lower than those at 4h,however,which in 12h were significantly increased,as compared with those at 8h (P<0.01),but IOD value and levels of Cyclin E,DP-1 in model group were decreased continually.Conclusion Truncation and inversion prescription can prolong survival time of model rats,and can improve the ultrastructure of liver cells,which has regulative effects on compensatory proliferation of liver cells at some extent.
【Key words】truncation and inversion prescription; acute-on-chronic liver failure; ultrastructure; Cyclin E; DP-1
(收稿日期:2014-12-20
通讯作者:张秋云,100069北京市,首都医科大学中医药学院首都医科大学络病重点实验室;
doi:10.3969/j.issn.1002-7386.2015.09.01
【文章编号】1002-7386(2015) 09-1285-05
【文献标识码】A
【中图分类号】R 575

