超微粉碎对灵芝中多糖、三萜的影响
吴长辉
(福州大学化学学院,福建 福州 350116;福建仙芝楼生物科技有限公司,350002)
超微粉碎对灵芝中多糖、三萜的影响
吴长辉
(福州大学化学学院,福建 福州 350116;福建仙芝楼生物科技有限公司,350002)
目的:考察将灵芝粉碎成300目的超微粉,对灵芝中多糖、三萜的影响。方法:选择灵芝主要有效成分灵芝多糖、灵芝三萜的提取得率和液相图谱为考察指标,采用紫外分光光度法(UV)、高效液相色谱-二极管阵列检测器法(HPLC-PDA)、高效液相色谱-蒸发光散射检测器法(HPLC-ELSD),比较10目灵芝粉、80目灵芝细粉与300目超微粉中灵芝多糖、灵芝三萜的提取得率和液相图谱的变化。结果:灵芝经超微粉碎成300目的超微粉后,超微粉30 min的提取得率为10目粉90 min的2.3倍,为80目粉90 min的1.3倍;但从HPLC-ELSD图谱来看,超微粉碎后,高分子量灵芝多糖的溶出量并没有增加,在接近一万分子量部位的多糖反而减少。300目超微粉中灵芝三萜和甾醇与10目粉、80目粉相比,提取得率变化不大,液相图谱峰形也基本没有变化。结论:将灵芝粉碎成300目的超微粉,灵芝总多糖的提出率和溶出速度大幅提高,且对灵芝三萜基本没有影响,超微粉碎可显著提高灵芝的生物利用度。
超微粉碎;灵芝;多糖;三萜
中药行业引进微粉化技术始于20世纪90年代末,虽然该技术在我国中药现代化的应用研究刚起步,但作为中药现代化突破口之一,已成为近几年来中药界的研究热点[1]。
灵芝为多孔菌科真菌赤芝(Ganoderma lucidum(Leyss.ex Fr.)Karst.)或紫芝(Ganoderma sinense Zhao,Xu et Zhang)的干燥子实体[2]。大量药理研究表明,灵芝具有调节免疫、保肝、抗肿瘤、抗衰老、提高机体耐缺氧能力等活性[3]。灵芝传统的炮制方法为切厚片[4],然后用水煎煮进行服用,该方法的有效成分使用率极低,因为灵芝的纤维性强,水溶性浸出物只有3%左右,而超微粉碎可以提高中药材的生物利用度,本试验对 300目灵芝超微粉、10目粉和80目粉中的灵芝多糖、灵芝三萜等主要有效成分的提取得率和液相图谱的变化进行研究。
1 仪器与试药
1.1 仪器
LS230激光粒度分析仪(美国贝克曼库尔特有限公司);旋转蒸发仪(上海申生科技有限公司);UV2450紫外可见分光光度计(日本岛津);TDL-40B离心机(上海安亭科学仪器有限公司);LC20A高效液相色谱仪(日本岛津);Alltech 3300蒸发光散射检测器;十万分之一分析天平(塞多利斯);WZJ-610振动式药物超微粉碎机(济南倍力粉工程技术有限公司)。
1.2 试药
灵芝(批号:GC-L6-1309020,DB131104,GC-L6-131116,均由福建仙芝楼生物科技有限公司提供);葡聚糖对照品(西格玛);乙腈,乙醇乙酯,无水乙醇,甲醇(均由广东光华科技股份有限公司提供);灵芝酸 A,灵芝酸 B,灵芝酸 C,灵芝酸 C1,灵芝酸C2,灵芝酸E,灵芝酸G,灵芝酸H,灵芝酸I(由中国医学科学院药物研究所提供)。
2 方法与结果
2.1 灵芝超微粉的制备
先将灵芝药材粗粉碎,干燥至水分约为5%,设定粉碎温度为-5~ 10℃,进行超微粉碎45 min。经测定D90< 45 μm,细度达300目。
2.2 不同提取时间总多糖提出率的测定
参照《中华人民共和国药典》2010年版第二增补版灵芝项下多糖测定法进行检测[5]。
对照品溶液的制备:取无水葡萄糖对照品适量,精密称定,加水制成每1 mL含 0.14 mL溶液,即得。
标准曲线的制备:精密量取对照品溶液0.2, 0.4,0.6,0.8,1.0,1.2 mL,分别置试管中,各加水至2.0 mL,迅速精密加入硫酸蒽酮溶液(精密称取蒽酮0.1 g,加硫酸100 mL使溶解,摇匀)6 mL,立即摇匀,放置15 min后,立即置冰水浴中冷却15 min,取出,以相应的试剂为空白,照紫外-可见分光光度法(《中华人民共和国药典》2010年版一部附录ⅤA),在625 nm波长处测定吸光度,以吸光度为纵坐标,浓度为横坐标,绘制标准曲线,见图1。
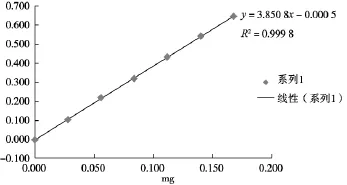
图1 无水葡萄糖对照品标准曲线
供试品溶液的制备:分别取300目灵芝超微粉、10目粉、80目粉各3份,每份约 2 g,精密称定,置圆底烧瓶中,加水100 mL,每种规格的灵芝粉分别按30,60,90 min加热回流,趁热抽滤,滤液置水浴上蒸干,残渣用水5 mL溶解,边搅拌边缓慢滴加乙醇75 mL,摇匀,在4℃放置12 h,离心,弃去上清液,沉淀物用水溶解并转至50 mL容量瓶中,摇匀,取溶液适量,离心,精密吸取上清液3 mL,置25 mL容量瓶中,加水至刻度,摇匀,即得。
测定法:精密量取供试品溶液2 mL,置试管中,照标准曲线制备项下的方法,自“迅速精密加入硫酸蒽酮溶液 6 mL”起,同法操作,测定吸光度,按回归方程求出供试品的多糖提取得率,结果见表1。
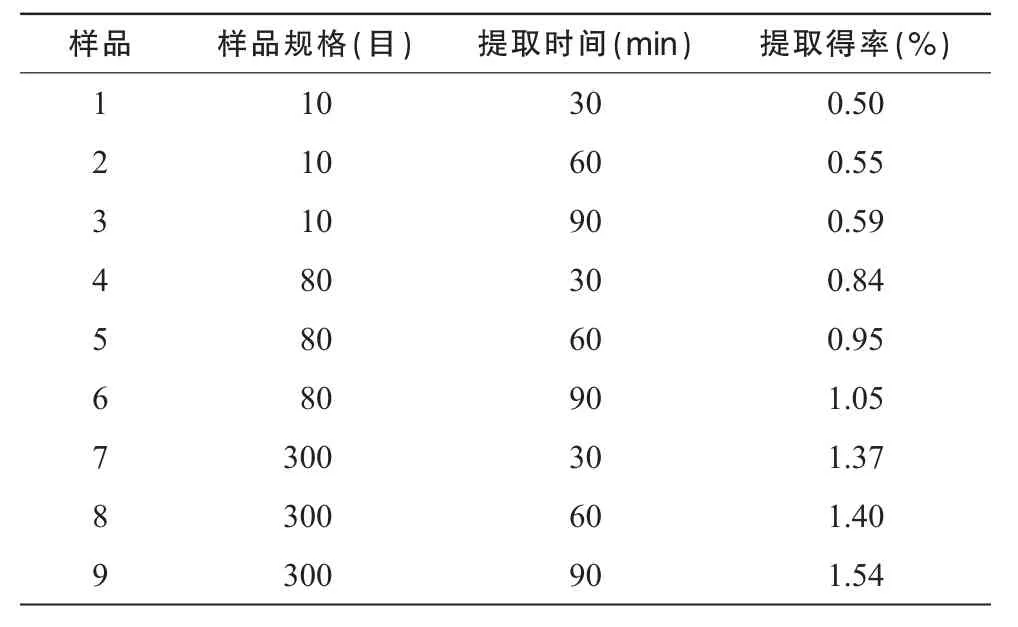
表1 灵芝粉(10目、80目)、灵芝超微粉(300目)提取得率测定结果
2.3 三萜及甾醇的测定
按《中华人民共和国药典》2010年版第二增补版灵芝项下三萜及甾醇含量测定法进行测定[5],结果见表2。
2.4 灵芝多糖相对分子量分布的分析
照高效液相色谱法(《中华人民共和国药典》2010年版一部附录ⅥD)测定。
色谱条件与系统适用性试验:凝胶色谱柱TSK-GEL G4000 PWXL(10 μm,7.8 mm×30 cm);乙腈-水(5∶90)为流动相;使用蒸发光散射检测器,漂移管温度60℃,气体流量1.5 mL/min。
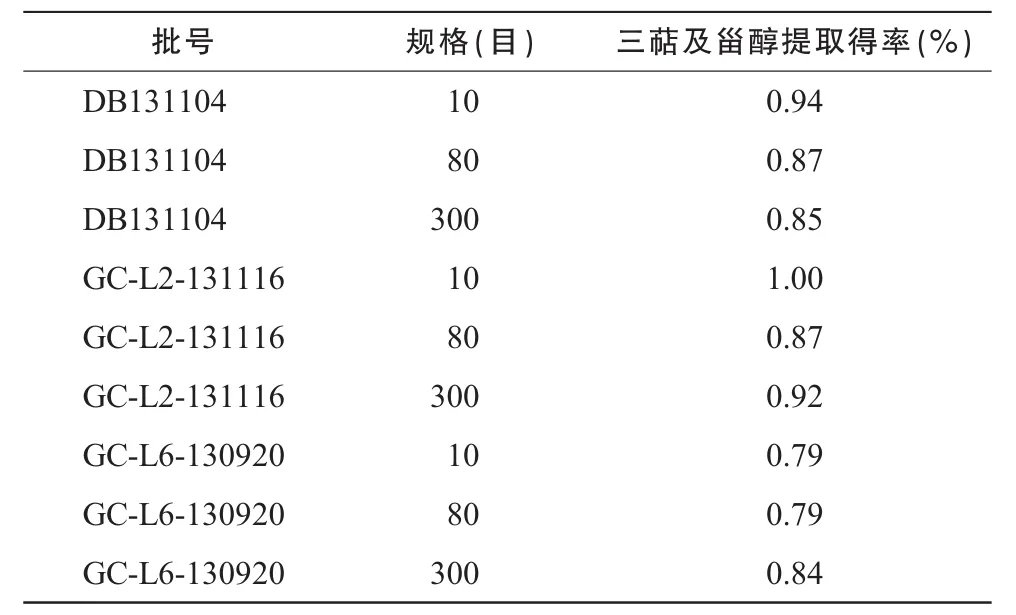
表2 三萜及甾醇提取得率测定结果
对照品溶液的制备:分别取分子量为MW= 5.0×105,MW=1.10× 105,MW=6.06×104,MW=1.26×104的葡聚糖对照品0.053 0,0.053 9, 0.060 0,0.051 6 g定容至10 mL,分别制成浓度为5.3,5.39,6.0,5.16 mg/mL对照品溶液。
供试品溶液的制备:分别取灵芝超微粉、10目粉、80目粉各1 g,精密称定,置圆底烧瓶中,加水100 mL,回流提取1 h,趁热抽滤,浓缩定容至10 mL。
测定法:精密吸取对照品溶液、供试品溶液各20 μL,注入液相色谱仪,测定。结果见图2~ 5。
2.5 灵芝酸的测定及灵芝三萜液相图谱
照高效液相色谱法《中华人民共和国药典》2010年版一部附录ⅥD)测定。
色谱条件与系统适用性试验:XDB-C18色谱柱(4.6 mm×250 mm,5 μm),波长254 nm,流速1.0 mL/min,以甲醇、乙腈、0.04%的甲酸为流动相进行梯度洗脱。
对照品溶液的制备:称取灵芝酸A,B,C,C1,C2,E,F,I各5 mg,精密称定,用甲醇定容至10 mL,然后各取1 mL,置10 mL容量瓶中,用甲醇定容至刻度。
供试品溶液的制备:分别称取10目、80目、超微粉样品各约1 g,精密称定,加乙酸乙酯50 mL超声提取30 min,过滤、蒸干,加甲醇转移定容至10 mL。
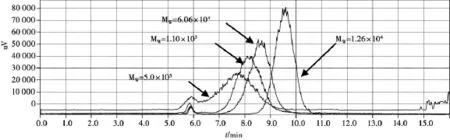
图2 4种葡聚糖对照品
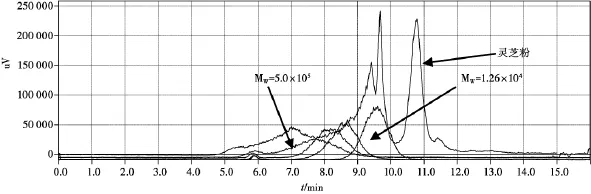
图3 灵芝粉与葡聚糖对照品
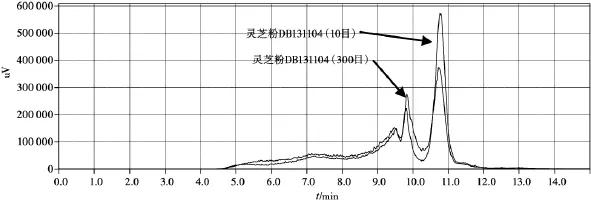
图4 灵芝粉(DB131104,10目、300目)
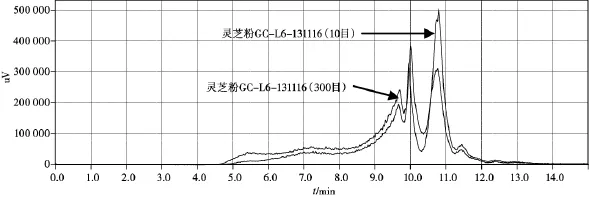
图5 灵芝粉(GC-L6-131116,10目、300目)
测定法:精密吸取对照品溶液、供试品溶液各20 μL,注入液相色谱仪,测定,并计算灵芝酸 A的含量。测定结果见图6~ 9,灵芝酸的测定结果见表3。
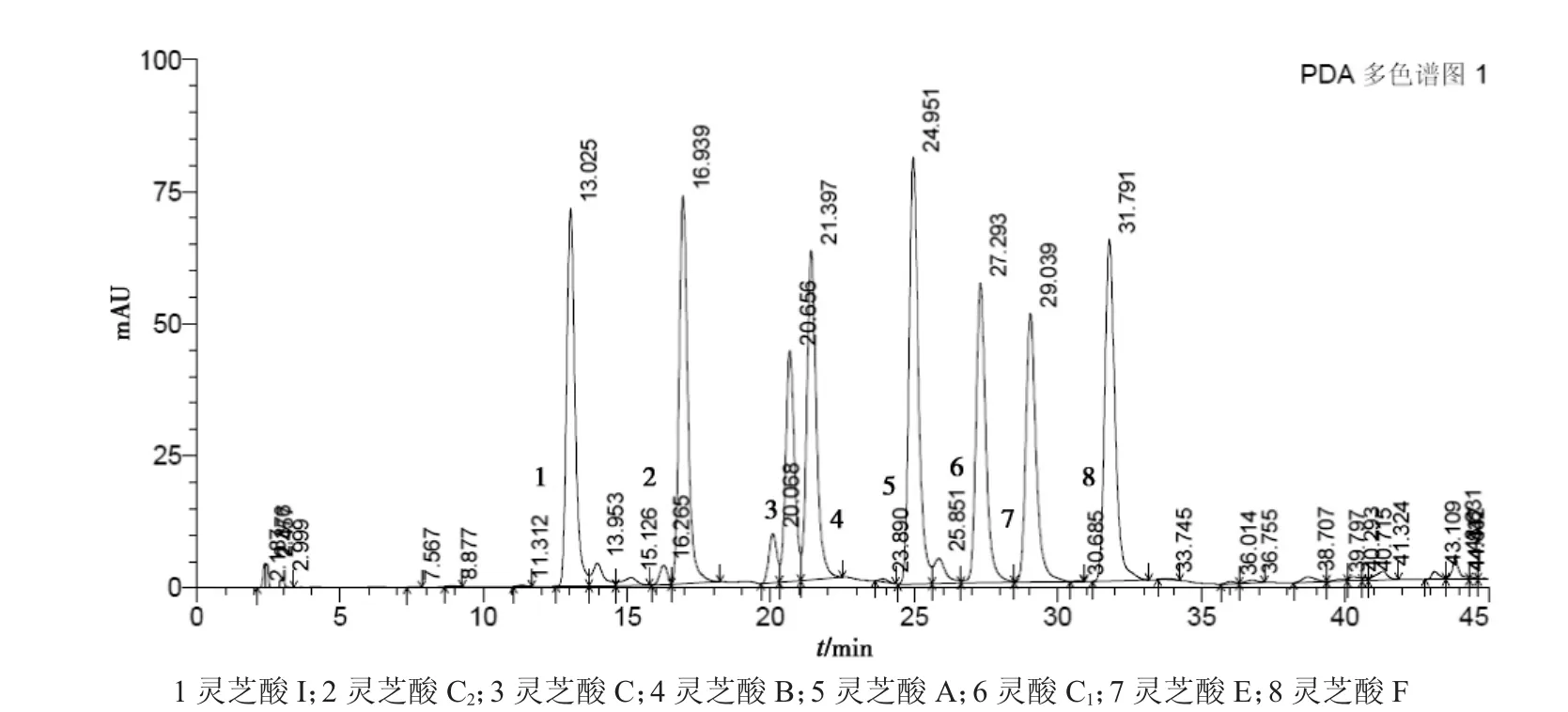
图6 8种灵芝酸对照品
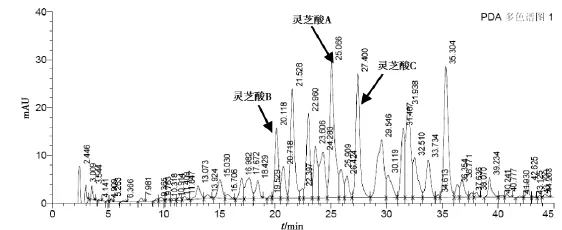
图7 灵芝粉(GC-L6-1309020,10目)
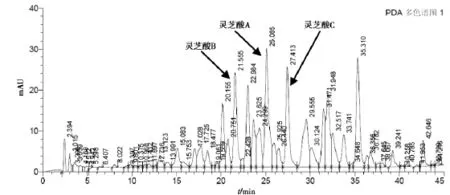
图8 灵芝粉(GC-L6-1309020,80目)

图9 灵芝粉(GC-L6-1309020,300目)
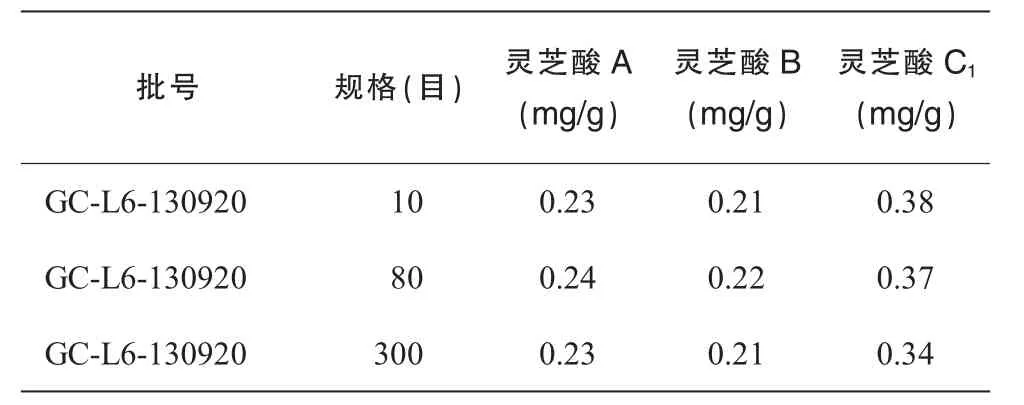
表3 3种规格灵芝粉中灵芝酸A,B,C1的测定结果
3 讨论
从不同提取时间灵芝多糖提取得率试验可以看出,超微粉碎后,灵芝总多糖的提取得率和溶出速度均大幅增加,超微粉30 min的提取得率为10目粉90 min的2.3倍,为80目粉90 min的1.3倍。但从HPLC-ELSD图谱来看,超微粉碎后,灵芝多糖的溶出量并没有增加,而是在接近一万分子量部位的多糖反而减少了,这表明,在超微粉碎过程中,这部分多糖部分被破坏。灵芝多糖的分子量分布较广,从1万左右至50万以上,在常规细粉中不易溶出,将灵芝粉碎成300目的细粉,细胞壁破裂,多糖比较容易溶出。
从三萜及甾醇的含量测定来看,3种规格的灵芝粉提取得率变化不大,这可能是由于灵芝三萜为小分子物质,比较容易被溶出来,与细度关系不大。从灵芝三萜的液相图谱来分析,3种规格灵芝粉的峰形和峰高基本一致,从灵芝酸A、灵芝酸B、灵芝酸 C1的含量测定结果来看,10目粉、80目粉、300目粉的灵芝酸的含量也基本一致。如将灵芝粉碎成比300目更细的灵芝粉,是否会对三萜有很大的影响,需作进一步的研究。
4 结论
将灵芝粉碎成300目的超微粉,灵芝总多糖的提出率和溶出速度大幅提高,且对灵芝三萜基本上没有影响,超微粉碎可显著提高灵芝的生物利用度,灵芝是我国医药保健品中应用最多和最广泛的中药材之一,进行超微粉碎可为深加工产业和新产品开发提供新的技术支撑。
[1] 徐月红,王宁生.中药微粉化的现状与分析[J].中国中药杂志,2004,29(6):497-500.
[2] 国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2010:174-175.
[3] 张晓云,杨春清.灵芝的化学成分和药理作用[J].国外医药:植物药分册,2006,21(4):152-155.
[4] 福建省食品药品监督管理局.福建省中药饮片炮制规范[M].福建:福建科学技术出版社,2013:108-109.
[5] 国家药典委员会.中华人民共和国药典(第二增补本)[S].北京:中国医药科技出版社,2013:93-94.
Effects of Superfine Grinding on Ganoderma Lucidum Polysaccharide and Triterpenes
Wu Changhui (College of Chemistry of Fuzhou University,Fujian Fuzhou 350116,China;Fujian Xianzhilou Biological Technology Co.,Ltd.,350002)
Objective:To investigate the effects of superfine grinding on ganoderma lucidum polysaccharide and triterpenes by crushing ganoderma lucidum into 300 mesh superfine powder.Methods:The extracting yields of ganoderma lucidum polysaccharides and ganoderma lucidum triterpenes and HPLC maps were used as the study indexes,and comparison was made on the changes of extracting yields of ganoderma lucidum polysaccharides and triterpenes and HPLC maps among 10 mesh powder,80 mesh fine powder and 300 mesh superfine powder by UV,HPLC-PDA and HPLC-ELSD.Results:The extracting yield of 300 mesh superfine powder extracted for 30 min was 2.3 times of 10 mesh powder extracted for 90 min,and 1.3 times of 80 mesh powder extracted for 90 min. Using the maps of HPLC-ELSD,the dissolved quantity of the superfine powder of ganoderma lucidum polysaccharides did not increase,but the polysaccharides decreased when closing to ten thousand molecular weight.Comparing with 10 mesh powder and 80 mesh fine powder of ganoderma lucidum,the extracting yields of ganoderma lucidum triterpenes and sterol in 300 mesh superfine powder had no big changes,and no big change was found onthe HPLC peak.Conclusion:When ganoderma lucidum was smashed into 300 mesh superfine powder,the extraction rate and dissolution rate of ganoderma lucidum polysaccharides increased greatly while there was basically no impact on ganoderma lucidum triterpenes.Superfine grinding can significantly increase the bioavailability of ganoderma lucidum.
Superfine Grinding;Ganoderma Lucidum;Polysaccharides;Triterpenes
10.3969/j.issn.1672-5433.2015.08.005
2015-04-19)
吴长辉,男,在读硕士,副主任药师。主要从事药品、保健食品的质量控制和制剂研究工作。E-mail:87974413@qq.com

