局灶性脑缺血大鼠脑组织硫化氢水平的动态变化
骆海坤 张建新 李国风
作者单位: 054000河北省邢台市第三医院药剂科(骆海坤);河北省医学科学院药物研究所(张建新、李国风)
局灶性脑缺血大鼠脑组织硫化氢水平的动态变化
骆海坤张建新李国风
作者单位: 054000河北省邢台市第三医院药剂科(骆海坤);河北省医学科学院药物研究所(张建新、李国风)
【摘要】目的观察大鼠局灶性脑缺血过程中不同时间内源性H2S含量的变化。方法健康成年雄性Sprague-Dawley(SD)大鼠共192只,体重250~300 g,随机分为假手术组、缺血1 h组、缺血3 h组,缺血6 h组,缺血9 h组,缺血12 h组,缺血24 h组。假手术组共48只(不同时间点各8只),其余组各8只。其中96只观察计算梗死体积,另96只测定其他指标。采用Zea-Longa线栓法建立局灶性脑缺血模型,参照Longa评分法,对大鼠进行神经功能缺损程度的评分,于术后1、3、6、9、12和24 h后断头取脑,观察并计算脑梗死体积,检测脑组织中H2S水平。结果与假手术组比较,缺血1 h组无明显变化,从缺血3 h到24 h,出现不同程度的神经功能缺损症状,随着时间的延长,缺血3、6、9、12和24 h时梗死灶增大(P<0.01),各组大鼠脑组织中H2S水平均明显降低(P<0.05或<0.01)。结论缺血3h后,随缺血时间延长,脑组织梗死体积逐渐增大,H2S含量明显降低。
【关键词】硫化氢;梗死体积;局灶性脑缺血;氧化应激
E-mail: jianxinzhang3@ hotmail.com
缺血性脑损伤是因局部血管栓塞造成的脑循环血流量减少为特征的中枢神经系统疾病,是导致人类死亡的重要原因之一。大量文献证实,H2S参与了脑缺血性损伤的发生。内源性H2S作为一种新型神经递质,在神经系统生理和病理生理过程中发挥重要作用[1,2]。有学者报道H2S可通过对抗线粒体氧化应激作用[2],保护神经细胞避免氧化损伤[2],因此我们建立大鼠局灶性大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)模型,观察大鼠在局灶性脑缺血过程中不同时间内源性H2S的动态过程,以探讨其在局灶性脑缺血损伤中的作用,为临床应用提供实验依据。
1 材料与方法
1.1动物与分组健康雄性SD大鼠,192只,体重250~300 g,由河北省实验动物中心提供,合格证号: 1110096。随机分为假手术组(n =48)和缺血组(n =48)根据时间分为1、3、6、9、12、24 h亚组,每组8例。其中96只观察计算梗死体积,另96只测定其他指标。
1.2局灶性脑缺血损伤模型的制备采用Zea-Longa等线栓法建立局灶性脑缺血模型,大鼠10%水合氯醛麻醉,消毒皮肤,取颈正中切口,分离组织,游离左侧颈总动脉(common carotid artery,CCA)、颈外动脉(exter-nal carotid artery,ECA)、颈内动脉(internal carotid artery,ICA),电凝颈外动脉的分支及颈外动脉与颈内动脉的交通支,结扎颈外动脉远心端,电灼断,在结扎部位近心端剪一小口入栓塞线,栓线进入颈内动脉,直至大脑中动脉的起始处,长度约18.5 mm。假手术组只做颈部手术,游离血管,但不插入线栓。
1.3神经功能缺损的变化术后依照Longa评分法进行神经功能缺损程度的评分,以判定模型是否成功。0分:无神经功能缺损症状; 1分:轻微神经功能缺损,对侧前爪不能完全伸展; 2分:中度局灶性神经功能缺损,身体向对侧旋转; 3分:重度局灶性神经功能缺损,身体倒向对侧; 4分:不能自发行走,意识水平下降。
1.4缺血体积变化阻断大脑中动脉后,7组大鼠于相应时间点麻醉,断头处死大鼠,快速取出完整的脑组织,置于-20℃冰箱内,约20 min,脑组织冷冻坚硬后,以2 mm间距冠状切成6片,弃去嗅球及小脑组织。将切片浸泡在盛有20 ml 2%TTC溶液的玻璃器皿内,置入37℃恒温箱内避光、孵育染色10 min,脑组织切片梗死区呈白色,非梗死区呈红色,形成界限分明的不同区域,将切片移入盛有10%甲醛溶液的避光器皿中固定24 h,对切片照相,图像进行分析,观察并计算大鼠缺血体积的变化。为减少大鼠脑水肿个体差异及拍照对脑梗死体积测定的影响,对每只大鼠以梗死体积/全脑体积(IV%)作统计参数。
1.5组织中H2S含量的测定采用去蛋白的方法测定[3],用不同浓度的NaHS绘制标准曲线。在不同时间点处死大鼠开颅取脑,分离出缺血侧脑组织,放入液氮保存备用。用0~4℃的50 mmol/L磷酸钾缓冲液(pH组7.4)制备匀浆(质量体积比为12%),匀浆液离心(47 000×g,10 min,4℃),取75 μl上清液移至另一离心管中,在室温下加入0.25 ml的1%醋酸锌及0.45 ml蒸馏水孵育10 min,然后加入10%三氯乙酸0.25 ml再次离心(14 000×g,10 min,4℃),收集清澈的上清液,加入133 μl的N,N-二甲基对苯二胺盐酸盐(20 mmol/L)/HCl(7.2 mol/L)缓冲液及133 μl的FeCl3(30 mmol/L)/HCl(1.2 mol/L)缓冲液,充分混匀。20 min后,用全自动酶标仪(Bio-TEK EL×800,美国)在波长670 nm测定吸光度,根据不同浓度NaHS绘制的标准曲线计算溶液中的H2S含量,以单位重量的脑组织中H2S的量(nmol/g)表示
1.6统计学分析应用SPSS 13.0统计软件,计量资料以±s表示,组间比较采用单因素方差分析(One-Way ANOVA),P<0.05为差异有统计学意义。
2 结果
2.17组神经功能缺损的变化与相应假手术组比较,各缺血组大鼠均出现不同程度的神经功能缺损症状,表现为提起尾巴对侧前肢无力曲屈,身体向对侧旋转,身体倒向对侧等。
2.27组缺血体积变化假手术组大鼠在1~24 h无明显变化,与相应假手术组大鼠比较,缺血1 h时大鼠脑组织无明显缺血灶,缺血3 h时可见明显梗死灶(P <0.01),随时间延长,缺血6、9、12 h和24 h时缺血体积明显增大(P<0.01)。见图1,表1。

图1 缺血后染色的脑切片变化
表1 7组不同时间缺血体积变化 %,±s
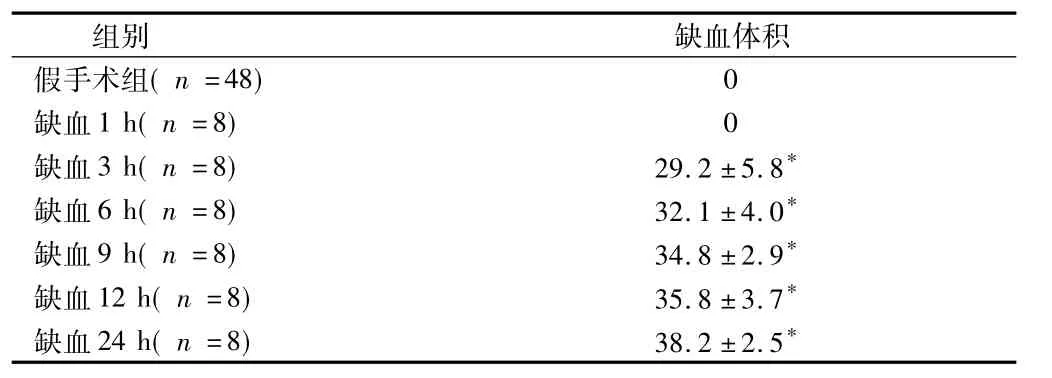
表1 7组不同时间缺血体积变化 %,±s
注:与假手术组比较,*P<0.01
组别 缺血体积假手术组(n =48)0缺血1 h(n =8) 0缺血3 h(n =8) 29.2±5.8*缺血6 h(n =8) 32.1±4.0*缺血9 h(n =8) 34.8±2.9*缺血12 h(n =8) 35.8±3.7*缺血24 h(n =8) 38.2±2.5*
2.3脑组织中H2S含量的变化假手术组大鼠脑组织中H2S含量在缺血后1~24 h无明显变化。与相应假手术组大鼠比较,缺血1 h时大鼠组织中H2S含量无明显变化,随着时间的延长,缺血3、6、9、12和24 h大鼠脑组织H2S含量均明显降低(P<0.05或<0.01)。见表2。
3 讨论
建立大鼠局灶性大脑中动脉栓塞模型(MCAO),是研究缺血性脑损伤的重要方法,Longa线栓法[4]具有不用开颅,损伤小,易操作且模拟性强等特点,应用较广泛。线栓由颈外动脉进入,经颈内动脉,至大脑中
表2 不同时间脑组织中H2S含量变化 n =8,±s

表2 不同时间脑组织中H2S含量变化 n =8,±s
注:与假手术组比较,*P<0.05,#P<0.01
时间 组别 H2S (nmol/g)1 h 假手术组40±10缺血组 34±6 3 h 假手术组 37±8缺血组 24±6*6 h 假手术组 38±8缺血组 22±6#9 h 假手术组 37±8缺血组 26±7*12 h 假手术组 34±3缺血组 24±5#24 h 假手术组 38±8缺血组 25±6#
动脉起始处,进入长度约18.5 mm,阻断血液循环,引起大脑中动脉供血区的脑组织局灶缺血,从而形成局灶性脑缺血模型。本研究建立模型时,对Longa线栓法进行了改良,在颈部正中切口,分离出血管后不用血管夹,改用缝合线牵引阻断颈总动脉血流,松开牵引即恢复血流,避免出现难以控制的出血,不需结扎颈总动脉。采用Longa评分法表明,缺血模型组大鼠术后出现明显的神经功能障碍,表现为提起尾巴右侧前肢无力屈曲,身体向右侧旋转,倒向右侧。同时,对缺血大鼠脑组织切片染色,清楚可见大鼠大脑左侧额顶皮质以及基底节区明显的梗死区,呈白色,而血液循环正常的血流供应区呈现红色,界限分明,易于分辨,表明栓塞效果良好,模型制备成功。
H2S广泛存在于哺乳动物的多种组织和器官中,有报道内源性H2S在大鼠脑内的浓度是50~160 μmol/L[5],Eto等[6]通过基因敲除研究认为,神经系统内合成H2S的主要酶是CBS,最近Shibuya等[7,8]研究敲除CBS基因的小鼠证实,3MST是神经系统生成H2S的重要酶,3MST与半胱氨酸丙转氨酶(CAT)共同作用,以L-半胱氨酸和a-酮戊二酸为底物,生成H2S,并证实神经系统中由3MST酶促产生的H2S含量较高。CAT与3MST酶体系的发现,可能为H2S的生成及作为信号分子提供新的见解,但是H2S和3MST的关系及作用机制还不是很清楚。在研究新生大鼠缺氧缺血性脑损伤(HIBD)发生发展时,任彩丽等[9]观察到脑皮层H2S含量亦呈动态变化,认为H2S在缺血性脑血管病的病理生理变化中可能起着重要的作用,本实验通过建立大鼠局灶性大脑中动脉栓塞模型,观察了大鼠体内H2S含量在缺血不同时间的动态变化及脑组织梗死体积的改变,结果表明与假手术组比较,缺血1 h组大鼠脑组织无明显梗死,H2S含量也无明显变化,在缺血3 h后,随时间延长,脑组织梗死体积逐渐增大,脑组织明显受损伤,H2S含量明显降低,提示H2S参与了局灶性脑缺血的发生发展过程。H2S可能通过抗氧化应激作用,升高细胞内谷胱甘肽水平,避免谷氨酸的氧化毒性作用的损伤,对脑组织起到保护作用[10]。邓芳帆等[11]的研究得出结论,H2S可下调脑组织caspase-3表达,抑制神经细胞凋亡。通过研究硫化氢对全脑缺血-再灌注大鼠损伤的作用,任彩丽等[12]认为H2S对脑缺血/再灌注损伤的保护机制可能跟抗脂质过氧化损伤、清除自由基,提高抗氧化剂能力有关。杨燕等[13]以帕金森病(PD)细胞模型,探讨硫化氢对该模型的保护作用及机制,结论提示,硫化氢可以通过促进细胞内源性抗氧化系统活性改善PD细胞模型的氧化应激状态,以减少氧自由基生成,稳定线粒体膜电位,减少线粒体损伤,最终减少细胞死亡。
综上所述,神经系统内H2S可能通过抑制及清除氧化性物质的作用,减轻氧化应激,起到保护神经元的作用。H2S在缺血性脑血管病的病理生理变化中可能起着重要的作用,有望成为新的临床监测指标,其对脑组织的保护作用及具体机制我们将进一步研究。
参考文献
1 Lowicka E,Beltowski J.Hydrogen sulfide (H2S)-the third gas of interest for pharmacologists.Pharmacol Rep,2007,59: 4-24.
2 Szabo C.Hydrogen sulphide and its therapeutic potential.Nat Rev Dru Discov,2007,6: 917-935.
3 Qu K,Chen CP,Halliwell B,et al.Hydrogen sulfide is a mediator of cerebral ischemic damage.Stroke,2006,37: 889-893.
4 Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebralatery occlusion without craniectomy in rats.Stroke,1989,20: 84-91.
5 Abe K,Kimura H.The possible role of hydrogen sulfide as an endogenous neuromodulator.J Neurosci,1996,16: 1066-1071.
6 Eto K,Kimura H.The production of hydrogen sulfide is regulated by testosterone and S-adenosy l-L-methionine in mouse brain.J Neurochem,2002,83: 80-86.
7 Shibuya N,Tanaka M,Yoshida M,et al.3-Mercaptopyruvate sulfur transferase produces hydrogen sulfide and bound sulfane sulfur in the brain.Antioxid Redox Signal,2009,11: 703-714.
8 Shibuya N,Mikami Y,Kimura Y,et al.Vascular endothelium expresses 3-mercap to pyruvate sulfur transferase and produces hydrogen sulfide.Biochem,2009,146: 623-626.
9 任彩丽,赵红岗,刘磊,等.缺氧缺血性脑损伤新生大鼠皮质脑组织硫化氢的动态变化.实用儿科临床杂志,2008,23: 930-931.
10 Kimura K,Kimura H.Hydrogen sulfide protects neurons from oxidative stress.FASEB,2004,18: 1165-1172.
11 邓芳帆,周细中,方素珍,等.硫化氢对新生大鼠缺氧缺血性脑损伤后神经细胞凋亡的影响.临床儿科杂志,2013,31: 551-556.
12 任彩丽,张国富,蔡德亮,等.外源性硫化氢对大鼠全脑缺血-再灌注损伤的保护作用.中国脑血管病杂志,2013,10: 421-424.
13 杨燕,常飞,曹旭.气体信使H2S对MPP +所致PC12细胞损伤的保护作用及其机制.华中科技大学学报(医学版),2014,43: 17-22.
Dynamic changes of content of hydrogensulfide in brain tissue of focal cerebral ischemia of rats
LUO Haikun,ZHANGJianxin,LI Guofeng.
Department of Pharmacy,The Third Hospital of Xingtai City,Hebei,Xingtai 054000,China
【Abstract】Objective To observe the changes of content of endogenous hydrogensulfide (H2S)during different time points in brain tissue of focal cerebral ischemia of rats.Methods One hundred and ninety-two male Sprague-Dawley (SD)rats weighted 250~300g were randomly divided into seven groups: sham-operation group,ischemia 1h,3h,6h,9h,12h,24h group,with 96 rats in sham-operation group and 16 rats in each ischemia group.Among 192 rats,the infarction area in 96 rats were detected,however,the other parameters were detected in the other 96 rats.The focal cerebral ischemia models in rats were established by Zea-Longa thread ligation,then according to Longa scoring method,the neurologic impairment degree scoring was performed.The cerebral infarction area was calculated by means of image analysis system at 1h,3h,6h,9h,12h,24h after operation and the levels of H2S in brain tissue were detected.Results As compared with those in sham-operation group,the symptoms of neurological impairment were more and more obvious from 3h to 24h after ligation,with the time going on,the cerebral infarction area was gradually increased from 3h to 24h (P<0.01).Furthermore the levels of H2S in brain tissue were significantly decreased in ischemia 3h,6h,9h,12h and 24h groups,as compared with those in sham-operation group (P <0.05 or P<0.01).ConclusionWith time going on,the cerebral infarction area in rats is gradually increased from 3h to 24h after ischemia and the contents of H2S were obviously decreased,which suggests that H2S may play an important role during physiopathologic process of focal cerebral ischemia.
【Key words】hydrogen sulfide; infraction volume; focal cerebral ischemia; oxidative stress
(收稿日期:2014-10-23)
通讯作者:张建新,050021石家庄市,河北省医学科学院药物研究所;
doi:10.3969/j.issn.1002-7386.2015.06.009
【文章编号】1002-7386(2015)06-0833-03
【文献标识码】A
【中图分类号】R 329.481.1

