肺癌患者血清和胸水中Dickkopf-1的表达及临床意义
李银鹏 石芳 杨婧 刘政
作者单位: 065000河北省廊坊市,中国石油中心医院呼吸科
肺癌患者血清和胸水中Dickkopf-1的表达及临床意义
李银鹏石芳杨婧刘政
作者单位: 065000河北省廊坊市,中国石油中心医院呼吸科
【摘要】目的探讨肺癌患者血清以及胸水中Dickkopf-1(DKK-1)的表达,以及其在临床应用中的诊断价值。
方法选取2011年3月至2012年4月呼吸科肺癌82例,良性病变者38例。酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测肺癌以及肺部良性病变患者血清以及胸水中DKK-1的浓度,比较肺癌与肺部良性病变患者血清以及胸水中DKK-1的表达情况。结果肺癌患者血清以及胸水中DKK-1的含量均较肺部良性病变患者显著增高(P<0.05)。血清中与胸水中DKK-1的表达正相关(r =0.72,P<0.05)。血清以及胸水中DKK-1用于诊断肺癌以及肺癌骨转移的敏感性及特异性均较高。非小细胞肺癌(NSCLC)患者予以正规化疗2个疗程后患者血清中DKK-1表达降低(P<0.05)。结论DKK-1有望成为肺癌以及肺癌骨转移的诊断与治疗新的靶点。
【关键词】DKK-1;肺肿瘤;酶联免疫吸附法;骨转移
E-mail: keaiduo68@163.com
肺癌是严重威胁人类健康的恶性肿瘤,其发病率及病死率在世界范围内占肿瘤性疾病的第一位[1],虽然近年来肺癌的早期诊断以及治疗方面取得了一些进展,但肺癌的总体预后仍然很差,其5年生存率总体不超过15%[2]。因此寻找理想的肺癌诊断、治疗、预后的指标具有重要的临床意义。Dickkopf-1(DKK-1)为一种分泌型糖蛋白,有研究表明DKK-1在肺癌患者的血清中高表达,有望成为肺癌诊断以及评价预后的新的血清学指标[3],本研究通过检测肺癌患者血清以及胸水中DKK-1的表达探讨其临床意义。
1 资料与方法
1.1一般资料收集2011年3月至2012年4月在我院呼吸科住院患者120例,其中男78例,女42例;平均年龄(63±12)岁。肺癌患者82例,良性病变患者38例。肺癌患者均经病理证实,腺癌37例,小细胞肺癌21例,鳞癌24例;伴有胸膜转移引起胸水28例,伴有骨转移31例。患者均为初诊患者且未经过放化疗,并排除合并有其他恶性肿瘤。肺癌的分期按美国癌症联合委员会癌症分期(TNM)手册(2009,第7版)制定的原则[3],Ⅰ期14例,Ⅱ期11例,Ⅲ期10例,Ⅳ期47例。对照组为同期住院良性病变患者38例,包括肺部感染15例,肺结核8例,结核性胸膜炎15例伴有胸水。
1.2检测方法患者入院第2天清晨抽取静脉血5 ml,室温下放置30 min,1 500 r/min,离心10 min,取上清液放入-70℃冰箱保存,待测。胸腔积液患者入院后行胸腔穿刺时收集胸腔积液15 ml,同时次日清晨抽取静脉血,同样按照上述方法处理标本,待测。试剂及仪器:人DKK-1ELISA检测试剂盒购苏州科创生物技术有限公司(美国RayBiotech生物公司生产),具体操作步骤严格按照试剂说明进行操作,酶标仪购自美国Biorad公司。
1.3统计学分析应用SPSS 13.0统计软件,计量资料以x±s表示,各组之间DKK-1浓度的比较采用独立样本t检验,化疗前后采用血清中DKK-1浓度的比较采用配对t检验,肿瘤各种类型以及分期之间DKK-1浓度的比较采用单因素方差分析,P<0.05差异有统计学意义。
2 结果
2.12组患者血清中DKK-1浓度肺癌患者血清DKK-1浓度为(36±17)ng/ml,明显高于肺部良性病变患者(11±7)ng/ml,差异有统计学意义(P<0.01),而在肺部良性病变中肺部感染(9±6)ng/ml与肺结核(14±9)ng/ml患者血清DKK-1的浓度比较,差异无统计学意义(P>0.05)。
2.22组患者胸水中DKK-1浓度肺癌伴胸膜转移引起胸水以及结核性胸膜炎患者胸水中DKK-1浓度分别为(31±17)ng/ml和(14±7)ng/ml,差异有统计学意义(P<0.05)。而在肺癌伴有胸水的患者中肺腺癌(28±12)ng/ml,小细胞肺癌(36±21)ng/ml,鳞癌(19±5)ng/ml之间两两比较,差异均无统计学意义(P>0.05)。43例(肺癌28例,结核性胸膜炎15例)患者同时收集外周血及胸水的DKK-1浓度分别为(27 ±17)ng/ml VS(34±20)ng/ml,通过双变量相关分析二者呈正相关(r =0.72,P<0.05)。见图1。
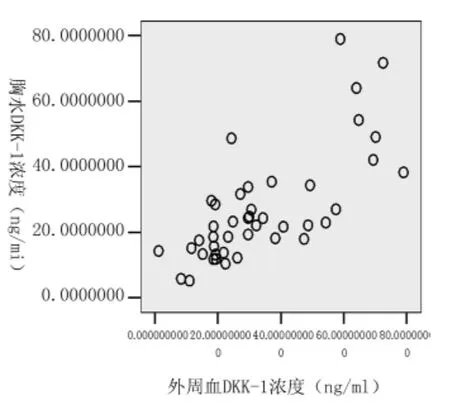
图1 肺癌患者血清以及胸腔积液中DKK-1浓度的相关性
2.3血清及胸水中DKK-1对肺癌的诊断价值应用ROC曲线计算血清中DKK-1诊断肺癌的最佳临界值为19.22 ng/ml,其敏感度为83.3%,特异度为82.1%,其曲线下面积为0.931,同样胸水中DKK-1诊断肺癌的最佳临界值为15.42 ng/ml,其敏感度为87.9%,特异度为70%,其曲线下面积为0.832,见图2。

图2 血清以及胸水中DKK-1诊断肺癌的ROC曲线
2.4血清中DKK-1浓度对肺癌骨转移的诊断价值31例肺癌伴有骨转移患者DKK-1浓度较无骨转移者显著升高,进一步通过ROC曲线计算肺癌骨转移血清中DKK-1诊断肺癌骨转移的最佳临界值为36.76 ng/ml,其敏感度为80.6%,特异度为78.4%,曲线下面积为0.843。见图3。
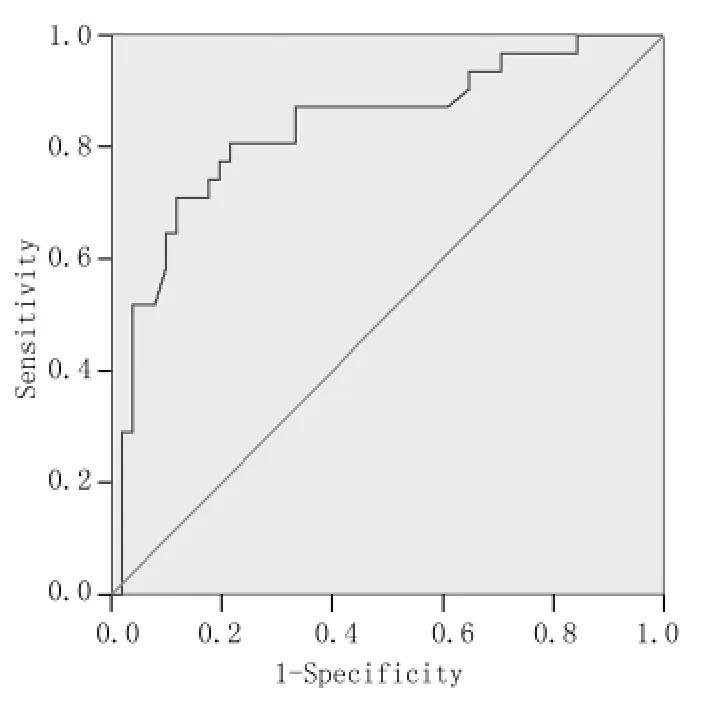
图3 血清中DKK-1浓度诊断肺癌骨转移ROC曲线
2.5化疗前后血清DKK-1浓度的变化15例Ⅳ期肺癌患者分别于第1次及第3次化疗前抽取静脉血检测其DKK-1的浓度化疗后(32±18)ng/ml较化疗前(48 ±21)ng/ml血清中DKK-1浓度明显降低(P<0.01)。
2.6DKK-1浓度与肺癌临床特征之间的关系肺癌患者中不同性别,吸烟状况患者之间DKK-1浓度差异无统计学意义(P>0.05),而在组织学类型中鳞癌与小细胞肺癌患者之间差异有统计学意义(P<0.05),其余各种肿瘤之间差异无统计学意义(P>0.05)。在不同肿瘤分期,有无淋巴结转移,以及有无骨转移的患者中DKK-1浓度差异有统计学意义(P<0.05)。见表1。
3 讨论
DKK-1为Wnt传到通路拮抗剂,为一种分泌型糖蛋白,其通过与Wnt蛋白竞争结合LRP5/6受体而直接抑制Wnt蛋白活性,进而来调控细胞的分化、增殖、
表1 DKK-1浓度与肺癌临床特征 ±s

表1 DKK-1浓度与肺癌临床特征 ±s
项目 DKK-1(ng/ml) P值性别男(n =55) 38±19 >0.05 女(n =27) 36±17吸烟无(n =32) 36±17 >0.05 有(n =50) 40±20组织学类型腺癌(n =37) 38±19 >0.05小细胞肺癌(n =21) 44±20 <0.05鳞癌(n =24) 31±12分期Ⅰ~Ⅱ(n =32) 28±12 <0.05Ⅲ~Ⅳ(n =50) 44±18淋巴结转移无(n =45) 29±14 <0.05 有(n =37) 47±17骨转移无(n =51) 29±18 <0.05 有(n =31)51±17
迁移或癌变等特性,在肿瘤发生方面发挥重要作用[4,5],有大量的研究表明,DKK-1在肺癌患者血清以及肺癌标本中高表达[6],其在肺癌患者血清以及标本中的异常表达可能为肺癌的早期诊断、治疗及其预后提供了新的理论基础。同样本研究通过检测肺癌患者血清及胸水中DKK-1的浓度提示,在肺癌患者血清中DKK-1高表达,且在晚期、伴有淋巴结及骨转移的患者中表达更高。且予以正规化疗后DKK-1浓度降低,同样在胸水中较结核性胸膜炎患者肺癌伴有胸腔积液的患者DKK-1浓度更高。同时血清及胸水中DKK-1的浓度检测对肺癌的诊断的敏感性及特异性均较高。
本研究通过ELISA检测82例肺癌患者血清中DKK-1浓度,发现肺癌患者血清DKK-1浓度为(36± 17)ng/ml,明显高于肺部良性病变患者的(11±7)ng/ml,差异有统计学意义(P<0.01),研究结果与Sheng等[7]通过免疫荧光测量法检测592例恶性肿瘤患者、72例良性肺部疾病患者及120名健康患者血清中DKK-1的提示肺癌患者血清的DKK-1浓度显著高于肺部良性病变患者的结果一致,同时Sheng等[7]进一步研究发现血清DKK-1的含量与肿瘤的组织分型及患者的年龄和性别无关,而与肿瘤的分期、淋巴结转移及远处转移相关。
而本研究发现性别以及吸烟与否对DKK-1的浓度无影响,同样肺癌晚期(Ⅲ~Ⅳ),伴有淋巴结转移的患者中其DKK-1浓度显著高于肺癌Ⅰ~Ⅱ期,无淋巴结转移的患者。在肿瘤的分型中本研究发现小细胞肺癌患者血清中DKK-1含量高于肺鳞癌此研究结果与Yamabuki等[6,7]的研究提示DKK-1含量与肺癌组织学类型无关的结果不一致,考虑可能是本研究肺癌患者病例数相对较少有关。
大部分肺癌患者在第1次诊断的时候,37%的患者有局部进展,38%的人有远处转移[8],30%~65%的远处转移患者将有骨转移[9],骨转移导致一些致死性的并发症,即所谓的骨相关事件(SREs)[10]括疼痛、病理性骨折、神经根压迫、脊髓压迫、高钙血症,严重影响患者的生活质量,因此对于肺癌骨转移的早期诊断以及及时有效的治疗,对于临床医生是极其重要的而Wnt通路的规范途径是骨诱导性传导通路,Wnt通路的信号传导在整个成骨细胞分化过程中扮演着重要的角色。DKK-1是一种分泌蛋白,是wnt通路规范途径的抑制因子。Lee等[11]报道DKK-1在骨肉瘤组织中高表达,Tian等[12]发现DKK-1表达在
有溶骨损伤的多发性骨髓瘤组织中,Hall等[13]对前列腺癌患者血清DKK-l蛋白进行检测,发现在骨转移前,血清DKK-1蛋白水平升高;在前列腺癌骨转移的患者中,DKK-1蛋白表达水平的高低与患者生存期负相关。但国内外关于DKK-1在肺癌骨转移患者中的表达情况未见相关报道,本研究根据患者入院后骨ECT检查结果以及患者临床表现确诊为肺癌骨转移患者31例其血清中DKK-1浓度为(51±17)ng/ml较无转移51例患者(29±18)ng/ml显著增高,进一步通过ROC曲线计算出在临界点为36.76 ng/ml,其诊断肺癌骨转移敏感度为80.6%,特异度为78.4%,其曲线下面积为0.843,因此可以推测通过检测血清中DKK-1的浓度用于肺癌骨转移的诊断具有重要的临床意义。
大部分肺癌患者在出诊的时候已经处于晚期,因此目前对于肺癌的主要治疗手段为化疗以及靶向治疗[14],Yamabuki等[6]学者通过免疫组织化学的方法检测279例非小细胞肺癌患者细胞内DKK-1的含量,进行生存分析,结果提示DKK-1的表达高低与患者的生存负相关,但肺癌患者在化疗前后血清中DKK-1含量的如何变化,目前研究甚少,本研究首先通过检测肺癌患者第1次及第3次化疗前血清中DKK-1的表达量发现化疗后其浓度为(32±18)ng/ml较化疗前(48 ±21)ng/ml显著降低(P<0.01),同时本研究通过体外的细胞实验同样得出在顺铂作用前后肺癌细胞株其细胞上清中DKK-1表达减少故推测化疗后患者DKK-1浓度的降低可能对患者的预后有积极的意义,同时Yamabuki等[6]进一步研究DKK-1可促进细胞的侵袭能力,尽管其通过与LRP5/6受体而直接抑制Wnt通路,理论上讲应该是抑制肿瘤,但DKK-1可能与细胞表面其他未知的分子结合,而发挥其侵袭能力。
胸腔积液是肺部多种疾病的并发症,大约20%的胸腔积液是恶性肿瘤引起的,其中的50%是原发性肺癌[15]。同时大约20%的肺癌患者最初的临床表现为胸腔积液,目前胸水找脱落癌细胞可作为肺癌伴有胸腔转移以及诊断肺癌的标准,但是由于癌细胞在积液中午组织及器官结构的束缚经过不停地繁殖失去了原来的细胞形态,加上胸水中本身存在大量的淋巴细胞以及间皮细胞,因此胸水诊断肺癌的细胞学检查敏感性很低[16],目前在临床上最常见用于诊断恶性胸腔积液的为CEA[17],但其单独用于诊断肺癌其结果仍不能令人满意,本研究首先检测肺癌血清中DKK-1的浓度,同时检测28例肺癌伴有胸腔积液的患者以及结核性胸膜炎的患者发现,肺癌伴有胸腔积液其胸水中DKK-1浓度为(31±17)ng/ml较结核性胸膜炎患者胸腔积液中DKK-1(14±7)ng/ml,差异有统计学意义(P<0.01)。同时通过ROC曲线计算得出胸水中DKK-1诊断肺癌的最佳临界值为15.42 ng/ml,其敏感度为87.9%,特异度为70%,进一步通过双变量相关分析得出血清中与胸水中DKK-1的浓度正相关(r =0.72,P<0.05),因此可以得出DKK-1在肺癌伴胸腔积液的诊断中具有重要的临床意义,且检测方法简单易行容易被患者接受,因此DKK-1可能成为肺癌的诊断甚至靶向治疗的新的热点。
综上所述,通过肺癌患者血清以及胸腔积液中DKK-1通过ELISA检测较肺部良性病变患者显著增高,且血清以及胸腔积液中DKK-1用于诊断肺癌的敏感性及特异性均较高,肺癌伴有骨转移患者血清中DKK-1含量较无骨转移者显著升高,且血清中DKK-1用于诊断骨转移其敏感性及特异性好,因此DKK-1有望成为肺癌诊断甚至治疗的新靶点。
参考文献
1 Jemal A,Bray F,Center MM,et al.Global cancer statistics.A Cancer Journal for Clinicians,2010,61: 69-90.
2 Jemal A,Siegel R,Xu J,et al.Cancer statistics 2010.CA Cancer J Clin,2010,60: 277-300.
3 UyBico SJ,Wu CC,Suh RD,et al.Lung cancer staging essentials: the new TNM staging system and potentialimagingpitfalls.Radio Graphics,2010,30: 1163-1181.
4 Nelson WJ,Nusse R.Convergence of Wnt,beta-carenin,and cadherin pathways.Science,2004,303: 1483-1487.
5 Luo J,Chen J,Deng ZL,et al.Wnt signaling and human diseases: what are the therapeutic implications.Lab Invest,2007,87: 97-103.
6 Yamabuki T,Takano A,flayamaS,et al.Dikkopf-1as a novel serologic and prognostic biomarker for lung and esophageal carcinomas.Cancer Res,2007,67: 2517-2525.
7 Sheng SL,Huang G,Yu B,et al.Clinical significance and prognostic value of serum Dickkopf-1 concentrations in patients with lung cancer.Clin chem,2009,55: 1656-1664.
8 Koshimune R,Aoe M,Toyooka S,et al.Anti-tumor effect of bisphosphonate (YM529)on non-small cell lung cancer cell lines.Cancer,2007,12: 7-8.
9 Roato I,CeRMS.Bone metastases: When and how lung cancer interacts with bone.World J Clin Oncol,2014,5: 149-155.
10 D’Antonio C,Passaro A,Gori B,et al.Bone and brain metastasis in lung cancer: recent advances in therapeutic strategies.Ther Adv Med Oncol,2014,6: 101-114.
11 Lee N,Smolarz AT,Olson S,et al.A potential role for DKK-1in the pathogenesis of osteosarcoma predicts novel diagnostic and treatment strategies.Br J Canacr,2007,97: 1552-1559.
12 Tian E,Zhan F,Walker R,et al.The role of the wnt signaling antagonist DKK-1in the developmentb of osteolytic lesions in multiple myeloma.N Engl J Med,2003,349: 2483-2494.
13 Hall CL,Daignault SD,Shah RB,et a1.Dickkopf-1 expression increases early in prostate cancer development and decreases during progression from primary tumor to metastasis.Prostate,2008,68: 1396-1404.
14 郭盛虎,殷长甫,史健.肺癌靶向药物及靶向载体研究进展.河北医药,2013,35: 1070-1072.
15 Alatas F,Alatas O,Metintas M,et al.Diagnostic value of CEA,CA15-3,CA19-9,CYFRA21-I,NSE and TSA assay in pleural effusions.Lung Cancer,2001,31: 9-16.
16 Afify AM,Stem R,Michael CW.Differentiation of mesothelioma from adenocarcinoma in serous effusions: the role of hyaluronic acidand CD44 localization.Diagn Cytopathol,2005,32: 145-150.
17 蒋莹,王晓岩,王正.血清CEA、CA-125、CYFRA21-1、NSE联合检测在肺癌诊断中的应用价值.河北医药,2014,36: 697-699.
Expression and clinical significance of DKK-1 in serum and hydrothorax of patients with lung cancer
LI Yinpeng,SHIFang,YANG Jing,et al.
Department of Respiratory Diseases,Petroleum Clinical Medical Collage of Hebei Medical University,Hebei,Langfang 065000,China
【Abstract】ObjectiveTo investigate the expression levels of Dickkopf-1(DKK-1)in serum and hydrothorax of patients with lung cancer,and to explore its clinical diagnostic value.MethodsEighty-two patients with lung cancer (observation group)and 38 patients with pulmonary benign lesion (control group)who were admitted into department of respiratory disease of our hospital from March 2011 to April 2012 were enrolled in the study.The levels of DKK-1 in serum and hydrothorax were detected by enzyme-linked immunosorbent assay (ELISA)for both groups.Results The levels of DKK-1 in observation group were significantly increased,as compared with those in control group (P<0.05).The expression levels of DKK-1 in serum were positively correlated to those in hydrothorax (r =0.72,P<0.05).Both sensitivity and specificity of DKK-1 in diagnosis of lung cancer were higher.The levels of DKK-1 were obviously decreased in patients with NSCLC after two treatment courses by routine chemotherapy (P<0.05).ConclusionDKK-1 is hopeful to become an new target point for diagnosis and treatment of lung cancer
【Key words】DKK-1; lung neoplasms; enzyme-linked immunosorbent assay; bone metastasis
(收稿日期:2014-10-20)
通讯作者:刘政,065000河北省廊坊市,中国石油中心医院呼吸科;
doi:10.3969/j.issn.1002-7386.2015.06.004
【文章编号】1002-7386(2015)06-0815-04
【文献标识码】A
【中图分类号】R 734.2

