18F-FDG PET/CT在食管癌骨转移患者中的临床应用*
马 兰,管 丹,陈晓锋,孙 婧,束永前,刘连科
南京医科大学第一附属医院 肿瘤科(南京 210029)
·临床报道·
18F-FDG PET/CT在食管癌骨转移患者中的临床应用*
马 兰,管 丹,陈晓锋,孙 婧,束永前,刘连科△
南京医科大学第一附属医院 肿瘤科(南京 210029)
目的探讨2-18F-2-脱氧-β-D-葡萄糖(18F-FDG)PET/CT在食管癌骨转移中的诊断价值,并分析18F-FDG PET/CT显像为阳性的食管癌骨转移患者临床特点及预后。方法回顾性分析2009年8月至2014年10月行18F-FDG PET/CT检查的148例食管癌住院患者的临床资料,其中骨转移病灶定义为FDG异常摄取灶在对应CT图像上存在形态学变化。结果27例(18.24%)患者共计178个部位证实为骨转移病灶。基于患者分析,18F-FDG PET/CT诊断食管癌骨转移的灵敏度、特异度和准确度分别为96.30%(26/27)、98.35%(119/121)和97.97%(145/148),高于同机CT 的66.67%(18/27)、76.03%(92/121)和74.32%(110/148),差异有统计学意义(P<0.05)。基于病灶分析,18F-FDG PET/CT鉴别食管癌骨转移病灶的灵敏度、特异度和准确度分别为94.94%(169/178)、97.92%(188/192)和96.49%(357/370),高于同机CT的82.02%(146/178),71.88%(138/192)和76.76%(284/370),差异有统计学意义(P<0.05)。22例骨质有异常改变和5例骨质无异常改变的食管癌骨转移患者半定量指标-标准摄取值最大值(SUVmax)分别为9.45±4.86和5.72±1.56,差异无统计学意义(t=1.673,P=0.107)。27例食管癌骨转移患者中位随访8个月,1和2年累计生存率分别为56.80%和23.30%。结论食管癌骨转移患者预后较差,在临床鉴别诊断中,18F-FDG PET/CT优于同机常规CT扫描,可早期发现食管癌骨转移,有利于制定个体化治疗方案及预后判断。
食管癌;骨转移;PET/CT;生存质量
食管癌是常见的消化系统恶性肿瘤,以淋巴结转移常见,骨转移的发生率相对较低。临床上食管癌骨转移检查方法包括X线片、CT、MRI、核素骨显像,其中核素骨显像是目前常用的骨转移筛查手段,但存在特异性低、假阳性率高等缺点[1]。近年来,2-18F-2-脱氧-β-D-葡萄糖(18F-FDG)PET/CT在肺癌、乳腺癌、前列腺癌等肿瘤骨转移中的诊断及预后价值评价已得到肯定[2],但18F-FDG PET/CT在食管癌骨转移鉴别诊断方面的研究相对缺乏,可能与骨不是食管癌发生转移的常见部位有关。本研究回顾性分析经18F-FDG PET/CT检查的148例食管癌住院患者临床资料,总结食管癌骨转移患者18F-FDG PET/CT影像学特点并探讨其在食管癌骨转移中的应用价值。
1 资料与方法
1.1 临床资料
收集南京医科大学第一附属医院2009年8月至2014年10月因食管癌住院的148例患者临床资料。患者均行18F-FDG PET/CT检查,其中男124例,女24例(男女比例为5.17∶1);年龄48~90岁,中位年龄63岁;初诊47例,复发101例。
1.2 检测方法
采用德国Siemens公司biograph 16HR PET/CT扫描仪,图像分析采用Siemens Wizard 工作站的MSViewer软件。18F-FDG由美国CTI RDS Ⅲ型回旋加速器生产,放化纯度>95%,pH值为5~7。患者检查前禁食6 h以上,控制血糖水平<200 mg/dL。静脉注射示踪剂18F-FDG后静卧休息60~90 min,行全身PET/CT检查,扫描范围从大腿中上段至颅底(6~7个床位),头颅部位单独扫描。体部扫描参数:电压120 kV,采用动态剂量控制扫描模式(Caredose 4D),参考mAs为200,层厚为5.0/1.5 mm;在同一范围用3D模式采集PET图像,1.5~2.0 min/床位,PET/CT图像重建采用有序子集最大期望值迭代法(OS-EM)重建。
1.3 图像分析
由两位高年资PET/CT诊断医师结合定性方法及半定量指标-标准摄取值(standardized uptake value,SUV)独立进行图像分析,结果不一致时,由两位医师共同分析图像,得出结论。同机CT诊断骨转移标准:局部破骨性或成骨性病变,骨皮质破坏,骨髓腔浸润,软组织肿块,骨膜反应,骨膨胀性破坏或肿瘤相关病理性骨折[3]。PET/CT诊断骨转移标准:结合FDG异常摄取病灶与同一部位的同机CT形态学变化,当同机CT图像显示异常,但FDG摄取病灶为骨邻近组织而非骨组织时,为非骨转移;当FDG异常摄取病灶在对应CT图像上存在形态学变化,为骨转移;另外,对于确认为多发骨转移患者,即使其异常FDG摄取部位无明显形态变化,也认为存在骨转移。同时,用同机CT记录骨阳性病变的形态(成骨性、溶骨性)。为方便分析,将全身骨分为颅骨、脊柱、肋骨、骨盆、四肢骨和胸部骨(胸部骨包括胸骨、锁骨、肩胛骨、胸锁关节及肩关节)6个区域[4]。
1.4 统计学方法
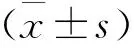
2 结果
2.1 食管癌骨转移患者的临床特点
148例食管癌患者中27(18.24%)例确诊为骨转移,其中男26例(96.30%),女1例(3.70%);病例类型以鳞癌为主(96.30%);初诊8例(29.63%),复发者19例(70.37%),其中复发时间≤1年的12例(63.16%),复发时间>1年的7例(36.84%);食管癌骨转移常表现为无症状(17例,62.96%);除骨转移外,其他转移部位依次为淋巴结25例、肺部7例、肝4例和肾上腺3例。
初诊时18F-FDG PET/CT即提示存在骨转移的8例食管癌患者均为男性,年龄48~83岁,首诊仅有1例表现为肢体麻木,其余7例均无骨转移表现。其中6例患者区域淋巴结为N3,1例为N2,1例无区域淋巴结转移;有4例患者的远处转移仅表现为骨转移;CT显示为骨质破坏6例,骨质无改变2例(表1)。8例患者均未行手术治疗。另外,复发时确诊为食管癌骨转移的患者19例,有15例患者为食管癌根治术后发生骨转移,3例患者为放化疗后发生骨转移,1例患者为放疗后发生骨转移。
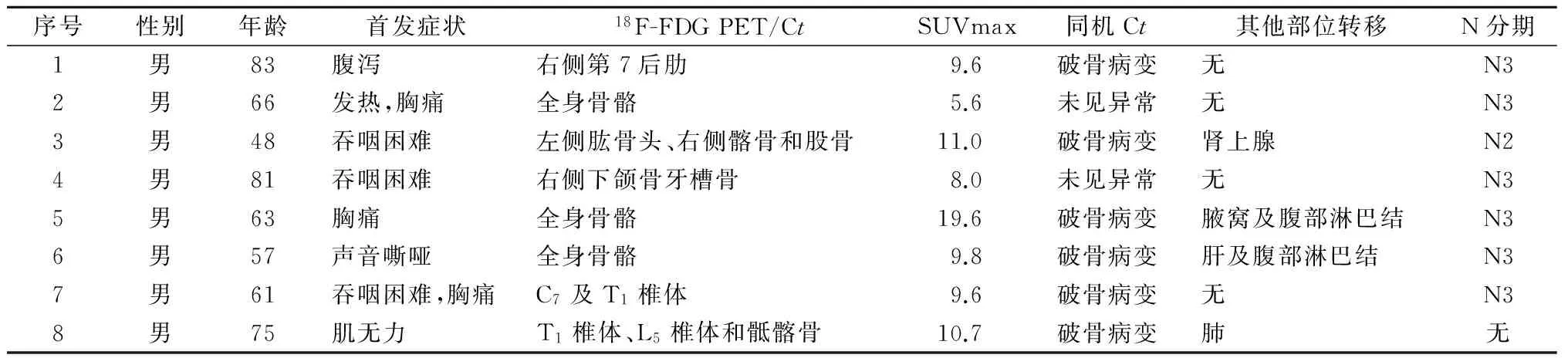
表1 食管癌初诊骨转移患者的临床特点
2.2 食管癌骨转移患者18F-FDG PET/CT显像特点
2.2.1 食管癌骨转移灶的分布 共178个病灶证实为骨转移病灶。27例食管癌患者中有11例患者为1~2个部位骨转移,其中3例为初诊患者;16例患者表现为≥3个部位发生骨转移,其中5例为初诊患者。食管癌骨转移以脊柱最常见,其次为肋骨、骨盆骨、四肢骨、胸部骨及颅骨。脊柱骨中以胸椎骨转移最多见,其次为颈椎骨。四肢骨发生转移的部位均为近端长骨干骺端,肢端骨未发现骨转移病灶(表2)。1例男性典型病例PET/CT显像见图1。
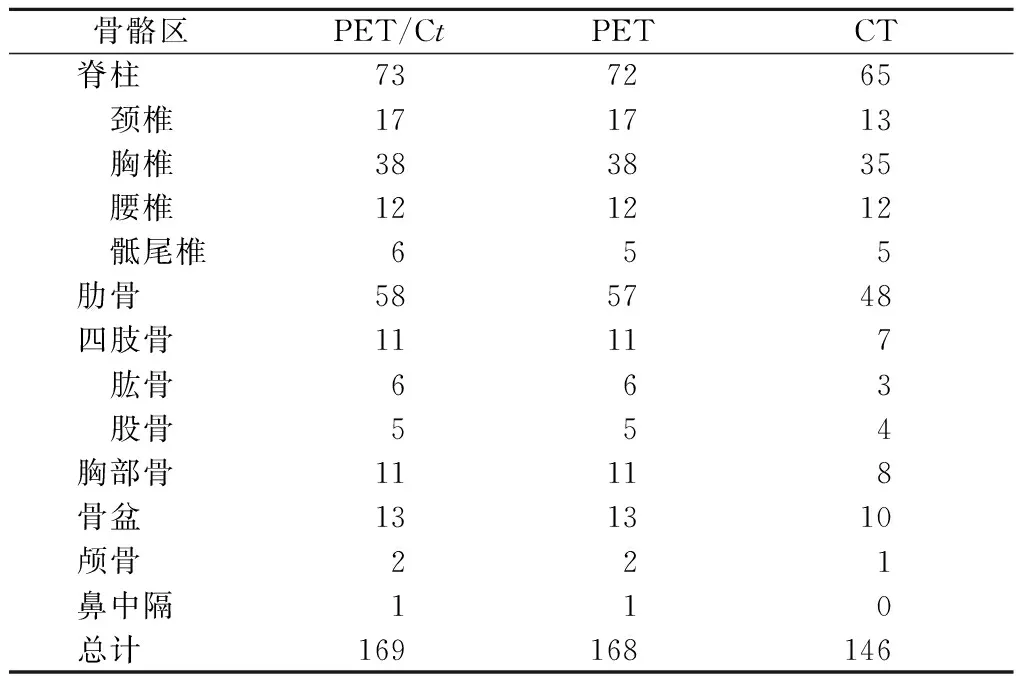
表2 食管癌骨转移病灶分布情况(个)
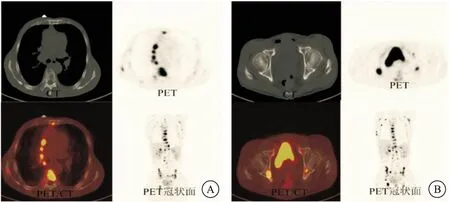
图1 食管癌骨转移患者PET/CT图像
注:A:PET 图像于T7椎体见18F-FDG高摄取病灶,SUV为10.8。CT图像于相应部位见1个破骨性病灶。PET 图像与CT图像融合,病灶匹配良好。B:PET图像于左侧髂骨见18F-FDG高摄取病灶,SUV 为6.7。CT 图像于相应部位未见明显骨密度改变。PET/CT 融合图像于相应部位见1 个18F-FDG 高代谢灶
2.2.218F-FDG PET/CT与同机CT检出率比较 基于患者分析,共27例患者确诊为食管癌骨转移,18F-FDG PET/CT确诊26例,同机CT确诊18例,18F-FDG PET确诊19例。18F-FDG PET/CT诊断食管癌骨转移的灵敏度、特异度和准确度分别为96.30%(26/27),98.35%(119/121)和97.97%(145/148),高于同机CT的66.67%(18/27)、76.03%(92/121)和74.32%(110/148)(χ2=4.90,16.69,5.03;P<0.05)及18F-FDG PET的70.37%(19/27)、83.47%(101/121)和81.08%(120/148)(χ2=4.00,13.14,9.38;P<0.05)。基于病灶分析,共有178个观测区域被诊断为骨转移病灶,18F-FDG PET/CT诊断出169个,同机CT诊断出146个,18F-FDG PET诊断出168个。18F-FDG PET/CT诊断食管癌骨转移病灶的灵敏度、特异度和准确度分别为94.94%(169/178)、97.92%(188/192)和96.49%(357/370),高于同机CT 的82.02%(146/178)、71.88%(138/192)和76.76%(284/370)(χ2=5.28,39.19,11.91;P<0.05)及18F-FDG PET的94.38%(168/178)、60.42%(116/192)和76.76%(284/370)(χ2=4.90,30.32,36.47;P<0.05)。此外,18F-FDG PET扫描10例食管癌患者共12个部位显示肋骨放射性摄取增高,同机CT定位均为第6、7肋骨骨质不连续,结合病史分析,11个部位考虑为手术切口、1个部位考虑为骨折。另外,同机CT扫描21例患者有骨质密度异常改变,而18F-FDG PET扫描未发现摄取异常,结合其他影像学检测结果显示,此21例患者的骨骼病灶均为骨良性疾病。
2.2.3 食管癌骨转移灶的SUVmax值 27例食管癌骨转移患者SUVmax值为8.76±4.65。8例初诊患者原发灶SUVmax值为9.23±2.60,其骨转移灶SUVmax值为10.49±4.06。27例食管癌骨转移患者,CT表现不同的骨转移灶的18F-FDG 摄取存在差异:CT显示骨质异常者22例,SUVmax值为9.45±4.86,CT显示骨质无异常改变者5例,SUVmax值为5.72±1.56,但两者差异无统计学意义(t=1.673,P=0.107)。22例骨质异常者中,19例为溶骨性骨转移,1例为成骨性骨转移,2例为混合性骨转移。
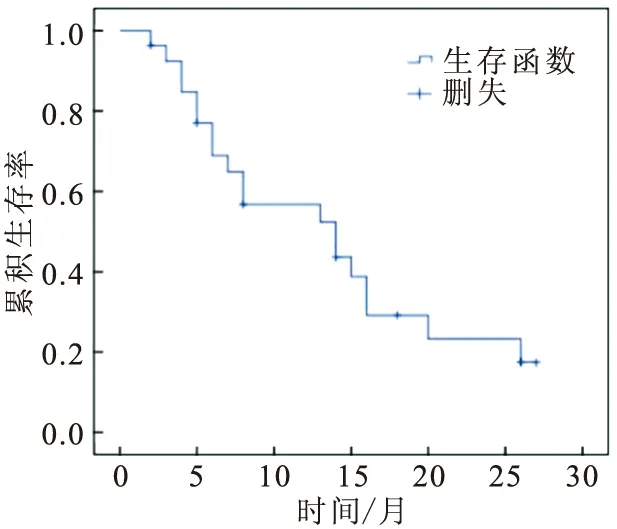
图2 食管癌骨转移患者生存曲线
2.3 生存随访
27例食管癌骨转移患者的中位随访时间为8个月(2~27个月)。截止至2014年10月,17例死亡,8例存活,2例失访。食管癌骨转移患者的1年、2年累积生存率分别为56.80%和23.30%(图2)。其中8例初诊时即为食管癌骨转移的患者,6例死亡,最长生存时间为26个月,最短生存时间为5个月,中位生存时间为15个月。19例复发患者中,11例死亡,最长生存时间为27个月,最短生存时间为2个月,中位生存时间为7个月。
3 讨论
食管癌骨转移的发生率很低,有研究[5]显示,食管鳞癌骨转移的发生率为2%~6%,尸体解剖骨转移发生率为8%~14%,本研究中18F-FDG PET/CT诊断食管癌骨转移阳性率为18.24%(27/148),检出率较高的原因可能是18F-FDG PET/CT检查与常规检查方法不同,其通过一次显像就能发现全身不同部位转移病灶,并可提供18F-FDG PET摄取区域的准确解剖学信息[6]。此外,尸检多注重内脏器官的解剖,而不能切取全身骨,相较18F-FDG PET/CT的全身扫描,可能会漏诊部分骨转移。因此18F-FDG PET/CT诊断骨转移对尸检结果起一定的补充作用[7]。本组27例食管癌骨转移患者中仅3例为治疗后复发,受治疗影响较小,但由于研究为回顾性分析,缺乏随机性,不排除选择性偏倚。
食管癌骨转移报道较少,除了和发生率较低、临床认识不足有关,还可能因为骨转移多见于疾病进展期,患者原发恶性肿瘤分期诊断多为中晚期,增加骨转移这一项并不能改变原有病理分期。然而,本组有8例患者首诊即被诊断为食管癌骨转移,其中有4例患者除骨转移外,无其他远处器官转移病灶,提示食管癌在疾病的早期仍可发生骨转移;因此,食管癌患者术前常规进行18F-FDG PET/CT检查,对明确肿瘤分期,合理制定治疗方案,提高食管癌患者生存质量,具有重要的意义。Kato等[8]采用18F-FDG PET用于食管癌骨转移诊断的研究显示,18F-FDG PET诊断食管癌骨转移的灵敏度、特异度、准确度均稍高于骨扫描,但由于样本量偏小,两者之间无显著性差异。本研究中,18F-FDG PET/CT在诊断食管癌骨转移的灵敏度、特异度及准确度方面均优于单一18F-FDG PET或同机CT,与18F-FDG PET/CT在其他恶性肿瘤骨转移的诊断结果近似[9]。18F-FDG PET/CT是一种集代谢显像与解剖成像于一体的检查方法,可以敏感地显示骨转移病灶,为肿瘤临床分期提供丰富的信息[10];特别是在骨转移的早期,骨密度及骨形态未发生改变之前,CT检查往往难以显示,此时18F-FDG PET可以明确显示骨组织高代谢病灶[3]。本组资料中,单独地对18F-FDG PET及常规CT图像进行分析,结果提示,一部分骨良性病变被误诊为骨转移,也有漏诊骨转移的情况。因此,在食管癌确诊后,建议有条件者尽早安排18F-FDG PET/CT检查,并应用于定期随访,以便早期发现骨转移,及时调整治疗方案。
食管癌骨转移最常见部位为脊柱,以多发骨转移为主,这些临床特点与肺癌及乳腺癌骨转移相似[11-12]。本组27例食管癌骨转移患者中骨痛发生率为29.63%。而郭庆志等[11]发现322例非小细胞肺癌骨转移患者中,188例患者有严重骨痛。张桂香等[12]发现约50%乳腺癌骨转移患者存在骨痛。由此可见,食管癌骨转移患者骨痛的发生率较肺癌及乳腺癌低,若仅以骨痛作为骨转移的指征,容易漏诊。本研究结果还提示,在确诊食管癌1年内骨转移的发生率较高,并且有8例患者在首诊时经18F-FDG PET/CT检查即确诊为骨转移,占全部骨转移病例的29.63%。此外,食管癌是常见的消化道恶性肿瘤,其两年生存率为30.00%~56.20%[13-14]。本研究中,患者1年和2年累积生存率分别为56.80%和23.30%,虽然样本量偏小,但仍提示食管癌骨转移预后很差。鉴于上述观点,建议食管癌确诊后,可尽早行影像学检查,筛查是否有骨转移,有条件者尽早行18F-FDG PET/CT检查,以便制定个体化治疗方案及判断预后。
[1] Iagaru A,Mittra E,Dick DW,etal.Prospective evaluation of 99mTc MDP scintigraphy,18F-NaF PET/CT,and18F-FDG PET/CT for detection of skeletal metastases[J].Molecular Imaging and Biology,2012,14(2):252-259.
[2] Damle NA,Bal C,Bandopadhyaya GP,etal.The role of18F-fluoride PET-CT in the detection of bone metastases in patients with breast,lung and prostate carcinoma:a comparison with FDG PET/CT and 99mTc-MDP bone scan[J].Japanese Journal of Radiology,2013,31(4):262-269.
[3] Evangelista L,Panunzio A,Polverosi R,etal.Early bone marrow metastasis detection:the additional value of FDG-PET/CT vs.CT imaging[J].Biomedicine & Pharmacothe-rapy,2012,66(6):448-453.
[4] Takenaka D,Ohno Y,Matsumoto K,etal.Detection of bone metastases in non-small cell lung cancer patients:Comparison of whole-body diffusion-weighted imaging(DWI),whole-body MR imaging without and with DWI,whole-body FDG-PET/CT,and bone scintigraphy[J].J Magn Reson Imaging,2009,30(2):298-308.
[5] Nakajima Y,Ohta S,Okada T,etal.Osteoplastic bone metastasis in esophageal squamous cell cancer:report of a case[J].Surgery Today,2012,42(4):376-381.
[6] 陈伟华,冷吉艳.18F-FDG PET-CT 显像对恶性淋巴瘤诊断和分期中的临床应用价值[J].中国实验诊断学,2010,14(5):682-684.
[7] 王广丽,杨涛,张成琪,等.18F-FDG PET-CT 在非小细胞肺癌骨转移诊断中的应用[J].临床放射学杂志,2011,30(3):350-352.
[8] Kato H,Miyazaki T,Nakajima M,etal.Comparison between whole-body positron emission tomography and bone scintigraphy in evaluating bony metastases of esophageal carcinomas[J].Anticancer Research,2005,25(6):4439-4444.
[9] 蔡亮,张伟,陈跃,等.18F-FDG PET/CT 与 MRI 在评价鼻咽癌颅底骨转移中的价值[J].重庆医学,2011,40(8):771-773.
[10] Boellaard R,O′Doherty MJ,Weber WA,etal.FDG PET and PET/CT:EANM procedure guidelines for tumour PET imaging:version 1.0[J].European Journal of Nuclear Medic-ine and Mmolecular Imaging,2010,37(1):181-200.
[11] 郭庆志,吴梅娜,安彤同,等.322 例非小细胞肺癌骨转移临床特点及治疗的回顾性分析[J].中国肺癌杂志,2014,17(9):656-662.
[12] 张桂香,刘新兰,赵艳娇.乳腺癌骨转移临床特点及其预后影响因素的研究[J].宁夏医科大学学报,2013,35(9):987-990.
[13] Schweigert M,Dubecz A,Stein HJ.Oesophageal cancer-an overview[J].Nat Rev Gastroenterol Hepatol,2013,10(4):230-244.
[14] Gertler R,Stein HJ,Langer R,etal.Long-term outcome of 2920 patients with cancers of the esophagus and esophagogastric junction:evaluation of the New Union Internationale Contre le Cancer/American Joint Cancer Committee staging system[J].Annals of surgery,2011,253(4):689-698.
Clinical Application of18F-FDG PET/CT in Diagnosis of Bone Metastases in Patients with Esophageal Carcinoma
MaLan,GuanDan,ChenXiaofeng,SunJing,ShuYongqian,LiuLianke△
.DepartmentofOncology,theFirstAffiliatedHospitalofNanjingMedicalUniversity,Nanjing210029,China
ObjectiveTo investigate the value of18F-FDG PET/CT in diagnosing esophageal carcinoma patients with bone metastases and analyze the characteristics and prognosis of the patients with18F-FDG PET/CT-positive bone metastases.Methods One hundred and forty-eight inpatients with esophageal carcinoma detected by18F-FDG PET/CT from August 2009 to October 2014 were collected,and their clinical data and survival time were retrospectively analyzed.Results A total of 27 patients(18.24%)with 178 lesions were diagnosed.In terms of patients,the sensitivity,specificity,and accuracy of hybrid CT for detecting bone metastases were 66.67%(18/27),76.03%(92/121),74.32%(110/148)and18F-FDG PET/CT were 96.30%(26/27),98.35%(119/121),97.97%(145/148),respectively(χ2=4.90,16.69,5.03,allP<0.05).In terms of lesions,the sensitivity,specificity,and accuracy of hybrid CT for detecting bone metastases were 82.02%(146/178),71.88%(138/192),76.76%(284/370)and18F-FDG PET/CT were 94.94%(169/178),97.92%(188/192),96.49%(357/370),respectively(χ2=5.28,39.19,11.91,allP<0.05).The mean maximum standardized uptake values(SUVmax)of abnormal bone and normal bone in 22 cases with bone changes and 5 cases without bone changes were 9.45±4.86 and 5.72±1.56,respectively(t=1.673,P=0.107).The median follow-up time was 8 months,and the 1-and 2-year cumulative survival rates were 56.80% and 23.30%,respectively.Conclusion18F-FDG PET/CT can be used for diagnosing esophageal carcinoma with bone metastases,which is more sensitive than the routine CT for early detection of bone metastases and more useful for prognosis assessment and individual treatment placement.
Esophageal carcinoma;Bone metastases;PET/CT;Quality of life
http://www.cnki.net/kcms/detail/51.1705.R.20150522.1057.003.html
10.3969/j.issn.1674-2257.2015.03.011
江苏省临床医学科技专项资金(No:BL2012008);中国高校医学期刊临床专项资金(No:11520566)
R735.1;R730.44
B
△通信作者:刘连科,E-mail:liulianke@csco.org.cn

