α-细辛醚诱导人食管癌细胞系Eca-109细胞凋亡及机制的研究*
周新强,韩倩倩,朱艳琴
(1.河南中医学院基础医学院2012级硕士研究生,河南 郑州 450046; 2.河南中医学院基础医学院,河南 郑州 450008)
·实验研究·
α-细辛醚诱导人食管癌细胞系Eca-109细胞凋亡及机制的研究*
周新强1,韩倩倩2,朱艳琴2
(1.河南中医学院基础医学院2012级硕士研究生,河南 郑州 450046; 2.河南中医学院基础医学院,河南 郑州 450008)
目的:研究α-细辛醚诱导人食管癌细胞Eca-109凋亡及其机制。方法:MTT法检测α-细辛醚对Eca-109细胞活力影响;AO/EB荧光染色观察细胞形态;流式细胞分析检测α-细辛醚对Eca-109细胞的凋亡诱导作用;蛋白质印迹法检测诱导凋亡相关蛋白的相对表达量。结果:MTT检测表明,α-细辛醚能够抑制Eca-109细胞的增殖,且随α-细辛醚质量分数的增加和作用时间的延长而增强(P<0.05)。AO/EB染色可以看到,经α-细辛醚作用的细胞的细胞核呈现固缩现象,被染成绿色或橘红色。流式细胞仪检测显示,α-细辛醚作用24 h后,其凋亡指数随药物质量分数的升高而相应增加,实验组凋亡指数和阴性对照组对比,差别有统计学意义(P<0.05)。蛋白印迹法检测结果表明,α-细辛醚作用24 h后,凋亡相关蛋白caspase-3和caspase-9的相对表达量上调,与阴性对照组对比,差别有统计学意义(P<0.05)。结论:α-细辛醚能促进Eca-109细胞的凋亡,其机制可能与上调caspase-3和caspase-9的表达有关。
食管癌;α-细辛醚;细胞凋亡
在世界大范围内居恶性肿瘤病死率第7位[1]的食管癌在中国的发病率居第4位,严重威胁了人类的健康。目前食管癌发病的分子机制尚没有标准阐述,临床治疗上仍找不到有效的靶向分子,因此,发现与其发生、发展联系密切的基因异常变化,深入研讨食管癌的发病机制,开展新基因的治疗策略显得尤为重要。α-细辛醚是天南星科植物石菖蒲挥发油的主要成分,挥发油是石菖蒲镇静、催眠、抗惊厥作用的主要有效部位。近年来,关于α-细辛醚的抗肿瘤作用有少量报道[2-3],本研究主要研究α-细辛醚促Eca-109细胞凋亡作用,进而探讨α-细辛醚诱导Eca-109凋亡的可能作用机制。
1 材料与方法
1.1 癌株来源
人食管癌细胞系Eca-109购于南京凯基生物科技发展有限公司。
1.2 药品、试剂与仪器
α-细辛醚,购自山西普德药业股份有限公司,批号HZ20051775。RPMI1640培养基,购于Thermo公司,批号MJZ1225;胎牛血清,购自杭州四季青公司,批号140511;四甲基偶氮唑盐(Methyl Thiazolyl Tetrazolium,MTT),Sigma公司产品,批号0793;二甲基亚砜(DMSO)、AO/EB,均为Solarbio公司产品,批号依次是D8307,AB5468;Annexin V-FITC/PI细胞凋亡检测试剂盒,BD公司产品,批号556547;caspase-3(批号1087-1)、caspase-9(批号1023-1)和羊抗兔HRP-IgG抗体(批号1058-1),均购自Abcam公司;β-ACTIN,购自博士的公司,批号BA2305。IX73型荧光倒置显微,Olympus公司产品;C6型流式细胞仪,Becton Dickinson公司产品;UNIVERSAL型免疫印迹设备,Bio-Rad公司产品。
1.3 细胞培养
人食管癌109细胞株,用含体积分数100 ml/L胎牛血清的RPMI1640培养基在37 ℃、50 mL/L CO2、相对饱和湿度的培养箱中培养。
1.4 检测指标
1.4.1 Eca-109细胞活力
采用MTT细胞活力实验。取对数生长期的109细胞,以每孔200 μL(5×103个/孔)接种于96孔板上,培养24 h待细胞贴壁后,加入不同质量分数(100, 50, 25 mg/L)的α-细辛醚,每孔200 μL;阴性对照组加入相同体积的完全培养基。每组设5个复孔,分别培养12h、24 h、36 h和48 h。每个时间点后加入MTT(5 g/L、20 μL),继续孵育4h;小心吸取上清液,每孔加进150 μL的DMSO,平板振动器振摇15 min;通过波长490 nm的酶联免疫检测仪测各孔的吸光值,计算体外增殖抑制率。实验重复3次。
1.4.2 细胞的凋亡形态
采用AO/EB法观察。收集以质量分数25 mg/L 和50 mg/L α-细辛醚作用24 h、48h的Eca-109细胞及阴性对照细胞;PBS洗涤细胞2遍,吸去上清;留少量细胞沉淀,加50 μL PBS重悬;AO、EB染液等体积混匀;吸取细胞悬液25 μL,加进1 μL的AO/EB染液混匀;吸混合液10μL,滴加到载玻片,盖上盖玻片,在510 nm激发光下用倒置荧光显微镜观察细胞形态。
1.4.3 细胞凋亡
采用流式细胞仪检测。细胞经传代后接种于培养瓶中,孵育细胞至贴壁后,取出上清液。根据实验再分别加入完全培养基和α-细辛醚,继续孵育24 h。收集细胞,制备细胞悬液,加进预冷的700 mL/L 乙醇,轻吹悬细胞之后于4 ℃冰箱过夜。取单细胞悬液1×106/mL,加入3 mL PBS洗涤两遍,加入500 μL 的Binding Buffer悬浮细胞,加入5 μL的Annexin V-FITC染液混匀,加入5 μL PI染液,混匀;避光室温孵育5~15 min,上机检测。
1.4.4 凋亡相关蛋白相对表达量
收集经处理的细胞,提取细胞总蛋白,采用BCA法测蛋白浓度。制备质量分数120 g/L 聚丙烯酰胺分离胶和50 g/L 的浓缩胶,将经过处理的样品和上样缓冲液以每空15 μL的体积加入上样孔;以一定的电压电泳,用半干转法将蛋白由胶转至NC膜上;经过脱脂奶粉的封闭、一抗和二抗的孵育,加入ECL发光液孵育3 min;暗室压片进行曝光,凝胶成像仪扫片出结果。
1.5 统计学方法
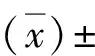
2 结 果
2.1 各组Eca-109细胞活力对比
α-细辛醚在25~100 mg/L范围内,各药物分别作用细胞12 h、24 h、36 h、48 h,均能抑制Eca-109细胞增殖,且增殖抑制率从17.04%逐渐提高至80.68%,且随着药物质量分数的增加和作用时间的延长,细胞的增殖抑制率呈增高趋势。表明:α-细辛醚对Eca-109细胞的增殖抑制具有时间-药物质量分数依赖性。见表1。
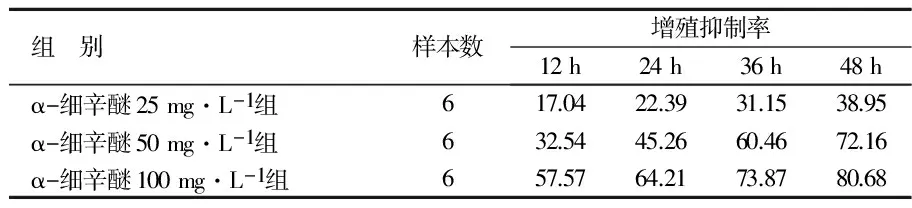
表1 各组Eca-109体外增殖抑制率对比 %
2.2 各组Eca-109细胞凋亡形态对比
倒置显微镜下:阴性对照组细胞贴壁状态良好,细胞分布密集,形态饱满、规则,呈圆形及椭圆形,细胞边界清楚。α-细辛醚各剂量组可见明显的细胞形态改变,随着药物质量分数的提高,细胞形态变化更加明显,圆细胞的数目明显增多,原本贴壁生长的细胞最后变成悬浮状态,体积变小,细胞的间隙变大。荧光显微镜下:阴性对照组染色质被染成绿色,呈正常结构。经α-细辛醚处理的一部分细胞的核染色质呈凝结状,被染成绿色或橘红色,为早期凋亡和晚期凋亡。见图1、图2。

图1 倒置显微镜下各组Eca-109细胞形态(×100)

图2 AO/EB染色后荧光显微镜下各组Eca-109细胞形态(×200)
2.3 各组Eca-109细胞凋亡指数对比
α-细辛醚25,50 mg/L组平均凋亡指数依次为(2.93±0.05)和(5.02±0.04),与阴性对照组对比,差别有统计学意义(P<0.01)。α-细辛醚两个剂量组之间的Eca-109细胞凋亡指数对比,差别有统计学意义(P<0.01)。见表2。
表2 各组Eca-109细胞凋亡指数对比

表2 各组Eca-109细胞凋亡指数对比
组 别样本数凋亡指数阴性对照组30.602±0.06α-细辛醚25mg·L-1组32.93±0.05∗∗α-细辛醚50mg·L-1组35.02±0.04∗∗##
注:与阴性对照组对比,**P<0.01;与α-细辛醚25 mg·L-1组对比,##P<0.01。
2.4 各组Eca-109细胞内24 h caspase-3、caspase-9相对表达量对比
α-细辛醚25,50mg/L组Eca-109细胞内caspase-3、caspase-9相对表达量均随药物质量分数增加而增高,与阴性对照组对比,差别均有统计学意义(P<0.05或P<0.01)。见表3。
表3 各组Eca-109细胞24h caspase-3、caspase-9相对表达量对比

表3 各组Eca-109细胞24h caspase-3、caspase-9相对表达量对比
组 别样本数caspase⁃3/β⁃actincaspase⁃9/β⁃actin阴性对照组30.664±0.0040.364±0.003α-细辛醚25mg·L-1组30.896±0.006∗0.510±0.003∗∗α-细辛醚50mg·L-1组31.087±0.007∗0.616±0.005∗∗
注:与阴性对照组对比,*P<0.05,**P<0.01。
3 讨 论
中西医结合防治肿瘤是近几年肿瘤研究的热点之一[4-5]。通过高效、低毒的中药及其有效成分的筛选、从中发现中西医抗肿瘤治疗结合点、探索研究抗肿瘤的分子机制是当前重点发展方向。α-细辛醚是中药石菖蒲的主要活性成分之一,存在于石菖蒲挥发油中,具有多种生物学效应,对神经系统[6]、循环系统[7]、呼吸系统[8]、消化系统的影响和抗氧化作用均已得到证实,尤其侧重于支气管哮喘[9-10]、支气管肺炎[11-12]、降血脂[13]等方面的作用。
细胞凋亡是细胞的调节因子在一系列的内源性基因的作用下引发的自然或物理的死亡过程,是由一系列因素的调节和控制下的“瀑布式”的反应过程。根据细胞启动信号转导的不同部分,可将其分为死亡受体通路、内质网通路和线粒体通路3条不同介导的凋亡通路[14]。半胱氨酸天冬氨酸蛋白酶(caspase)家族是线粒体凋亡途径的重要内容,caspase家族分为两大类,一是上游的起动者,有caspase-8,10 等;另一种是包括下游执行的Caspase-3,6,7[15]。细胞色素C从凋亡细胞的线粒体内释放,凋亡蛋白酶活化因子和其结合,进而活化caspase-9的前体[16],随后激活Caspase-3蛋白前体,紧接着通过DNA修复酶以及具有结构、信号或转录功能的蛋白质激活而裂解,从而导致细胞的调亡[17]。
本研究中,α-细辛醚对Eca-109细胞具有明显的抑制作用,其作用与剂量和作用时间呈正相关。α-细辛醚作用24 h和48 h后荧光显微镜下可见明显的凋亡形态;且其作用于Eca-109细胞后细胞的凋亡率增加,凋亡相关蛋白( caspase-3、 caspase-9)的表达量亦增加,可以推测:α-细辛醚处理109细胞后,细胞色素c的释放,和凋亡蛋白酶活化因子的结合,活化了caspase-9的前体,随后激活了casease-3前体变为casease-3,紧接着通过DNA修复酶以及具有结构、信号或转录功能的蛋白质激活而裂解,从而导致细胞的调亡,完成了一次典型的线粒体途径凋亡。
综上所述,α-细辛醚对人食管癌细胞系Eca-109促凋亡作用明显,并具有时间-剂量关系,该作用可能是通过经典的线粒体凋亡途径实现的。
[1]Parkin DM, Pisani P, Ferlay J.Estimates of the worldwide incidence of 25 major cancers in 1990[J].Int J Cancer, 1999,80(6): 827-841
[2]杜毅,周超凡.石菖蒲的效用与现代研究的关系[J].中国中药杂志,1993,18(4):24.
[3]鲁光华,李玉洁,朱艳琴.α-细辛醚对人食管癌Ec-109 细胞的体外抑制作用初探[J].中国药理学通报,2012,28(1):148.
[4]刘辉,郭月秋.基于中药免疫组学对中药方剂免疫调节作用的评估[J].中国中药杂志,2008,33(24):2958-2960.
[5]Chen QX, Miao JK, Li C,et al.Anticonvulsant activity of acute and chronic treatment with a-asarone from Acorus gramineus in seizure models[J].Biol Pharm Bull,2013,36(1):23-30.
[6]Huang C,Li WG,Zhang XB,et al.α-asarone from Acorus gramineus alleviates epilepsy by modulating A-type GABA receptors[J].Neuropharmacology,2013,65:1-11.
[7]兰烨荣,刘素香,张铁军,等.细辛醚的研究进展[J].现代药物与临床,2013,2(28):252-257.
[8]王睿,费洪新,李晓明,等.石菖蒲的化学成分及药理作用研究进展[J].中华中医药学刊,2013,7(31):1606-1610.
[9]向海军,葛必胜,刘花香,等.α-细辛脑治疗婴幼儿毛细支气管炎的临床观察[J].儿科药学杂志,2010,16(3):27-29.
[10]姚丹,陈卫东.α-细辛脑的临床应用进展[J].安徽医药,2005,9(7):537-539.
[11]徐乃明,陶左荷,郝志勇.注射用细辛脑治疗慢性阻塞性肺疾病急性加重期的疗效观察[J].中西医结合心脑血管病杂志,2010,8(6):741.
[12]张青,马伟从,李慧,等.细辛脑注射液治疗呼吸系统疾病的Meta分析[J].中国循证医学杂志,2010,10(10): 1174-1181.
[13]吴启端,袁德俊,王绮雯等.石菖蒲挥发油对心肌细胞形态学及细胞活力的影响[J].中药材,2009,32(2):242.
[14]Wu Y,Wang D,Wang X,et al.Caspase 3 is activated through caspase 8 instead of caspase 9 during H2O2-induced apoptosis in HeLa cells[J].Cell Physiol Biochem,2011,27(5):539-546.
[15]Modjtahedi N,Giordanetto F,Madeo F,et al.Apoptosis-inducing factor:vital and lethal[J].Trends Cell Biol,2006,16(5):264-272.
[16]刘春燕.Survivin基因在阿糖胞苷诱导K562细胞凋亡机制中的研究[D].甘肃:兰州大学,2013.
[17]Modjtahedi N,Giordanetto F,Madeo F,et al.Apoptosis-inducing factor:vital and lethal[J].Trends Cell Biol,2006,16(5):264-272.
(编辑 陶 珠)
1001-6910(2015)03-0061-05
R735.1
B
10.3969/j.issn.1001-6910.2015.03.30
朱艳琴,医学硕士,教授,硕士生导师,jc.zyqin@163.com;
郑州市重大科技攻关攻关项目(131PCXTD520);郑州市创新科技团队(121PCXTD520)
2014-10-13;
2015-01-09

