人参牡丹胶囊的提取工艺研究*
李向阳,周志敏,张留记
(1.河南省食品药品检验所,河南 郑州 450003; 2.河南中医学院,河南 郑州 450046;3.河南省中医药研究院,河南 郑州 450004)
·药学研究·
人参牡丹胶囊的提取工艺研究*
李向阳1,周志敏2,张留记3
(1.河南省食品药品检验所,河南 郑州 450003; 2.河南中医学院,河南 郑州 450046;3.河南省中医药研究院,河南 郑州 450004)
目的:优选人参牡丹胶囊提取工艺的最佳条件。方法:采用正交试验法L9(34),对影响人参牡丹胶囊提取工艺的主要因素进行了研究。结果:优选出人参牡丹胶囊的最佳提取工艺为水煎提取最佳工艺为8倍量水,煎煮3次,每次2 h。结论:该提取工艺合理可行。
人参牡丹胶囊;人参;牡丹皮;提取工艺;正交试验;人参皂苷;芍药苷
人参牡丹胶囊是按中医益气活血理论配伍而成的创新药物,处方由人参和牡丹皮组成,具有益气通络、活血化瘀的功效,可用于气虚血瘀型中风病的治疗。据报道,人参中主要含有多种皂苷、挥发油、多糖、有机酸、蛋白质、甾醇及其苷、多肽、黄酮等成分[1],其中人参总皂苷是人参的主要有效成分。目前已从人参中分离提取出了人参皂苷Rb1、Re、Rg1、Rg3等40多种皂苷单体[2],人参总皂苷及人参皂苷Rb1、Rb3和Rg1等单体具有保护脑缺血和免疫调节作用[3-5]。牡丹皮中主要含有芍药苷、牡丹皮原苷等多种单萜及苷类成分、挥发性成分及甾醇生物碱等[6]。牡丹皮中的苷类成分具有镇痛、抗炎、免疫调节、抗血栓等多种药理活性[7],其中芍药苷可改善局灶性脑缺血模型大鼠的神经行为学、脑组织含水量、组织病理学改变和血脑屏障通透性,显著增加大脑局部血流量,抗神经元凋亡[8-9]。考虑到人参和牡丹皮主要成分多为水溶性成分,拟采取水煎煮的提取方法。本研究采用正交实验对工艺参数进行了优化和筛选,确定了最佳工艺参数。
1 药品、试剂与仪器
人参和牡丹皮饮片,均购自张仲景大药房。芍药苷对照品(批号110736-201035)、人参皂苷Rd对照品(批号111818-201001)、人参皂苷Rg1对照品(批号0703-200016)、人参皂苷Re对照品(批号110754-200320)、人参皂苷Rb1对照品(批号110704-200318),均为含量测定用对照品,由中国药品生物制品检定所提供; 甲醇、乙腈为色谱纯,德国Merck.公司产品;水为自制重蒸水;其余试剂均为分析纯。美国Waters高效液相色谱仪(2695溶剂管理系统,2996二极管阵列检测器,Waters柱温箱,Empower II色谱工作站软件),美国Waters公司产品;ODS C18色谱柱(4.6 mm×150 mm,5 μm)日本岛津公司产品;LIBROR L-160DTP型万分之一分析天平,日本岛津公司产品;METTLER AE240型十万分之一分析天平,产地瑞士。
2 方法与结果
2.1 正交试验因素水平的确定
拟对煎煮时间、煎煮次数、加水量等主要影响因素进行考察,选用L9(34)正交实验表进行设计,每个因素选取3个水平,设定的因素水平表见表1。

表1 煎煮试验的因素水平表
2.2 实验设计和方法
2.2.1 正交实验设计
按处方比例,平行称取9份人参和牡丹皮药材,按表3正交试验表的试验条件分别进行煎煮,煎液浓缩,定容至100 mL量瓶中,制成1~9号样品液。煎煮试验的正交实验安排和实验方法见表3。
2.2.2 人参皂苷Rg1、Re、Rb1和Rd的含量测定
色谱条件与系统适应性试验: SHIMADZU ODS C18色谱柱(4.6 mm×150 mm,5μm);以乙腈为流动相A,以水为流动相B,梯度洗脱(0—35 min,19%A;35—45 min,19%A→29%A;45—55 min,29%A;55—85 min,29%A→40%A;85—95 min,40%A→70%A;95—100 min,70%A),流速1.0 mL/min;检测波长203 nm;柱温35 ℃。理论塔板数按人参皂苷Rg1峰计算应不少于3 000。
对照品溶液的制备:精密称取人参皂苷Rg12.58 mg,人参皂苷Re 1.97 mg,人参皂苷Rb12.67 mg,人参皂苷Rd 3.57 mg,至10 mL量瓶中,加甲醇溶解并定容至刻度,摇匀,制成混合对照品溶液。
供试品溶液的制备:精密吸取1~9号样品溶液各10 mL,置分液漏斗中,用水饱和的正丁醇振摇提取4次,每次10 mL,合并正丁醇提取液,用20 mL氨试液洗涤,弃去氨水层,分取正丁醇液,水浴蒸干,残渣加甲醇溶解并定容至25 mL量瓶中,作为1~9号供试品溶液。
标准曲线的绘制:分别精密吸取上述混合对照品溶液2,10,15,20,30 μL,注入液相色谱仪,测定。以进样量X(μg)为横坐标,峰面积Y为纵坐标,进行线性回归,回归方程线性范围及相关系数(r)见表2。

表2 回归方程、线性关系及相关系数
测定法:分别精密吸取上述混合对照品溶液10 μL,1~9号正交试验供试品溶液各5 μL,注入液相色谱仪,测定供试品色谱中人参皂苷Rg1、Re、Rb1和Rd的含量,计算出1~9号样品液中人参皂苷的总量,见下表3。对人参总皂苷的统计结果进行方差分析,结果见表4。有关人参皂苷测定对照品和供试品的HPLC色谱图见图1。
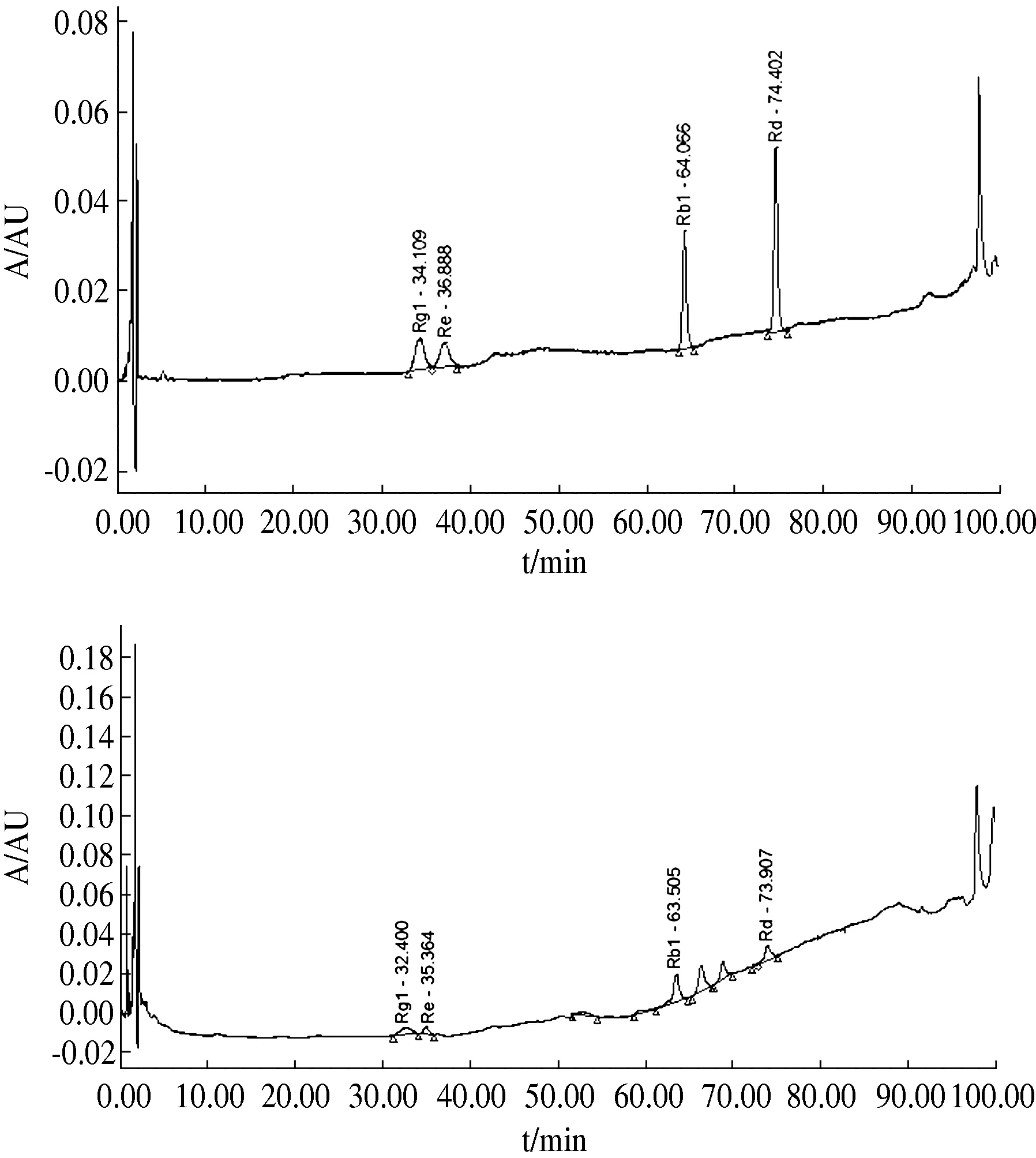
A对照品;B供试品图1 正交试验人参皂苷Rg1、Re、Rb1、Rd测定HPLC色谱图
2.2.3 芍药苷的含量测定
色谱条件与系统适应性试验: SHIMADZU ODS C18色谱柱(4.6 mm×150 mm,5 μm),流动相为0.5 mL/L磷酸水溶液—甲醇(76∶24),流速1.0 mL/min,检测波长230 nm,柱温35 ℃,理论塔板数按芍药苷峰计算应不少于2 000。
对照品溶液的制备:精密称取芍药苷1.42 mg,至25 mL容量瓶中,加甲醇溶解并定容至刻度,摇匀,制成每毫升含0.056 8 mg的溶液,作为对照品溶液。
供试品溶液的制备:精密吸取1~9号样品的上清液各5mL,置三角瓶中,缓缓滴加无水乙醇15 mL,振摇,静置约2年 h,滤过,取续滤液作为1~9号供试品溶液。
标准曲线的绘制:分别精密吸取上述对照品溶液5,10,15,20,25 μL,注入液相色谱仪,测定。以进样量X(μg)为横坐标,峰面积Y为纵坐标,进行线性回归,回归方程线性范围及相关系数(r)见表2。
测定法:分别精密吸取上述对照品溶液10 μL,1~9号正交试验供试品溶液各5 μL,注入液相色谱仪,测定供试品色谱中芍药苷的含量,计算出1~9号样品液中芍药苷的总量,见下表3。对统计结果进行方差分析,结果见表4。有关芍药苷测定对照品和供试品的HPLC色谱图分别见图2。
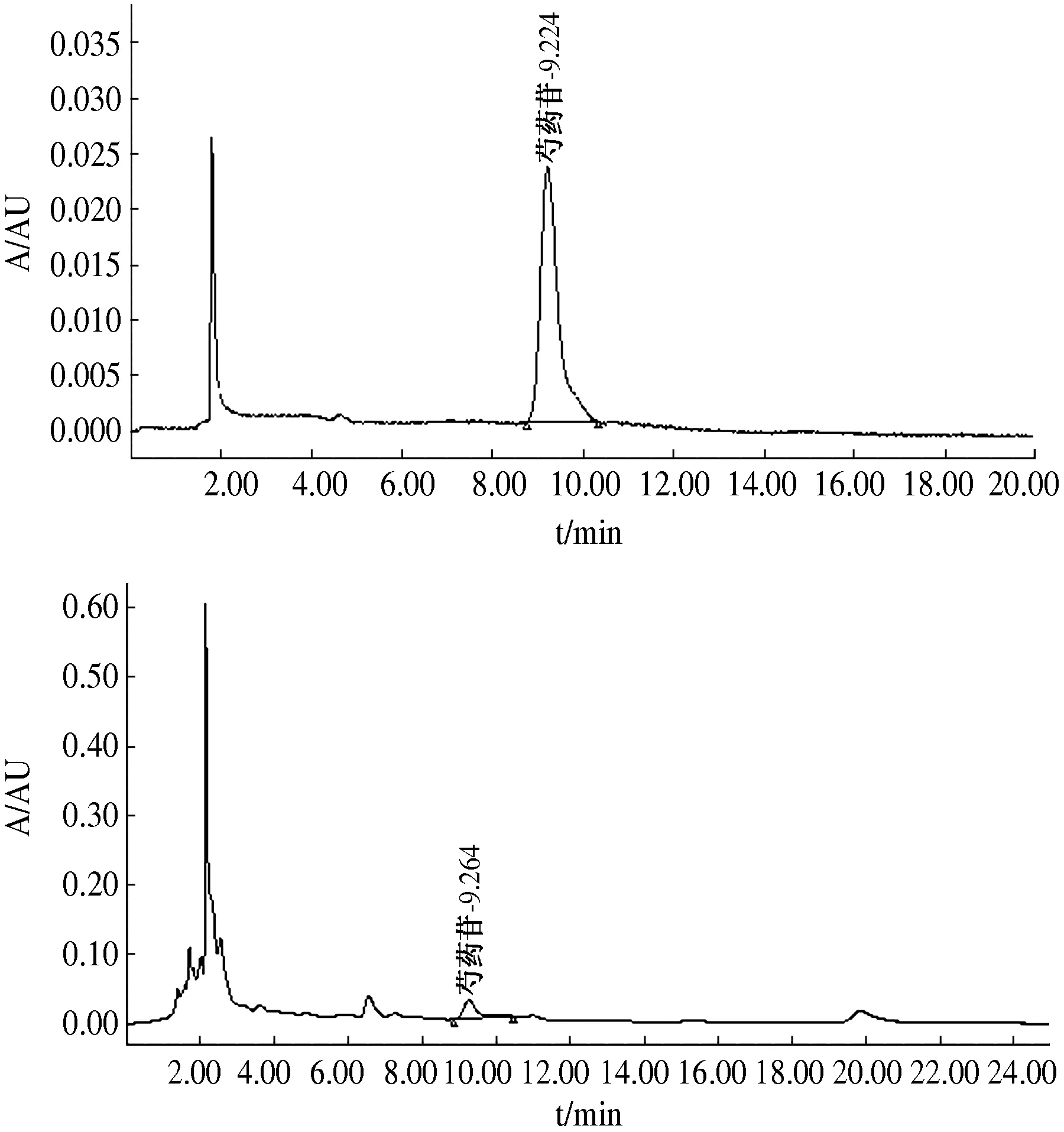
A对照品;B供试品图2 正交试验芍药苷测定HPLC色谱图
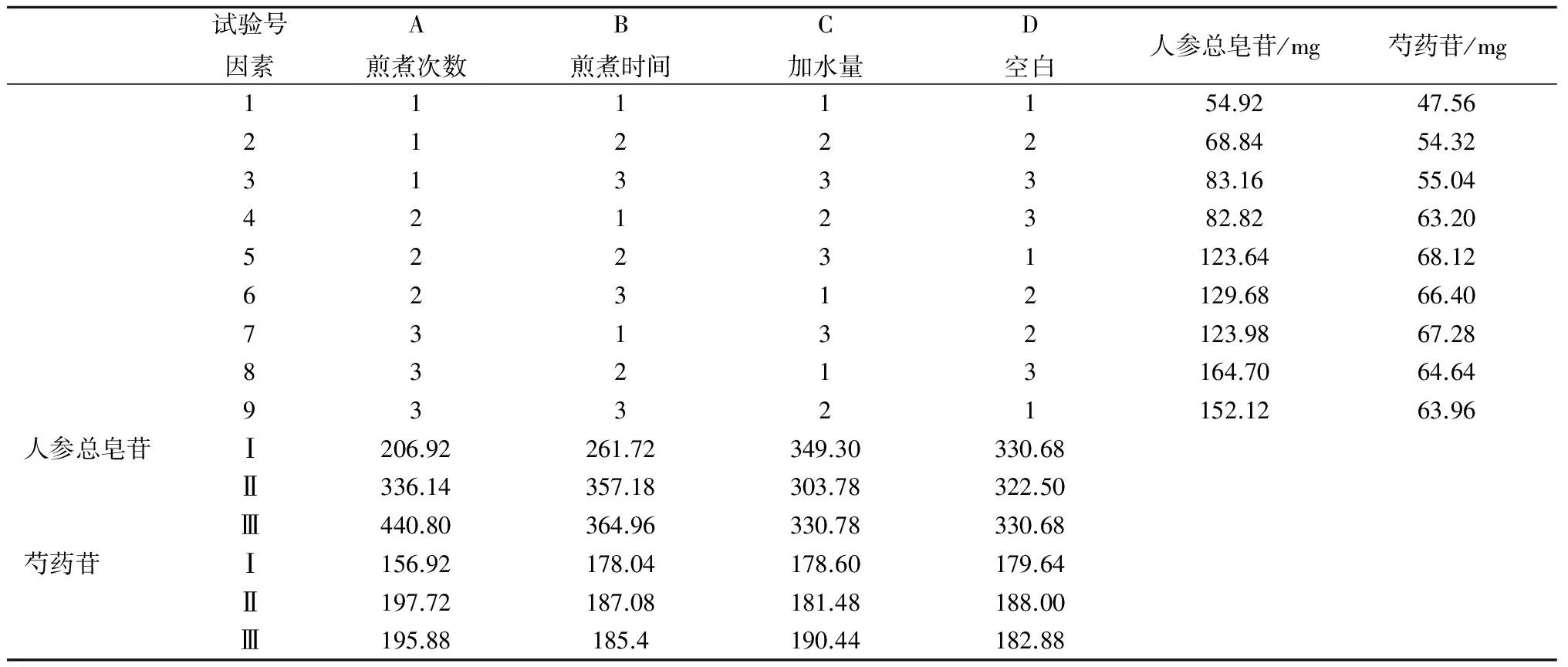
表3 正交试验设计和结果
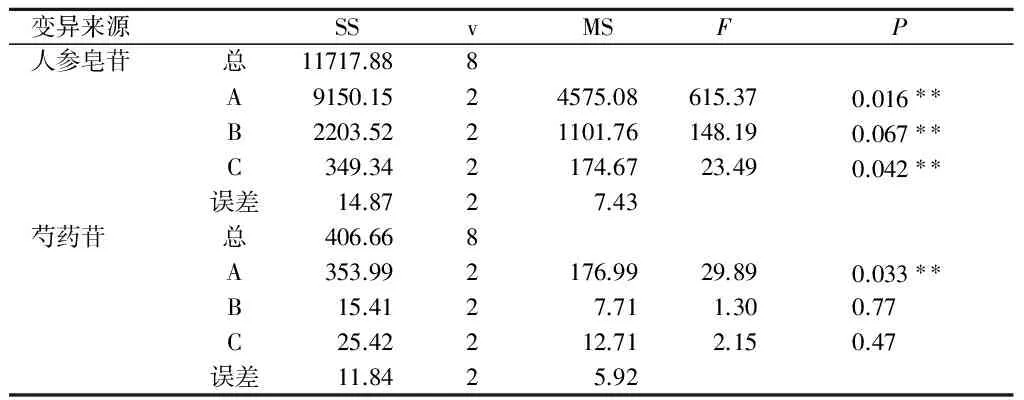
表4 正交试验的方差分析结果
注:F0.10(2,2)=9.00,F0.05(2,2)=19.00。
由表4可以看出,因素A即提取次数对人参总皂苷和芍药苷的提取量有极显著影响,而因素B、C对人参皂苷影响较为显著,对芍药苷影响较小,不呈显著性。由表3的直观分析结果可知,人参皂苷的最佳提取次数为3次,芍药苷为2次,但提取2次与3次芍药苷提取结果接近;因素B和C的人参皂苷最佳水平分别为2 h和10倍量。因此,确定的最佳的提取工艺条件为A3B3C3,即人参牡丹胶囊水煎煮的最佳工艺参数为人参和牡丹皮加10倍量水,煎煮3次,每次2 h。
3 讨 论
根据人参牡丹胶囊中药材的主要有效成分水溶性较好的特点,选用加水煎煮的方式进行提取。在实验中,分别以人参皂苷Rg1、Re、Rb1、Rd和芍药苷为测定指标,多指标考察,综合分析,优选出了人参牡丹胶囊的最佳煎煮提取工艺条件。
在人参皂苷Rg1、Re、Rb1、Rd和芍药苷的测定中,采用与《中国药典》2010版一部药材项下含量测定方法一致的HPLC法。在测定人参皂苷时,本文所选流动相可使Rb1和Rd的出峰时间提前,减少了分析时间,提高了工作效率;在待测成分出峰结束后,提高流动相中乙腈的比例,去除样品杂质对后续测定的干扰,可有效保护色谱柱。
[1]郭秀丽,张淑莲.人参化学成分和药理研究进展[J].中医临床研究,2012,4(14):26-28.
[2]窦德强,薪玲,陈英杰,等.人参的化学成分及药理活性的研究进展与展望[J].沈阳医科大学学报,1999,16(2):151-156.
[3]石楸鸣.人参皂苷的药理作用研究进展[J].中国药房,2010,21(31):2967-2968.
[4]曹丽,顾学文,张天一,等.人参皂苷对小鼠腹腔巨噬细胞活性的影响及作用机制初步探讨[J].中国免疫学杂志,2011,27(5):423.
[5]樊兴娟,柯开富,姜正林,等.人参皂苷单体对大鼠局灶性脑缺血再灌注的神经保护研究[J].中华医学杂志,2006,86(29):2071-2074.
[6]王祝举,唐力英,赫炎.牡丹皮的化学成分和药理作用[J].国外医药:植物药分册,2006,21(4):155-159.
[7]王艳华,吴德玲,刘劲松,等.牡丹皮中丹皮总苷的提取工艺研究[J].安徽中医学院学报,2012,31(2):69-71.
[8]王君萍,韦颖梅,郭梅,等.芍药苷对大鼠脑缺血再灌注损伤细胞凋亡相关基因的影响[J].中西医结合心脑血管病杂志,2008,6(3):310-312.
[9]孙蓉,吕丽莉,郭守东,等.芍药苷对局灶性脑缺血模型及血脑屏障的影响[J].哈尔滨商业大学学报:自然科学版,2005,21(4):405-410.
(编辑 陶 珠)
1001-6910(2015)03-0067-04
R284.2
B
10.3969/j.issn.1001-6910.2015.03.32
李向阳(1968—),男(汉族),河南商丘人,副主任药师,从事中药质量控制研究与药品检验工作。
河南省科技创新人才计划资助项目(144200510028)
2014-09-17;
2014-10-23

