高效液相色谱法同时测定凤仙花中的萘醌类和黄酮类成分
姜洪芳 石宝俊 张峰伦 赵伯涛 施国新 张卫明
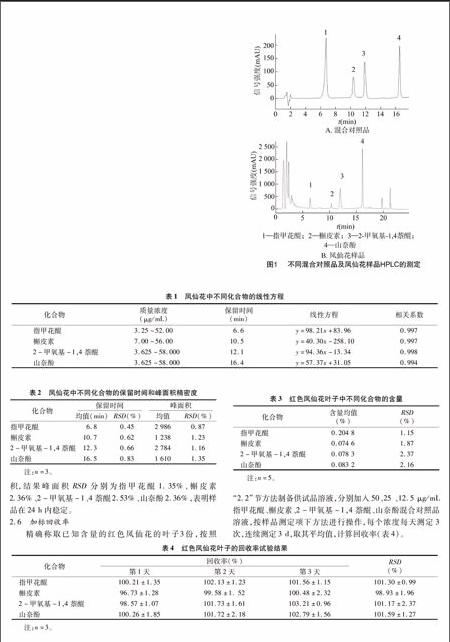
摘要:建立反相高效液相色谱,测定不同花色单瓣凤仙花和多重瓣茶凤仙茎、叶、花中指甲花醌、槲皮素、2-甲氧基-1,4萘醌、山奈酚含量。采用Agilent Eclipse XDB-C18色谱柱,乙腈-25%乙酸水为流动相,梯度洗脱进行分离,检测波长245 nm。指甲花醌、槲皮素、2-甲氧基-1,4萘醌、山奈酚在选定浓度范围内线性关系良好,平均回收率分别为 1013%、9893%、10117%、10159%,RSD分别为0986%、196%、237%、127%,该方法简单、快速、准确,可作为凤仙花中萘醌类和黄酮类物质同时测定的方法。
关键词:凤仙花;萘醌;黄酮;高效液相色谱法
中图分类号: O6577+2文献标志码: A
文章编号:1002-1302(201412-0344-03[HS][HT9SS]
收稿日期:2014-07-18
基金项目:国家科技支撑计划(编号:2012BAD36B01 。
作者简介:姜洪芳(1974—,女,博士研究生,副研究员,从事天然产物活性物质应用与开发。E-mail:jhf74@163com。
通信作者:张卫明,研究员,从事植物活性物质的应用与开发。E-mail:botanyzh@163com。
凤仙花(Impatiens balsamina L为凤仙花科(Balsaminaceae凤仙花属(Impatiens一年生草本植物。凤仙花属共有植物900余种,全球均有分布。凤仙花作为观赏植物在国内外均有种植,也是该属植物的常见品种,其花、茎、叶、种子在民间有悠久的药用历史,被广泛用于治疗腰胁痛、 蛇咬伤、 鹅掌风、 风湿性关节炎、 痈疖疮疔、 胎衣不下、 溃疡日久不愈和经闭腹痛等,2010年版《中国药典》收载其种子急性子作为药用部位。凤仙花的化学成分主要有黄酮、萘醌、香豆素、有机酸、花青素和甾醇类,其中黄酮和萘醌有很强的抗炎、抗菌、抗过敏和抑制Wnt信号通道等活性;据报道指甲花醌和2-甲氧基-1,4萘醌是该植物抗细菌和抗真菌的活性成分,2-甲氧基-1,4萘醌具有很强的对抗HepG2细胞的抗肿瘤活性[1-3]。国内外已有文献报道,用高效液相色谱法(HPLC分别定量测定凤仙花中的黄酮和萘醌类成分[4-7],但对于2类成分含量的同时测定还未见报道,本研究应用HPLC对常见品种单瓣凤仙花和多重瓣茶凤仙在7月盛开期的茎、叶、花中指甲花醌、2-甲氧基-1,4萘醌、槲皮素、山萘酚进行了测定,为该属植物的开发应用提供技术依据。
1材料与方法
11材料
高效液相色谱仪Agilent 1200 HPLC(美国安捷伦公司生产,G1354A四元泵,G1313A自动脱气机,G1316柱温箱,G1315B二极管阵列检测器。
Q-600DE型超声波清洗器,江苏省昆山市超声仪器有限公司生产;
高效液相色谱(HPLC分析用甲醇、乙腈为色谱纯(美国天地;试验用水为超纯水,提取用试剂均为分析纯。
对照品包括指甲花醌、2-甲氧基-1,4萘醌、槲皮素、山奈酚,均购于中国食品药品检定研究院,纯度大于98%。单瓣凤仙花及多重瓣茶凤仙的茎、叶、花均于2012年7月采自南京,经南京野生植物研究院张玖教授鉴定为凤仙花(Impatiens balsamina L。
12HPLC分析条件
Agilent Eclipse XDB-C18分离柱(46 mm×150 mm,5 μm;流动相为乙腈-25%醋酸水,梯度洗脱条件:0~10 min,25 ∶[G-3]75;10~20 min,32 ∶[G-3]68;20~35 min,25 ∶[G-3]75,流速10 mL/min,进样量20 μL,柱温为25 ℃,DAD检测器,检测波长245、250、280、360 nm。
13对照品溶液的制备
分别称取指甲花醌、2-甲氧基-1,4萘醌、槲皮素、山奈酚对照品10 mg,精确称定,甲醇溶解并定容,稀释成浓度为50、40、25、125、10、625、312 μg/mL的溶液,经045 μm 微孔滤膜过滤,供HPLC测定,并绘制每种物质的标准曲线。
14供试品溶液的制备
称取样品粉末 (50 ℃ 烘干12 h,磨碎过40目筛 50 g,精确称定,加入55% 乙醇水溶液80 mL,室温浸泡2 h,超声提取 1 h,定容至100 mL,滤液经045 μm 的微孔滤膜过滤,供HPLC测定。
2结果与分析
21标准品与样品的HPLC测定
在“12”节色谱条件下,样品中指甲花醌、槲皮素、2-甲氧基-1,4萘醌、山奈酚色谱峰的保留时间与对照品一致,4种成分的色谱峰均能得到较好的分离,样品其他成分对欲测成分的测定无干扰(图1。
22线性关系分析
将不同梯度浓度的混合对照品溶液分别进样,进样量为20 μL,以峰面积y为纵坐标,进样质量浓度x (μg/mL为横坐标绘制标准曲线,结果见表1。
23精密度试验
准确吸取25 μg/mL指甲花醌、2-甲氧基-1,4萘醌、槲皮素、山奈酚混合对照品溶液20 μL,按照“23”节建立的方法进行检测,重复测定3次,记录保留时间和峰面积,计算各个化合物的相对标准差(RSD,均小于 15%(表2,表明仪器精密度良好。
24重复性试验
精确称取红色凤仙花叶子粉末5002 3 g,共5份,按照“22”节方法制备供试品溶液,再按照“23”节建立的方法进行检测,重复测定3次,记录各化合物峰面积,计算得到各化合物含量的RSD为115 %~237%(表3,表明该方法的重现性良好。
25稳定性试验
供试品溶液于配制后4、10、14、24 h分别进样,记录峰面
[F(W21][TPJHF1tif][F][FL]
[F(W9][HT6H][J]表1凤仙花中不同化合物的线性方程[HTSS][STB]
[HJ5][BG(!][BHDFG3,W12,W16,W8,W16,W8W]化合物质量浓度(μg/mL保留时间(min线性方程相关系数
[BHDG12,W12Q3,W16DW,W8DW,W16Q4,W8W]指甲花醌325~520066y=9821x+83960997
[BHDW]槲皮素700~5600105y=4030x-258100997
2-甲氧基-1,4萘醌3625~58000121y=9436x-13340998
山奈酚3625~58000164y=5737x+31050994[HJ][BG)F][F)]
[FL(22]
[F(W8][HT6H][J]表2凤仙花中不同化合物的保留时间和峰面积精密度[HTSS][STB]
[HJ5][BG(!][BHDFG3,W9,W20W]化合物[B(][BHDWG12,W10。2W]保留时间峰面积[XXSX2-SX92]均值(minRSD(%[XXSX2-SX92]均值RSD(%[BW]
[BHDG12,W9Q0,W5。4DWW]指甲花醌680452 986087
[BHDW]槲皮素1070621 238123
2-甲氧基-1,4萘醌1230662 784116
山奈酚1650831 610135[HJ][BGF]
注:n=3。[F]
积,结果峰面积RSD分别为指甲花醌135%、槲皮素236%、2-甲氧基-1、4萘醌253%、山奈酚236%,表明样品在24 h内稳定。
26加标回收率
[CM(24]精确称取已知含量的红色凤仙花的叶子3份,按照[CM]
[F(W9][HT6H][J]表3红色凤仙花叶子中不同化合物的含量[HTSS][STB]
[HJ5][BG(!][BHDFG3,W11,W9。2W]化合物含量均值(%RSD(%
[BHDG12,W11Q1,W9。2DWW]指甲花醌0204 8115
[BHDW]槲皮素0074 6187
2-甲氧基-1,4萘醌0078 3237
山奈酚0083 2216[HJ][BGF]
注:n=5。[F]
“22”节方法制备供试品溶液,分别加入50、25 、125 μg/mL指甲花醌、槲皮素、2-甲氧基-1,4萘醌、山奈酚混合对照品溶液,按样品测定项下方法进行操作,每个浓度每天测定3次,连续测定3 d,取其平均值,计算回收率(表4。
[FL]
[F(W8][HT6H][J]表4红色凤仙花叶子的回收率试验结果[HTSS][STB]
[HJ5][BG(!][BHDFG3,W12,W36,W12W]化合物[B(][BHDWG12,W36W]回收率(%[BHDWG12,W12。3W][XXSX2-SX352]第1天第2天第3天RSD(%
[BHDG12,W12Q1,W12。4W]指甲花醌10021±13510213±12310156±11510130±099
[BHDW]槲皮素9673±1289958±1 5210048±2329893±196
2-甲氧基-1,4萘醌9857±10710173±16110321±09610117±237
山奈酚10026±18510172±218 10279±15610159±127[HJ][BGF]
注:n=3。[F]
[FL(22]27样品测定
按照“22”节及“23”节的方法操作,测定不同凤仙花样品的指甲花醌、槲皮素、2-甲氧基-1,4萘醌、山奈酚峰面积,按照“表1”中的标准方程计算出各种化合物的含量,结果见表5。
[FL]
[F(W10][HT6H][J]表5凤仙花中萘醌及黄酮化合物含量[HTSS][STB]
[HJ5][BG(!][BHDFG42,W6,W54W]凤仙花样[B(][BHDWG12,W54W]化合物含量(%
[BHDWG12,W132。4W][XXSX2-SX532]指甲花醌2-甲氧基-1,4萘醌槲皮素山奈酚
[BHDWG12,W42。12W][XXSX2-SX13]茎叶花[XXSX2-SX13]茎叶花[XXSX2-SX13]茎叶花[XXSX2-SX13]茎叶花
[BHDG12,W6,W42。12DWW]白色020106900258 006100810836004601750133005303680714
[BHDW]紫色083202140321019400450258003101410131009601770653
红色011702070236018200800626005500730158007400760603
粉紫色00710342030200040042063200870135002801020362
多重花瓣048400900337008400060135006100670100012801890765[HJ][BG)F][F)]
[FL(22]指甲花醌含量在凤仙花的叶、花中较高,多数集中在02%~07% 之间,在紫色凤仙花的茎中含量最高,为0832%,多重瓣茶凤仙的茎中含量为0484%;2-甲氧基-1,4萘醌普遍分布在花中,以白色凤仙花中为最高,达0836%;可见,萘醌类在植株中的总量以白色凤仙花最高,为2127%,紫色凤仙花位居第2 ,为1864%,多重瓣茶凤仙最低,为1136%。槲皮素主要分布在叶和花中,以白色凤仙花的叶子为最多,达0175%;山奈酚主要分布在各色凤仙花的叶和花中,多重瓣茶凤仙含量最高,达0765%,白色凤仙花中为0714%;以槲皮素和山奈酚为代表的黄酮类物质在植株中的总量以白色凤仙花最高,达1489%,多重瓣茶凤仙花和紫色凤仙花分别为1310%、1229%,粉紫色凤仙花最低,为0714%。
3讨论与结论
31提取溶剂的优化
为了使供试品溶液获得最佳的提取率,参照文献 [4-7],应用HPLC法比较水、55% 乙醇、95% 乙醇、乙酸乙酯室温下对红色凤仙花叶子浸泡提取的指甲花醌、2-甲氧基-1,4萘醌、槲皮素、山奈酚的含量,以55% 乙醇溶液为溶剂能够将4种物质最大量地提取出来。
32HPLC检测波长的选择
由于指甲花醌、2-甲氧基-1,4萘醌、槲皮素、山奈酚的最大吸收波长不完全一致,如指甲花醌、2-甲氧基-1,4萘醌最大吸收波长为250、280、350 nm,其中350 nm处的吸光度比较弱,槲皮素最大吸收波长为255、370 nm,山奈酚最大吸收波长为266、367 nm[5-7],在HPLC分析中,DAD检测器设置了245、250、280、360 nm多通道检测模式,结果表明,4个化合物在245 nm处的峰面积均高于其他波长处的峰面积,所以选择245 nm作为液相色谱分析的检测波长,从而提高了检测方法的灵敏度。
33HPLC流动相的确定
通过HPLC分析条件的筛选,有利于在最短的时间内将复杂组份完全分离,特别是有多个样品需要分析时。用甲醇-水、乙腈-水对凤仙花的叶子提取物进行分析,结果显示乙腈-水分离效果优于甲醇-水,缩短了分离时间,将25% 醋酸加入到水中,可以将欲分离的萘醌类物质与黄酮类物质达到基线分离,同时进行定量测定。
[JP2]从总体来看,白色凤仙花的萘醌类和黄酮类物质含量较高,国外大量研究也是围绕白色凤仙花开展的,但紫色、粉紫色及多重瓣茶凤仙中也含有较高的活性物质,可以作为药用植物进行研究与应用。 生长环境、采收时间、种植资源等因素都会影响植物次生代谢产物的含量,可以利用能增加次生代谢产物的有利因素,进行组织培养,增加次生代谢产物的含量。
本试验建立了HPLC同时测定凤仙花中指甲花醌、2-甲氧基-1,4萘醌、槲皮素、山奈酚含量的方法,该方法可同时测定萘醌、黄酮2类成分,可用于凤仙花药材的质量控制。
[HS2][HT85H]参考文献:[HT8SS][HJ19mm]
[1][(#]鞠培俊,孔德云,李晓波凤仙花化学成分及药理作用研究进展[J] 沈阳药科大学学报,2007,24(5:320-324
[2]苏秀芳,蓝金 凤仙花的化学成分及药理活性研究进展[J] 广西民族师范学院学报,2010,27(3:13-15
[3]胡喜兰,朱慧,刘存瑞,等 凤仙花的化学成分研究[J] 中成药,2003,25(10:833-834
[4]郝治湘,刘玉芬,周丽华 反相高效液相色谱法测定凤仙花中芦丁、槲皮素和山奈酚的含量[J] 化工时刊,2006,20(10:42-43,49
[5]胡喜兰,韩照祥,刘玉芬,等 凤仙花不同提取物中山奈酚的测定[J] 分析实验室,2007,26(5:33-35
[6]Lobstein A,Brenne X,Feist E,et al Quantitative determination of naphthoquinones[J] Phytochemical Analysis,2001,12:202-205
[7]Sakunphueak A,Panichayupakaranant P Simultaneous determination of three naphthoquinones in the leaves of Impatiens balsamina L by reversed-phase high-performance liquid chromatography[J] Phytochemical Analysis,2010,21(5:444-450

