高岭土-硅酸锂的制备及其吸附CO2动力学
谢洪燕,丁彤,李玉龙,高挪挪
(天津大学化工学院,天津 300072)
引言
当前,温室效应已成为人类社会可持续发展面临的全球性问题,影响地球气候变暖,破坏生态环境,影响人类健康。二氧化碳气体排放是导致温室效应最主要的原因之一[1],自工业革命以来,化石燃料的大量使用使CO2的排放量逐年递增,预计到2050年,CO2的排放量比工业革命前要增长1.4~4.0倍[2],其中CO2主要来自于以化石燃料为主的火电厂、水泥厂等的排放,所以脱除高温烟道气中的CO2、减少排放已经成为消除温室效应的研究重点。
从1998年Nakagawa等[3]发现锆酸锂吸附剂以来,众多学者开始对锂基吸附剂展开研究,包括Li2ZrO3[4-5]、Li4SiO4[6-7]、Li4TiO4[8]、Li2CuO2[9]等,在这一系列锂盐吸附剂中 Li4SiO4被认为是最具发展潜力的 CO2高温吸附剂,该材料高温吸附 CO2的能力超过其他陶瓷材料,而且该材料在室温下也可吸附CO2[10-11],这对解决全球变暖问题具有重要的意义。硅酸锂属于单斜晶系,其制备一般采用含二氧化硅成分的物质为硅源,以碳酸锂、硝酸锂或氢氧化锂为锂源,锂源的选择因不同制备方法而不同,硅酸锂的制备方法主要有固相法、浸渍沉淀法、溶胶凝胶法等。汪文哲等[12]对比了溶胶凝胶法和固相法,发现两者最大吸附量及相应的吸附温度相同,但溶胶凝胶法制备的硅酸锂材料吸附速率更快,更容易达到最大吸附量,更有利于高温CO2的吸附。Shan等[13]以硅藻土为原料,采用浸渍沉淀法制备硅酸锂材料,相比固相法,具有较好的吸附效率和吸附速率,而关于浸渍沉淀法的制备条件中影响因素较大的是煅烧温度、煅烧时间和浸渍温度[14]。对比这3种方法,发现固相法制备硅酸锂的温度较高,样品容易烧结,溶胶凝胶法基本上不能合成出单一的Li4SiO4[15],所得样品纯度最低,而浸渍沉淀法不仅可以获得纯度较高的硅酸锂,而且制备的样品颗粒较小,工艺简单,有利于大规模生产。
煤系高岭土作为中国特有的一种资源,储量丰富,应用广泛。用高岭土生产硫酸铝或氯化铝时会产生大量的废渣,废渣主要成分为SiO2,目前废渣主要用来生产硅酸钙[16]和白炭黑[17]或作生产水泥[18]的活性材料,其他方面的应用报道很少[19]。因此,开展煤系高岭土及其工业废渣的综合利用具有长远的战略意义。
本文在本课题组前期的研究[20]基础上,以高岭土为硅源,进一步考察硅源、制备方法对硅酸锂吸附CO2性能的影响,同时探讨浸渍沉淀法的主要制备条件,进一步提高硅酸锂的吸附性能,并使用双指数模型进行动力学分析。
1 实验部分
1.1 实验试剂
市售-SiO2,高岭土-SiO2[20](酸处理高岭土后剩余的物料),碳酸锂,硝酸锂,氨水,无水乙醇。
1.2 硅酸锂基吸附剂的制备
固相法,即按n(Si):n(Li)=1:4,称取一定量的高岭土-SiO2或市售-SiO2和Li2CO3加入到石英研钵中,并加入适量的无水乙醇为溶剂,充分研磨,干燥完全后,将混合物于马弗炉中750℃煅烧6 h。
以市售-SiO2为硅源,采用浸渍沉淀法制备硅酸锂,即按n(Si):n(Li)=1:4,称取一定量的LiNO3溶于无水乙醇中,加热至40℃,加入市售-SiO2,浸渍搅拌4 h后,缓慢地滴加氨水,静置3 h,干燥,研磨,最后将混合物于马弗炉中750℃煅烧6 h。
以高岭土-SiO2为硅源,采用浸渍沉淀法制备硅酸锂,即按n(Si):n(Li)=1:4,称取一定量的 LiNO3溶于无水乙醇中,加热至一定温度(30、40、54℃),加入高岭土-SiO2,充分浸渍搅拌4 h后,缓慢地滴加氨水,静置3 h,干燥,研磨,最后将混合物分别于马弗炉中650、700、750、800℃煅烧4 h。
注:以高岭土-SiO2(或市售-SiO2)为硅源制备的硅酸锂记为高岭土-Li4SiO4(或市售-Li4SiO4)。
1.3 测试分析
X射线粉末衍射采用荷兰 Panalytical公司X’Pert Pro型X射线衍射分析仪测试,Co靶,扫描范围 10°~90°,扫描速率 8(°)·min-1。样品的形貌特征采用日本日立公司 S-4800型场发射扫描电子显微镜测试。热分析采用美国Perkin-Elmer公司生产的型号为 DIAMOND差热-热重联用分析仪(DTA-TG)进行吸附剂吸附CO2性能评价。
2 结果与讨论
2.1 样品的表征
图1是不同方法制备的硅酸锂XRD图。由图1可以看出,以高岭土-SiO2、市售-SiO2为硅源采用固相法和浸渍沉淀法均能制备出纯度较高的硅酸锂(PDF卡号为37-1472)。同时还可以看出,固相法制备的样品中,市售-Li4SiO4衍射峰强度高、结晶度高;不同方法制备的高岭土-Li4SiO4,采用浸渍沉淀法可得到结晶度较低的样品。

图1 不同方法制备的硅酸锂XRD图Fig.1 XRD patterns of Li4SiO4prepared by different methods

图2 二氧化硅的扫描电镜图Fig.2 SEM images of SiO2
图2和图3分别是SiO2和Li4SiO4的扫描电镜图。由图2可以看出,高岭土-SiO2为片状结构,而市售-SiO2为絮状结构。由图3可以看出,固相法制备的高岭土-Li4SiO4和市售-Li4SiO4样品,均为片层结构,其中,市售-Li4SiO4表面光滑、结构致密,有明显的烧结现象,而高岭土-Li4SiO4表面相对粗糙、疏松,存在大量的层状堆积缝隙孔。因此可知,硅源原料的表面结构对硅酸锂样品的表面结构有直接影响,以高岭土-SiO2硅源制备的样品相对疏松,疏松的结构有利于CO2在吸附剂表面及孔道中的扩散和吸收。

图3 硅酸锂的扫描电镜图Fig.3 SEM images of Li4SiO4
比较不同方法制备的Li4SiO4,可以发现,浸渍沉淀法制备的高岭土-Li4SiO4颗粒较小,为3~5 μm,且分布均匀,而固相法制备的高岭土-Li4SiO4颗粒较大,为3~30 μm,且分布不均匀;由此看出,改变制备方法可以进一步减小样品的聚集度。由此推断,较小的颗粒度、较小的聚集度将更有利于样品吸附CO2。
2.2 热重分析
以高岭土-SiO2和市售-SiO2为硅源,采用固相法,和以高岭土-SiO2为硅源,采用浸渍沉淀法750℃煅烧6 h制备的硅酸锂热重曲线图,如图4所示。对照固相法制备的硅酸锂样品,在350~650℃温度区间内时,高岭土-Li4SiO4的 CO2吸附量明显高于市售-Li4SiO4,600 ℃时两者的吸附量分别为10.0%和4.9%,前者是后者的2倍。对照以高岭土-SiO2为硅源,采用两种不同方法制备的硅酸锂吸附剂,发现在450~650℃区间内,采用固相法制备的样品的吸附量高于浸渍沉淀法,但是当温度高于650℃时,采用浸渍沉淀法制备的样品的吸附量超过固相法,当温度升高到 718℃左右时,浸渍沉淀法和固相法制备的样品的吸附量分别达到最大值,即31.1%和29.8%,前者比后者高出1.3%。下面通过改进浸渍沉淀法制备硅酸锂的工艺条件,进一步降低硅酸锂的吸附温度,扩大吸附温度范围,扩展其在吸附强化反应中的应用。
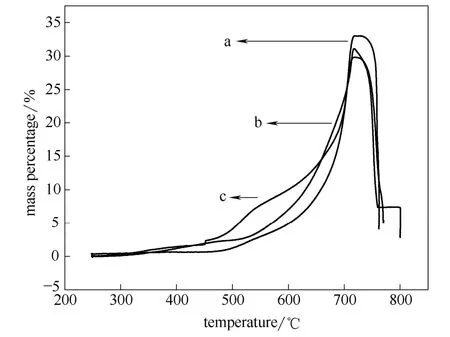
图4 硅酸锂吸附CO2的热重曲线Fig.4 TG curve of Li4SiO4on CO2adsorption

图5 浸渍沉淀法前驱体的热重曲线Fig.5 TG curve of precursor of impregnation-precipitation method

图6 不同煅烧温度下硅酸锂的热重曲线Fig.6 TG curve of Li4SiO4at different calcination temperature
为了确定浸渍沉淀法硅酸锂的煅烧温度,使用热重分析仪,将前驱体在 100 ml·min-1空气气氛下,以10℃·min-1的升温速率从室温升高到800℃,做程序升温热重分析,如图5所示。由图5可以看出,温度低于 500℃时混合物出现缓慢的失重,这部分失重主要是水分的挥发和部分硝酸铵的缓慢分解,当温度高于 500℃时,开始出现明显失重,646℃时,样品的重量几乎不再发生变化,直至结束。因此,以高岭土-SiO2为原料,采用浸渍沉淀法制备硅酸锂的煅烧温度必须高于 646℃。故本文选择煅烧温度为650、700、750、800℃。
以高岭土-SiO2为硅源,采用浸渍沉淀法,浸渍温度为40℃,650、700、750、800℃煅烧4 h,所得样品在60 ml·min-1CO2气氛下进行程序升温吸附,热重曲线如图6所示。由图6可以看出,在程序升温过程中,750℃样品的CO2吸附量高于其他3个样品,750℃是最佳的煅烧温度。
以高岭土-SiO2为硅源,采用浸渍沉淀法,浸渍温度为40℃,750℃煅烧4、5、6 h所得样品的热重曲线如图7所示,由图7可以看出,随煅烧时间的增加,最大吸附量逐渐降低,出现上述结果的原因可能是,煅烧时间过长,硅酸锂容易烧结,小颗粒团聚在一起,比表面积降低,从而影响吸附剂吸附CO2。4 h是最佳煅烧时间。

图7 不同煅烧时间下硅酸锂的热重曲线Fig.7 TG curve of Li4SiO4at different calcination time
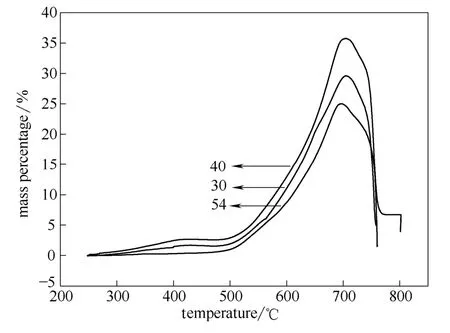
图8 不同浸渍温度下硅酸锂的热重曲线Fig.8 TG curve of Li4SiO4at differentimpregnation temperature
以高岭土-SiO2为硅源,采用浸渍沉淀法,浸渍温度为30、40、54℃,750℃煅烧4 h所得样品的热重曲线如图8所示。浸渍温度为40℃的样品,各温度段的CO2吸附量及最大吸附量都是最高的,最大吸附量为35.75%。40℃是最佳的浸渍温度。
经上述探讨,浸渍沉淀法制备的最佳工艺条件为煅烧温度 750℃,煅烧时间4 h,浸渍温度为40℃。通过改进浸渍沉淀法的制备工艺条件,能明显改善硅酸锂的吸附性能,如图9所示。浸渍沉淀法和固相法制备的样品的最大吸附量分别为35.7%(704℃)和 29.8%(718℃),前者明显高于后者,在 570~700℃的温度范围内,浸渍沉淀法制备的样品的吸附量明显高于固相法,650℃时,吸附量分别为22.1%和13.6%,相差8.5%。
无论从吸附性能,还是节能的角度,浸渍沉淀法都优于固相法。
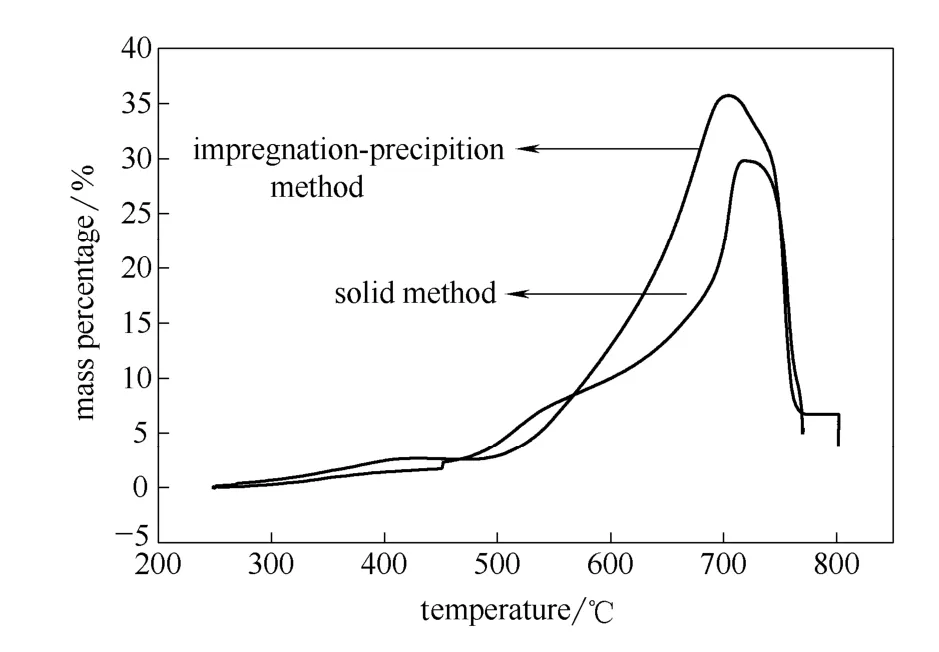
图9 不同制备方法所得样品的热重曲线Fig.9 TG curve of samples prepared by different methods
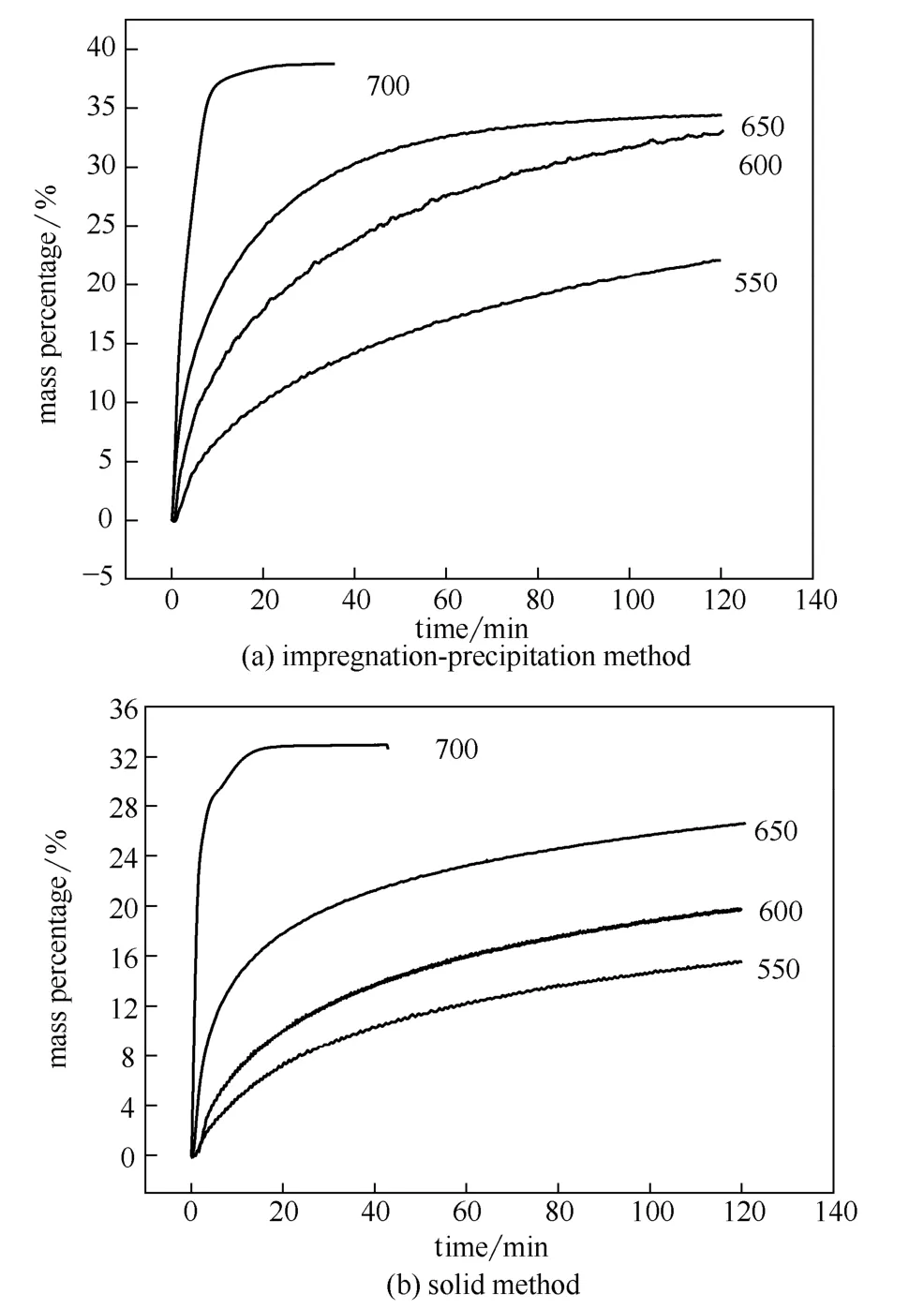
图10 硅酸锂吸附CO2的等温吸附图Fig.10 Isotherms of Li4SiO4absorbing CO2
2.3 硅酸锂吸附CO2的动力学分析
图10是以高岭土-SiO2为硅源,采用浸渍沉淀法和固相法制备的样品的恒温吸附 CO2的热重分析。由图10可以看出,样品在不同温度下的吸附量和吸附速率有较大差异,随着吸附温度的升高,样品的吸附量均逐渐升高,具体数据见表 1。在每个测试温度点,浸渍沉淀法制备的样品的吸附量均高于固相法;且随吸附温度的升高,趋于吸附平衡的时间逐渐缩短,说明吸附速率逐渐加快,对于浸渍沉淀法制备的样品,在700℃恒温吸附10 min达到平衡,对于固相法,则吸附15 min达到平衡。针对制备方法对硅酸锂吸附性能的影响,进行了动力学计算,并分析了浸渍沉淀法优于固相法的原因。

表1 不同温度下的吸附量Table 1 Adsorption quantity at different temperature/%
用双指数模型拟合硅酸锂基吸附剂吸附CO2的过程,求得反应速率常数k1、k2,结果如表2所示。

式中,k1为表面化学反应的速率常数,k2为锂迁移过程的速率常数,y为二氧化碳吸附质量百分比,t为时间,A、B、C为指前因子。
对于浸渍沉淀法,当温度为550、600℃时,k1/k2小于 1,表明整个反应过程的控制步骤是表面化学反应过程,表2中数据显示此时表面化学反应速率非常慢,从而导致较低的吸附量及吸附速率。当温度由 600℃升高到 650℃,k1/k2由 0.0942升高到9.2698,此时整个反应过程的控制步骤转变为锂迁移过程,表面反应速率加快,锂迁移速率变慢。当温度继续升高到 700℃时,k1/k2降到 1.0087,k2略小于k1,可以认为锂迁移过程仍是控制步骤,从k1和k2的绝对数值上看,均大于其他温度,说明700℃时,表面反应速率和迁移速率都很快,很快达到吸附饱和。

表2 不同温度下等温吸附的反应速率常数Table 2 Rate constants of isothermal absorption at different temperatures
对于固相法,当温度小于600℃时,k1/k2小于1,表明整个反应过程的控制步骤是表面化学反应过程,表2中数据显示此时表面化学反应速率非常慢,从而导致较低的吸附量及吸附速率。当温度由 600℃升高到650℃、700℃,k1/k2由小于1的值升高到12.6423、6.5816,表明整个反应过程的控制步骤转变为锂迁移过程。
随吸附温度的升高,两种方法制备的样品的表面化学反应速率和锂迁移速率大致呈逐渐增大的趋势,故随吸附温度的升高,吸附量升高,吸附速率加快。
比较两种方法制备的样品各个温度吸附时的k1、k2数值发现,浸渍沉淀法的样品在吸附 CO2的过程中,锂迁移速率是固相法的1.5~2.2倍。低于650℃时的吸附,浸渍沉淀法的样品表面化学反应速率皆高于固相法。
在上述扫描电镜的分析中发现,固相法制备的样品颗粒较大,浸渍沉淀法制备的样品颗粒较小,表面有大量的层状堆积缝隙孔,有利于吸附剂吸附CO2。
以上分析充分说明了利用浸渍沉淀法可以制备出在较低的温度下具有优良吸附CO2性能的吸附剂,优于固相法。
3 结 论
(1)高岭土-SiO2具有疏松的结构,以高岭土-SiO2为硅源制备的硅酸锂在 350~680℃温度范围内的吸附量明显高于以市售-SiO2制备的硅酸锂。
(2)通过实验条件的探索,确定了以高岭土-SiO2为硅源,采用浸渍沉淀法制备硅酸锂的最佳工艺条件为浸渍温度40℃,煅烧温度 750℃,煅烧时间 4 h。在此条件制备的硅酸锂最大吸附量为35.7%,高出固相法5.9%,同时吸附温度降低。
(3)通过动力学分析可知,表面化学反应过程和锂迁移过程是影响硅酸锂吸附性能的主要因素。温度低于 600℃时,表面化学反应过程是整个反应过程的控制步骤;高于 650℃,锂迁移成为控制步骤。在吸附CO2的过程中,浸渍沉淀法制备的样品锂迁移速率是固相法的 1.5~2.2倍。低于650℃时的吸附,浸渍沉淀法的样品表面化学反应速率皆高于固相法。因此可知,利用浸渍沉淀法可以制备出在较低的温度下具有优良吸附CO2性能的吸附剂。
[1] Fang Jingyun (方精云), Zhu Jiangling (朱江玲), Wang Shaopeng (王少鹏). Global warming, carbon emissions and uncertainty [J].Science China:Earth Science(中国科学:地球科学), 2011, (10):1385-1395.
[2] Fang Huashu (方华书). Carbon dioxide and greenhouse effect [J].Journal of Fuzhou Teachers College(福州师专学报), 2000, (6):56-59.
[3] Nakagawa K, Ohashi T. A novel method of CO2capture from high temperature gases [J].Journal of the Electrochemical Society, 1998,145 (4):1344-1346.
[4] Ochoa-Fernández E, Rønning M, Grande T, Chen D. Synthesis and CO2capture properties of nanocrystalline lithium zirconate [J].Chemistry Materials, 2006, 18:6037-6046.
[5] Raskar R, Rane V, Gaikwad A. The applications of lithium zirconium silicate at high temperature for the carbon dioxide sorption and conversion to syn-gas [J].Water Air and Soil Pollution, 2013, 224:1569.
[6] Wang Jinxiang (王金香), Liu Yin (刘银), Peng Xiaobo (彭小波).Study on the property of CO2absorbed with Li4SiO4material [J].Bulletin of the Chinese Ceramic Society(硅酸盐通报), 2014, (3):620-623.
[7] Wang Yinjie (王银杰), Qi Lu (其鲁), Wang Weijun (江卫军). Effect of doping K element on properties of lithium silicate as CO2-absorbent [J].Transactions of Beijing Institute of Technology,2006, 26 (5):458-467.
[8] Nobuaki T, Takeshi O, Katsuyoshi O. Synthesis and CO2absorption property of Li4TiO4as a novel CO2absorbent [J].Journal of the Ceramic of Japan, 2007, 115 (1341):324-328.
[9] Palacios-Romero L M, Pfeiffer H. Lithium cuprate (Li2CuO2):a new possible ceramic material for CO2chemisorption [J].Chemistry Letters, 2008, 37 (8):862-863.
[10] Kato M, Yoshikawa S, Nakagawa K. Carbon dioxide absorption by lithium orthosilicate in a wide range of temperature and carbon dioxide concentrations [J].Journal of Materials Science Letters, 2002,21:485-487.
[11] Essaki K, Nakagawa K, Kato M, Uemoto H. CO2absorption by lithium silicate at room temperature [J].Journal of Chemical Engineering of Japan, 2004, 37 (6):772-777.
[12] Wang Wenzhe (汪文哲), Xiong Gui (熊贵), Zhang Junying (张军营).Influence of Ti-doping on CO2absorption by Li4SiO4at high-temperatures [J].Journal of Chinese Society of Power Engineering(动力工程学报), 2010, 30 (8):623-627.
[13] Shan S Y, Li S M, Jia Q M, Jiang L H, Wang Y M, Peng J H.Impregnation precipitation preparation and kinetic analysis of Li4SiO4-based sorbents with fast CO2adsorption rate [J].Industrial &Engineering Chemistry Research, 2013, 52:6941-6945.
[14] Li Qinchao (李芹超). The research on preparation and CO2absorption performance of lithium orthosilicate [D]. Kunming:Kunming University of Science and Technology, 2011.
[15] Venegas M J, Fregoso-Israel E, Escamilla R, Pfeiffer H. Kinetic and reaction mechanism of CO2sorption on Li4SiO4:study of the particle size effect [J].Industrial & Engineering Chemistry Research, 2007,46:2407-2412.
[16] Wu Zeguang (伍泽广). Study on the preparation of multi-form alumina and siliceous inorganic filler form coal-bearing kaolin [D].Xuzhou:China University of Mining and Technology, 2012.
[17] Zhang Qichun (张其春),Ye Qiaoming (叶巧明). The preparation of white carbon black from kaolin [J].Chinese Journal of Applied Chemistry, 1999, 16 (5):91-93.
[18] Hu Puhua (胡普华), Wang Aiguo (王爱国), Sun Daosheng (孙道胜).Orthogonal optimization design of preparing geopolymeric cement with alkali activation of coal-kaolinite [J].Materials Review, 2008,(11):150-152, 156.
[19] Zhu Hua (朱华). The industry progress and situation of application in kaolin [J].Mining Engineering, 2005, (6):25-26.
[20] Liu Yulan (刘玉兰). Study on CO2absorption performance of lithium orthosilicates [D]. Tianjin:Tianjin University, 2013.

