多巴胺包埋磁性SiO2固定化漆酶催化去除4-氯酚
张笛,邓满凤,赵赫,曹宏斌,2,张松平
(1中国科学院过程工程研究所,北京 100190;2天津化学化工协同创新中心,天津 300072)
引 言
随着中国工业化的不断发展,工业“三废”不能得到有效的控制,污水灌溉、污泥施肥等使水体的污染日益加剧,尤其是酚类有机物的污染给人类生活带来严重的影响。4-氯酚(4-CP)属于氯酚类污染物的一种,它作为重要的工业原料主要用于除草剂、杀虫剂、防锈剂、木材防腐剂和染料等物质的合成[1]。4-CP的化学性质比较稳定,在自然环境中能够长期存在且很难被降解,因此会对生物体造成一定的危害,其生物毒性随浓度的增加而增大。目前,4-CP去除的方法主要有活性炭吸附法、电化学降解、光催化氧化法和微生物降解法等[2-4]。虽然这些传统的处理方法起到了一定的作用,但对于微量氯酚类有机物的去除效果却不太理想。
酶催化技术具有反应条件温和、反应速度快、催化效率高、对低浓度微量有机污染物选择性高等特点,因此酶催化技术与传统方法结合来降解氯酚类污染物也受到越来越多的关注[5-7]。漆酶是一类含铜的多酚氧化酶,能够催化氧化各种氯酚类物质,是一种绿色环保的催化剂[8]。相比游离酶而言,固定化漆酶在使用过程中的稳定性高,便于回收利用,因此它在酚类废水处理方面具有广阔的应用前景。
目前,用于固定化漆酶的载体主要有活性炭[9]、多孔碳[10]、微球[11]、膜[12]等。由于磁性载体固定化酶在磁场作用下可从反应体系中迅速分离,有利于重复利用且降低成本,因此磁性载体固定化酶也越来越受到关注[13]。其中,磁性二氧化硅粒子不仅具有较高的比表面积,可调的孔径及表面性能,而且其制备过程相对简便,因此被广泛用作酶固定化的载体。
多巴胺(dopamine,DA)作为一种新型的聚合物材料被广泛用于酶的固定化领域[14]。据研究发现,DA是一种仿生物黏合蛋白,在水溶液中,它能够在溶解氧的作用下发生聚合反应,形成强力黏附于固体表面的聚多巴胺(PDA)层,酶蛋白分子在此聚合反应过程中能被牢固地包裹固定在聚合层内[15]。DA的这种黏附行为主要源自其分子结构上的氨基和邻苯二酚基团,这种结构能够与无机-有机材料建立起非共价和共价的相互作用,从而使PDA强力黏附于固体材料的表面上[16]。由于多巴胺的生物相容性好,反应条件温和,聚合过程快,反应可控[17-18],因此它作为一种较理想的聚合材料在酶的固定化领域具有广阔的应用前景。然而,通过多巴胺自聚合用于二氧化硅磁性纳米颗粒固定化漆酶来降解 4-CP的研究还未见报道。
在以前的研究中[19],通过多巴胺的自聚合,制备了聚多巴胺-磁性纳米二氧化硅材料并用于固定化漆酶,本文主要将制备的多巴胺包埋磁性二氧化硅固定化漆酶用于水体中4-CP的去除实验,进一步探讨其对污染物的催化性能及影响因素,以期为固定化酶催化降解废水中有机物的实际应用提供 指导。
1 实验材料和方法
1.1 材料
漆酶(laccase,EC 1.10.3.2,Sigma公司); 2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸铵)(ABTS,Sigma公司);多巴胺(DA,武汉远成科技公司)。实验用水为Milli-Q 超纯水(Millipore 公司),其余均为国药集团化学试剂有限公司分析纯试剂。
1.2 分析测试仪器
紫外可见分光光度计(UNICO 2800型),上海实验设备有限公司;电动机械搅拌装置(JJ-2型),江苏省金坛市医疗仪器厂;混合振荡器(XH-C型),江苏省金云市医疗仪器厂;恒温冷冻摇床(SPH-200B型),上海世平有限公司;高效液相色谱(Agilent 1200型),美国Agilent公司;离心机(TGL-16C型),上海安亭科学仪器厂;电子微量天平(BS-124S型),北京赛多利斯仪器系统有限公司;浊度仪(HACH-2100Q型),上海京工实业有限公司。冷场扫描电子显微镜(JSM-6700F型),日本JEOL公司;激光粒度分析仪(Coulter Model N4SD型), 美国Beckman Coulter公司; X射线衍射仪(PW 3040-60型),荷兰 Philips 分析仪器公司。
1.3 酶固定化条件优化及热稳定性测定
本实验以溶液pH、漆酶浓度、固定化时间因素,设计一组3因素3水平的正交实验来优化Fe3O4@SiO2-PDA-Lac的制备,溶液pH分别为5、6、7,漆酶浓度分别为0.25、0.5、0.75 mg·ml-1,固定化时间分别为6、12、18 h。
将游离酶、Fe3O4@SiO2-PDA-Lac分别置于 50℃的恒温水浴锅中保存6 h,每隔1 h取样进行检测漆酶的活性,其中以第1次测定的活性大小为100%来计算,用来对比考察固定化漆酶对不同温度的耐受性。酶活性测定方法如文献[19]。
1.4 模拟水样的配制
取一定量的4-CP用去离子水溶解配制成质量浓度为10 mg·L-1的反应液,并加入一定量的碱度、离子强度、浊度,使其与天然水体条件相似。具体步骤如下:加入一定量的碳酸氢钠,使碱度为100 mg·L-1(以 CaCO3计算);加入一定量的氯化钾,使离子强度为3.3 mmol·L-1;加入一定量高岭土,使浊度为 20 NTU。以上溶液配制完成后均匀搅拌2 h,测定初始溶液的pH,并置于4℃的冰箱中保存待用。
1.5 固定化漆酶去除4-CP
将50 ml上述配制好的4-CP溶液加入到体积为150 ml的反应器,向该反应器中投加一定量的固定化漆酶,在150 r·min-1的机械搅拌下反应10 min后,用磁铁将反应器中的固定化漆酶分离回收,接着投加PAC絮凝剂(以4 mg Al·L-1计算),以150 r·min-1快速搅拌2 min,50 r·min-1慢速搅拌15 min,静置沉降30 min。取1 ml上清液经0.22 µm滤膜过滤后,进高效液相色谱仪(HPLC)中测量4-CP的残留量。
1.6 4-CP 检测方法的建立
在磁性纳米颗粒固定化漆酶去除4-CP的实验中,以HPLC作为4-CP的检测手段,紫外检测波长279 nm,检测器柱温35℃,流动相甲醇和水(体积配比为50:50),流速0.25 ml·h-1,进样体积20 μl,检测时间15 min。
4-CP标准曲线的建立方法具体如下:取一定量的4-CP溶液分别配制成0.5、1.0、2.0、4.0、6.0、8.0、10 mg·L-1的待测液,用HPLC在紫外波长279 nm处检测4-CP的含量。4-CP的标准工作曲线为:Y=68.08X+13.14(R2=0.9975)。
1.7 固定化漆酶去除4-CP的条件优化
(1)溶液pH对4-CP去除率的影响
为了探究不同pH的反应溶液对游离漆酶和固定化漆酶去除4-CP的影响,本实验将反应体系的pH分别设为2、3、4、5、6、7、8,其中,游离漆酶和固定化漆酶的浓度都是1.2 U·ml-1。在30℃ 条件下,将反应混合物置于150 r·min-1转速的摇床中振荡反应8 h,每隔1 h取1 ml反应液并且滴加少量的浓H2SO4终止酶反应,经0.22 µm的滤膜过滤后,用HPLC检测分析体系中4-CP的残留量。
(2)漆酶浓度对4-CP去除率的影响
为了考察不同浓度的游离漆酶和固定化漆酶对4-CP降解过程的影响,在几组反应液中加入一定量的游离漆酶或固定化漆酶,使其终浓度分别为0.4、0.8和1.2 U·ml-1。反应体系在30℃条件下150 r·min-1转速的摇床中振荡反应8 h,每间隔1 h取1 ml反应液并且滴加少量的浓H2SO4终止酶反应,经过0.22 µm的滤膜过滤后,用HPLC进行检测分析反应体系中4-CP的残留量。
(3)ABTS对4-CP去除率的影响
为了考察ABTS对游离漆酶和固定化漆酶催化降解4-CP的影响,本实验设计了几组实验进行探究。其中,漆酶的浓度分别为1.2,2.4,3.6 U·ml-1,ABTS浓度为50 μmol·L-1,以不加ABTS的反应作为对照实验。反应液在30℃条件下,150 r·min-1的摇床中反应10 min后,滴加一定量的浓H2SO4终止反应,取出1 ml上清液经0.22 µm的滤膜过滤后,进HPLC中检测分析体系中4-CP的残留量。
1.8 固定化漆酶在去除4-CP中的重复使用性
为了研究固定化漆酶在去除4-CP实验中的重复使用性,先配制20 ml质量浓度为10 mg·ml-1的4-CP反应液,加入一定量的固定化漆酶,使其浓度为1.2 U·ml-1。在30℃条件下150 r·min-1转速的摇床中反应2 h后,用磁铁将固定化漆酶从体系中分离出来,取出1 ml上清液经0.22 µm的滤膜过滤后,进HPLC检测4-CP的残留量,将分离的固定化漆酶洗涤2次后用于下次重复实验,如此反复使用10次。
2 实验结果与讨论
2.1 磁性颗粒的表征
2.1.1 磁性纳米颗粒的表面形貌 图1所示为磁性SiO2纳米颗粒固定化酶的表面形貌结构。从扫描电子显微镜图中可以看出Fe3O4@SiO2比较规整的球形结构,分散性较好,平均粒径在130 nm左右,颗粒的粒径较小有利于漆酶的固定化。而Fe3O4@SiO2-PDA-Lac表面呈不规则的形态分布,颗粒间还产生了聚集现象,这是因为漆酶在纳米颗粒上的固定化不是以直接共价结合的方式,而是借助于DA自聚合过程中的黏合作用来实现的,纳米颗粒与酶分子通过这种作用力黏附在一起,从而形成了聚集体。

图1 磁性SiO2纳米颗粒固定化漆酶的扫描电镜图 Fig.1 SEM images of nanoparticles
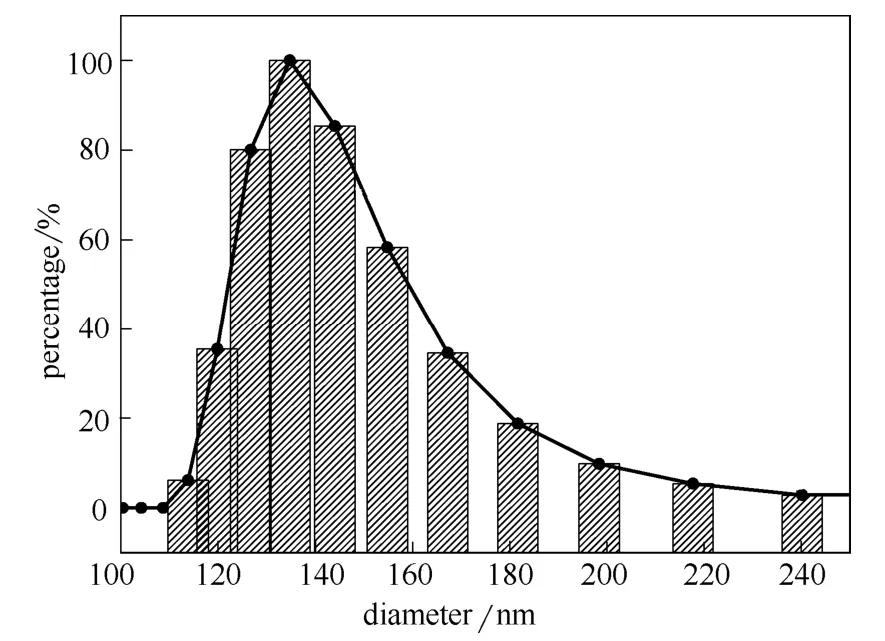
图2 Fe3O4@SiO2纳米颗粒在水溶液中的粒径分布图 Fig.2 Size distribution of Fe3O4@SiO2nanoparticles
图2为Fe3O4@SiO2纳米颗粒在去离子水中的粒径分布图。其结果表明,制备的纳米颗粒在去离 子水中呈单一分散,粒径分布较均一,计算出的颗粒平均粒径为134 nm。与扫描电镜的测定结果基本一致。
2.1.2 磁性纳米颗粒的磁性特征 图3为Fe3O4纳米颗粒在外加磁场作用下的沉降情况,可以看出,在外加磁场作用下,10 min内Fe3O4纳米粒子90%发生沉降,该结果表明Fe3O4纳米粒子在去离子水中具有良好的磁响应。因此,以磁性纳米颗粒作为理想的载体来固定漆酶,不仅可以将漆酶从反应体系中加以回收利用,还能够利用外加磁场调整固定化漆酶的运动方式,从而代替普通的搅拌方式并适用于产业化大规模使用。
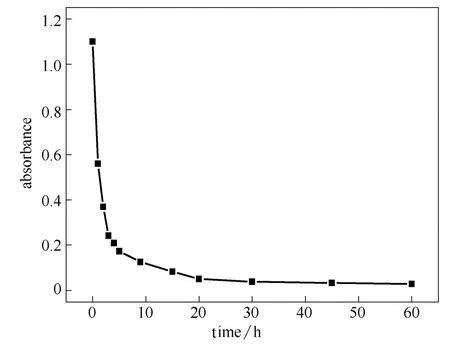
图3 Fe3O4纳米颗粒在外加磁场作用下的沉降曲线 Fig.3 Precipitation curve of Fe3O4NPs in magnetic field
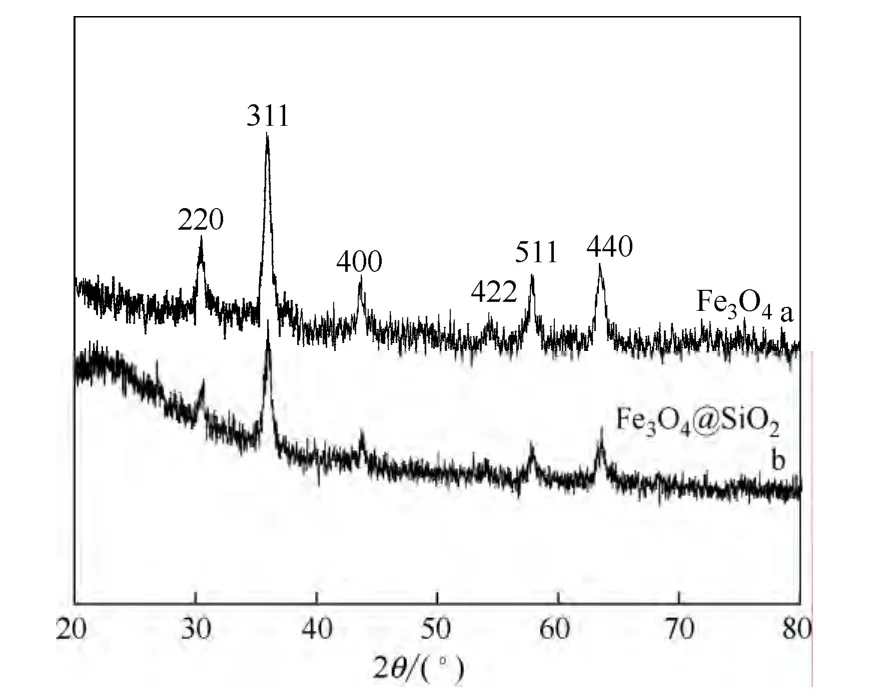
图4 磁性纳米颗粒的XRD图 Fig.4 XRD patterns of nanoparticles
2.1.3 磁性纳米颗粒的结构分析 图4是Fe3O4纳米颗粒和Fe3O4@SiO2纳米颗粒的 XRD图。从曲线a可以看出,制备的Fe3O4纳米颗粒的主要衍射角分别位于30.1°、35.5°、43.1°、53.4°、57.0°和62.6°,和标准Fe3O4晶体的衍射角所对应的位置基本上是吻合的。Fe3O4纳米颗粒的衍射峰依次对应于(220)、 (311)、(400)、(422)、(511)和(440)晶面,与标准Fe3O4晶体的衍射峰完全一致[20],说明以高温热分解法所制备的Fe3O4纳米颗粒具有较好的晶型结构。从曲线b可知,通过溶胶-凝胶法在Fe3O4纳米颗粒表面包埋了一层SiO2壳层后,Fe3O4晶体的特征峰强度明显下降,这是由于无定形结构的SiO2壳层覆盖在Fe3O4纳米颗粒的表面上,Fe3O4纳米颗粒的结晶度下降所致。但是包埋了SiO2壳层的Fe3O4颗粒在XRD图谱上的特征峰都出现了,说明颗粒的晶型结构没有明显的变化。
2.2 固定化漆酶活性及稳定性
表1为优化制备Fe3O4@SiO2-PDA-Lac的正交实验结果,通过以总酶活回收率为评价指标的参数估算和极差分析,得出影响Fe3O4@SiO2-PDA-Lac酶活回收率的因素主次关系为:溶液pH>酶浓度>固定化时间,得出制备Fe3O4@SiO2-PDA-Lac的最优条件是:溶液pH为6、酶浓度为0.25 mg·ml-1、固定化时间为18 h。在最优固定化条件下,通过验证得出的实际总酶活回收率为43.28%,与极差分析的预测值(40.79%)基本吻合,说明正交实验优化Fe3O4@SiO2-PDA-Lac的实验结果是可靠的。相比于其他生物友好材料应用于漆酶的固定化方法[21-23],本研究中利用多巴胺聚合固定化漆酶的总酶活回收率更高,具有更好的固定化效果。

表1 正交实验所得固定化酶最佳条件 Table 1 Optimum parameters by optimization of orthogonal experiments
图5所示是游离酶和Fe3O4-SiO2-PDA-Lac的热稳定性曲线。在50℃的恒温水浴锅中放置6 h后,Fe3O4-SiO2-PDA-Lac的活性保持在63%左右,相比固定化酶而言,游离酶在50℃条件下的活性下降更快,6 h后只保留了18%的活性。这是因为固定后的漆酶分子与纳米颗粒之间的相互作用力使得漆酶的结构刚性增强,因而增加了它对环境的抗热变性能,游离酶分子由于缺乏与载体之间的作用力,在高温条件下容易引起失活。
2.3 固定化漆酶对CP的去除效果
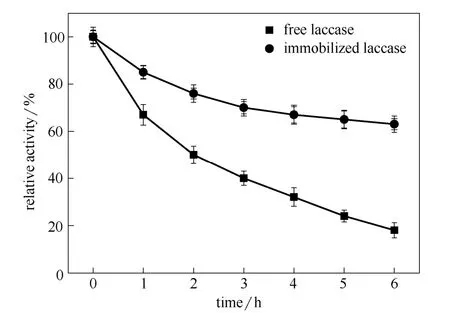
图5 游离漆酶和固定化漆酶在磷酸盐缓冲液 (0.1 mol·L-1,pH 6.0)中的热稳定性 Fig.5 Thermal stability of free and immobilized laccase in PBS buffer (0.1 mol·L-1, pH 6.0) at 50℃ for 6 h
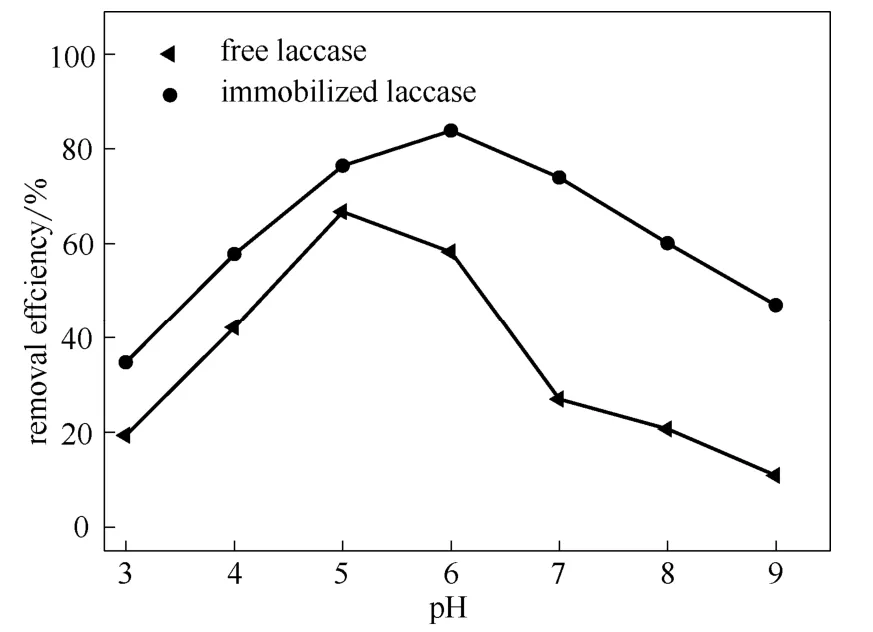
图6 pH对游离漆酶和固定化漆酶去除4-CP的影响 Fig.6 Effect of pH on removing efficiency of 4-CP by free and immobilized laccase
2.3.1 溶液pH的影响 图6所示为不同pH的反应体系中漆酶对4-CP去除率的影响。从图中的结果可以看出,固定化漆酶反应的最适pH为6,对应 4-CP的去除率能达到84.3%,而游离漆酶反应的最适pH为5,对应4-CP的去除率只有65.7%。当溶液的pH在5~7之间时,固定化漆酶对4-CP的去除率均能保持在60%以上,对于游离酶来说,在pH为5~7之间,4-CP的去除率相对较低。在本研究中,由于多巴胺包埋磁性SiO2固定化漆酶的稳定性较高,其在酸性及碱性环境下适应性均较好,所以对4-CP的去除效果明显高于游离漆酶。
2.3.2 漆酶浓度的影响 图7所示为不同浓度的游离漆酶和固定化漆酶对4-CP去除率的影响,结果显示,随着漆酶浓度从0.4 U·ml-1提高至1.2 U·ml-1,4-CP的去除率不断提高,且随着反应时间增加,所有体系的去除率均逐渐增加。当反应达到8 h后,1.2 U·ml-1的固定化漆酶对4-CP的去除率能达到95%。对于游离漆酶而言,在相同反应条件下,1.2 U·ml-1的游离酶对4-CP 的去除率仅为82%。这主要是由于游离酶在体系中很不稳定,在 长时间的振荡反应过程中,容易发生形变,导致活性损失,所以在长时间的催化反应过程中,游离漆酶对4-CP的去除效果反而低于固定化漆酶。
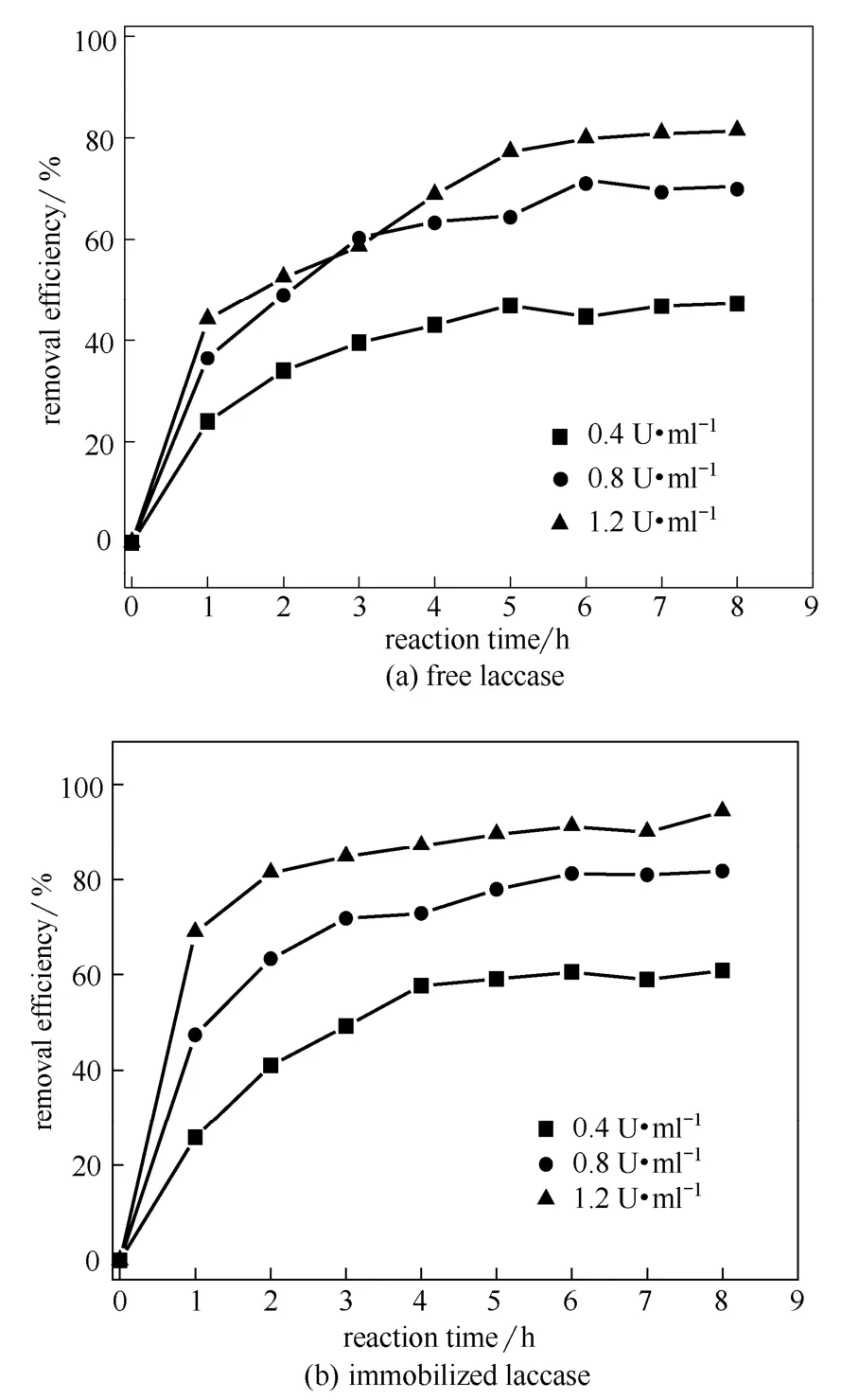
图7 游离漆酶和固定化漆酶的浓度对4-CP去除率的影响 Fig.7 Effect of laccase concentration for removing 4-CP (4-CP: 10 mg·L-1at pH 5.0; temperature: 30℃)
2.3.3 ABTS的影响 从图8可知,在未加入ABTS时,游离酶和固定化酶催化降解4-CP的速率较慢,反应10 min后,3.6 U·ml-1的游离酶和固定化酶对4-CP的去除率分别仅为54%和35%。当体系中加入ABTS时,反应10 min后,1.2 U·ml-1的游离酶和固定化酶分别能去除76%和96%的4-CP;3.6 U·ml-1的游离酶和固定化酶分别能去除96%和 99%的4-CP。由此可知,ABTS作为一种氧化还原介质可以促进漆酶对4-CP的去除,相比游离漆酶,ABTS对促进固定化漆酶去除4-CP的效果明显要高。因此,以ABTS为介质的酶催化反应具有潜在的研究价值,为酶催化降解氯酚类物质提供了依据。
2.4 固定化漆酶的重复使用性
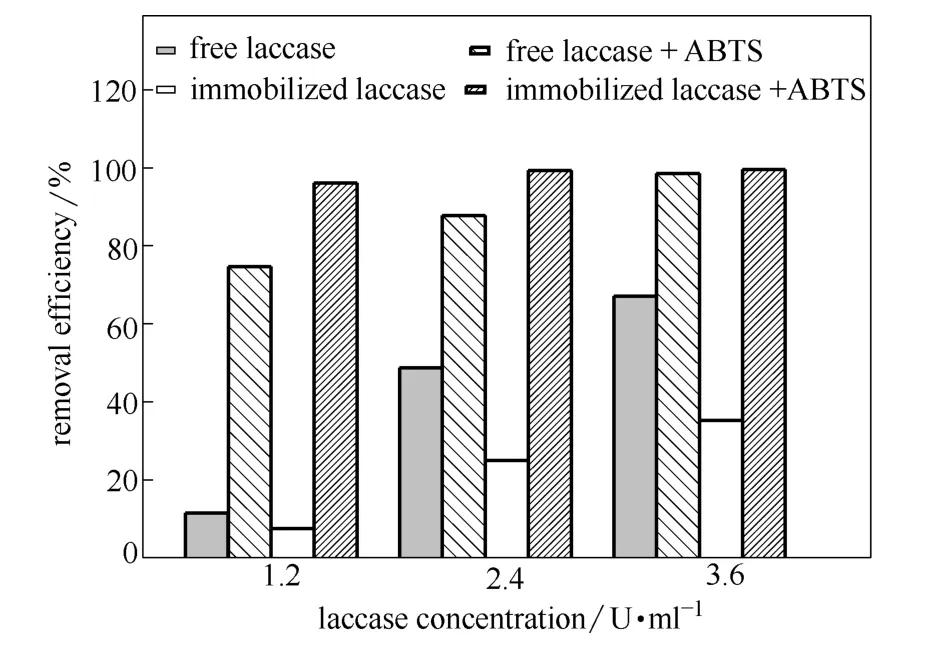
图8 ABTS对游离漆酶和固定化漆酶去除4-CP的影响 Fig.8 Effect of ABTs concentration for removing 4-CP by free laccase and immobilized laccase
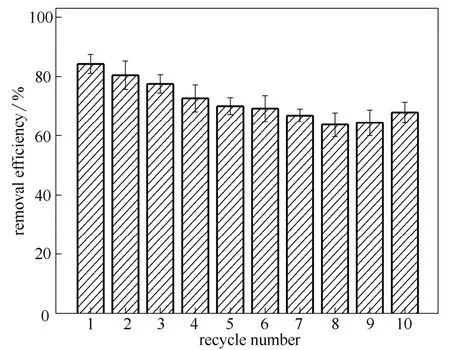
图9 固定化漆酶在去除4-CP中的重复使用性 Fig.9 Reusability of immobilized laccase for removing of 4-CP at 30℃ (4-CP: 10 mg·L-1at pH 5.0; laccase concentration: 1.2 U·ml-1; reaction time: 2 h)
本实验考察了固定化漆酶在去除4-CP实验中的重复使用性,其结果如图9所示。第一次使用时, 4-CP的去除率能达到85%,重复使用10次后,4-CP的去除率保持在67%左右,相当于固定化漆酶仍然保留了80%的催化活性。该结果表明,通过多巴胺的自聚合作用[24],在氧化聚合的过程中将漆酶包埋在聚合层的里面,该聚合层对外界微环境的变化具有一定的抵抗作用,有利于固定化漆酶活性的保存,因此固定化漆酶具有较高的重复使用性。由于在酶催化降解过程中,产生的不溶性物质会增加酶与4-CP反应的位阻,影响酶的活性中心对底物的作用,从而导致酶的催化效率有一定的降低。
3 结 论
(1)通过溶胶-凝胶法制得的Fe3O4@SiO2纳米颗粒,颗粒呈球状分布而且平均尺寸为134 nm。可以在外加磁场的作用下迅速将磁性纳米颗粒从反应体系中分离出来。通过最优条件制备出的Fe3O4-SiO2-PDA-Lac固定化漆酶在50℃的恒温中放置6 h后,活性保持在63%左右,而游离酶仅保留了18%的活性。
(2)固定化漆酶在反应最适pH时(pH=6),能催化降解84.3%的4-CP,而游离漆酶在反应最适pH时(pH=5),4-CP的去除率仅为65.7%。
(3)随着体系中漆酶浓度的增加,4-CP的去除率不断增大,当反应达到8 h时,1.2 U·ml-1的固定化漆酶对4-CP的去除率可达95%,对于游离漆酶而言,在相同条件下,4-CP的去除率仅82%,说明固定化漆酶催化降解4-CP的效果优于游离漆酶。
(4)当体系中加入ABTS时,反应10 min后,3.6 U·ml-1的游离酶和固定化酶对4-CP的去除率分别为96%和99%,由此可知,ABTS作为一种反应介质可以促进漆酶对4-CP的去除,相比游离漆酶,ABTS对促进固定化漆酶去除4-CP的效果明显要高。
(5)在重复使用10次后,固定化漆酶对4-CP的去除率仍然保持在67%左右,相当于固定化漆酶还保留了80%的初始催化活性,该结果表明固定化漆酶具有较高的操作稳定性和重复使用性,为实现工业化应用提供了有力的依据。
[1] Salmer`On-Aleoeer A, Ruiz-Ordaz N, Ju`arez-Ram`xrez C, Galíndez-Mayer J.Continuous biodegradation of single and mixed chlorophenols by a mixed microbial culture constituted by Burkholderiasp, Microbacterium phyllosphaerae, and Candida tropicalis[J].Biochem.Eng.J., 2007, 37 (2): 201-211.
[2] Ho K L, Lin B, Chen Y Y, Lee D J.Biodegradation of phenol using Corynebacteriumsp.DJ1 aerobic granules [J].Bioresource Technol., 2010, 100 (21): 5051-5063.
[3] Duan X Y, Ma F, Chang L M.Electrochemical degradation of 4-chlorophenol in aqueous solution using modified PbO2anode [J].Water Sci.Technol., 2012, 66 (11): 2468-2474.
[4] Neppolian B, Vinoth R, Bianchi C L, Ashokkumar M.Degradation of 4-chlorophenol and NOxusing ultrasonically synthesized TiO2loaded graphene oxide photocatalysts [J].Sci.Adv.Mater., 2015, 7 (6): 1149-1155.
[5] Lloret L, Eibes G, Feijoo G, Moreira M T, Lema J M, Hollmann F.Immobilization of laccase by encapsulation in a sol-gel matrix and it characterization and use for the removal of estrogens [J].Biotechnol.Progr., 2011, 27 (6): 1570-1579.
[6] Yin Y, Xiao Y, Lin G, Xiao Q, Lin Z, Cai Z.An enzyme-inorganic hybrid nanoflower based immobilized enzyme reactor with enhanced enzymatic activity [J].J.Mater.Chem.B, 2015, 3: 2295-2300.
[7] Liese A, Hilterhaus L.Evaluation of immobilized enzymes for industrial applications [J].Chem.Soc.Rev., 2013, 42 (15): 6236-6249.
[8] Yaropolov A, Skorobogat’Ko O, Vartanov S, Varfolomeyev S.Laccase [J].Appl.Biochem.Biot., 1994, 49 (3): 257-280.
[9] Davis S, Burns R G.Covalent immobilization of laccase on activated carbon for phenolic effluent treatment [J].Appl.Microbiol.Biot., 1992, 37 (4): 474-479.
[10] Champagne P P, Ramsay J.Dye decolorization and detoxification by laccase immobilized on porous glass beads [J].Bioresource Technol., 2010, 101 (7): 2230-2235.
[11] Jiang D S, Long S Y, Huang J, Xiao H Y, Zhou J Y.Immobilization of pycnoporus sanguineus laccase on magnetic chitosan microspheres [J].Biochem.Eng.J., 2005, 25 (1): 15-23.
[12] Datta S, Christena L R, Rajaram Y R S.Enzyme immobilization: an overview on techniques and support materials [J].3 Biotech, 2013, 3 (1): 1-9.
[13] Zheng M Q, Zhang S P, Ma G H, Wang P.Effect of molecular mobility on coupled enzymatic reactions involving cofactor regeneration using nanoparticle-attached enzymes [J].J.Biotehnol., 2014, 154 (4): 274-280.
[14] Cui J, Yan Y, Such G K, Liang K, Ochs C J, Postma A, Caruso F.Immobilization and intracellular delivery of an anticancer drug using mussel-inspired polydopamine capsules [J].Biomacromolecules, 2012, 13 (8): 2225-2228.
[15] Lee H, Rho J, Messersmith P B.Facile conjugation of biomolecules onto surfaces viamussel adhesive protein inspired coatings [J].Adv.Mater., 2009, 21 (4): 431-434.
[16] Lee H, Lee B P, Messersmith P B.A reversible wet/dry adhesive inspired by mussels and geckos [J].Nature, 2007, 448 (7151): 338-341.
[17] Lai G, Zhang H, Yong J, Yu A.In situ deposition of gold nanoparticles on polydopamine functionalized silica nanosphere for ultrasensitive nonenzymatic electrochemical immunoassay [J].Biosens.Bioelectron., 2013, 47: 178-183.
[18] Liu Y L, Ai K L, Lu L H.Polydopamine and its derivative materials: synthesis and promising applications in energy, environmental, and biomedical fields [J].Chem.Rev., 2014, 114 (9): 5057-5115.
[19] Deng M F, Zhao H, Zhang S P, Tian C Y, Zhang D, Du P H, Liu C M, Cao H B, Li H P.High catalytic activity of immobilized laccase on core–shell magnetic nanoparticles by dopamine self-polymerization [J].J.Mol.Catal.B-Enzym., 2015, 112: 15-24.
[20] Raul A, Laura D M, Laura C, Alvaro M, Marcel T, Valeria G, Jesús M D L F, Clara M, Ricardo I.Spatially-resolved EELS analysis of antibody distribution on biofunctionalized magnetic nanoparticles [J].ACS Nano, 2013, 7 (5): 4006-4013.
[21] Zhang P, Wang Q Q, Zhang J N, Li G H, Wei Q F.Preparation of amidoxime-modified polyacrylonitrile nanofibers immobilized with laccase for dye degradation [J].Fiber.Polym., 2014, 15 (1): 30-34.
[22] Wang Q Q, Cui J, Li G H, Zhang J N, Li D W, Huang F L, Wei Q F.Laccase immobilized on a PAN/adsorbents composite nanofibrous membrane for catechol treatment by a biocatalysis/adsorption process [J].Molecules, 2014, 19 (3): 3376-3388.
[23] Xu R, Chi C L, Li F T, Zhang B R.Laccase-polyacrylonitrile nanofibrous, membrane: highly immobilized, stable, reusable, and efficacious for 2,4,6-trichlorophenol removal [J].ACS Appl.Mater.Interfaces, 2013, 5 (23): 12554-12560.
[24] Yang C, Wu H, Shi J F, Wang X L, Xie J J, Jiang Z Y.Preparation of dopamine/titania hybrid nanoparticles through biomimetic mineralization and titanium (Ⅳ)-catecholate coordination for enzyme immobilization [J].Ind.Eng.Chem.Res., 2014, 53 (32): 12665-12672.

