颈动脉分叉部动脉瘤模型形态学、血流动力学和组织病理学研究
李 菁, 王 珏, 谭华桥
血管分叉部动脉瘤,如颅内动脉瘤,有较高患病率[1],并能导致致命性出血,然而其发生发展、破裂的具体机制目前尚未明确[2-3]。血流动力学改变和血管壁损伤在颅内动脉瘤发生中起重要作用;近80%颅内大血管分叉部存在动脉壁肌层缺失。有研究证实动脉分叉顶部动脉瘤存在由复杂的管壁面切应力(WSS)或管壁面切应力梯度(WSSG)所引起的细胞及分子水平改变[3]。但仅有少数动物模型较满意地模拟了分叉部动脉瘤发生及生长[4]。我们假设内层弹力膜(IEL)及中膜弹力纤维损伤和特定血流动力学行为可促进动脉瘤发生和发展,设计制作一种犬颈总动脉(CCA)Y形分叉模型并以弹力蛋白酶消化分叉部顶端,从血管造影和组织病理水平动态观察动脉瘤生长。
1 材料与方法
本实验研究方案经上海交通大学附属第六人民医院动物研究委员会批准,并遵循国际动物保护协会指导方针。取用21只8个月龄比格犬,体重12~20 kg(上海交通大学农学院提供,许可证:SCXK2007-0004)。
1.1 动物模型制作及分组
取18只犬,按Meng等[5]报道方法制作CCA Y形分叉模型,随后随机分为弹力蛋白酶处理组(EBG组)和分叉模型对照组(CBG组),每组雌性犬6只和雄性3只。EBG组通过弯曲的注射器钝头将弹力蛋白酶(3.0 U/μl)滴入T形塑料管并流入模型分叉部顶端(面积约4×4 mm2)15 min,防止流入血管其它区域;CBG组以同样方法换用生理盐水流入模型分叉部顶端。上述步骤前应尽量多地去除血管外膜,以方便弹力蛋白酶或盐水渗透。另取3只犬,直段CCA切开暴露并以弹力蛋白酶处理(ESG组)。用彩色多普勒超声仪采集模型建立前后目标血管收缩期峰值流速。
1.2 血管造影分析
术后即刻、术后12周和24周,采用德国Siemens公司Syngo AXIOM-Artis型数字减影血管造影机作血管造影检查。如果有动脉瘤样囊泡形成,即依据三维DSA图像分别测量颈和瘤体最大值、载瘤动脉直径和角度。术后第4周和第8周,采用超声仪动态监测动脉瘤是否形成及其大小,观察模型分叉情况。
1.3 流体动力学分析
术后即刻、术后12周和24周,采用三维DSA作旋转性血管造影并对模型分叉部三维成像,测得分叉部血流流速作为边界条件,引入计算流体动力学(CFD)模拟软件(Mimics 10.0图像处理软件,比利时Materialise公司)分析WSS(横向力)、流速场、流速曲线、表面相对压力场(纵向力)、总压力场并计算WSSG,同时分别在CCA分叉顶部同侧相距1、2、3mm处定量分析EBG组分叉模型WSS和WSSG。
1.4 组织病理学检查
术后 12周(n=6)和 24周(n=3)分别取 EBG组、CBG组CCA Y形分叉模型样本,术后24周取ESG组(n=6)CCA样本。预实验和术后分叉样本均作苏木精-伊红(HE)、Masson染色和弹力纤维染色。连续切片用于评估分叉样本组织学改变,用EnVision快速微波免疫组化标记技术,以小鼠抗增殖细胞核抗原(PCNA)抗体、α-平滑肌肌动蛋白(SMA)单克隆抗体、抗巨噬细胞单克隆抗体(MAC387)、基质金属蛋白酶(MMP)-2和MMP-9单克隆抗体为CCA样本作免疫标记;用抗CD45的白细胞抗体和抗MAC387的抗巨噬细胞抗体作免疫双荧光染色,判断白细胞中是否包含巨噬细胞;测量平滑肌细胞增殖率(PCNA阳性平滑肌细胞所占比例)、弹力层和肌动蛋白阳性平滑肌层厚。炎性细胞浸润指数为CD45阳性细胞在血管分叉中膜有核细胞中所占百分比,MMP-2和MMP-9表达水平定义为MMP-2/9阳性区域在血管分叉中膜中所占面积百分比。采用Image-Pro Plus 6.0版图像分析系统软件(美国Media Cybernetics公司)作组织病理学图像统计分析,每个切片至少随机选择20个以上高倍镜视野(400倍)进行分析。
1.5 统计学分析
采用GraphPad Prism 5.0软件(美国GraphPad微软公司)进行统计学分析。连续变量用平均值±标准差表示,数值变量以数量或百分比表示;用确切概率法(Fisher检验)比较分类资料;用组间t检验比较平滑肌细胞增殖速率、弹力层、肌动蛋白阳性平滑肌层厚、炎性细胞浸润程度、MMP-2和MMP-9表达水平。所有数据均经双边检验,P<0.05为差异有统计学意义。
2 结果
2.1 动物模型及血管造影结果
成功建立所有犬CCA Y形分叉模型。超声或血管造影检查均显示无吻合口狭窄、无载瘤动脉闭塞。血管造影显示EBG组5只犬模型有CCA分叉顶部新生动脉瘤形成,其中4只为雌性,1只为雄性(P>0.05);二维和三维DSA均显示动脉瘤位置在分叉顶部,形态为宽基底型,瘤体平均直径(3.2±0.4)mm,瘤颈(6.7±2.3)mm(图1);术后24周未观察到动脉瘤破裂,较12周时仅有轻度增大,(3.5±0.3)mm对(3.2±0.4)mm(P=0.076)。术后4周超声监测均已发现所有新生动脉瘤。CBG组12周时血管造影未显示任何形态学改变。载瘤动脉直径和角度在CBG组分别为(4.3±0.4)mm和(112.9±36.1)°,EBG组分别为(4.3±0.4)mm和(120.3±44.2)°(表1)。EBG组5只形成动脉瘤模型载瘤CCA分叉角度为(146.8± 40.8)°,4只未形成动脉瘤者分叉角度为(87.25± 18.87)°(P=0.032)。
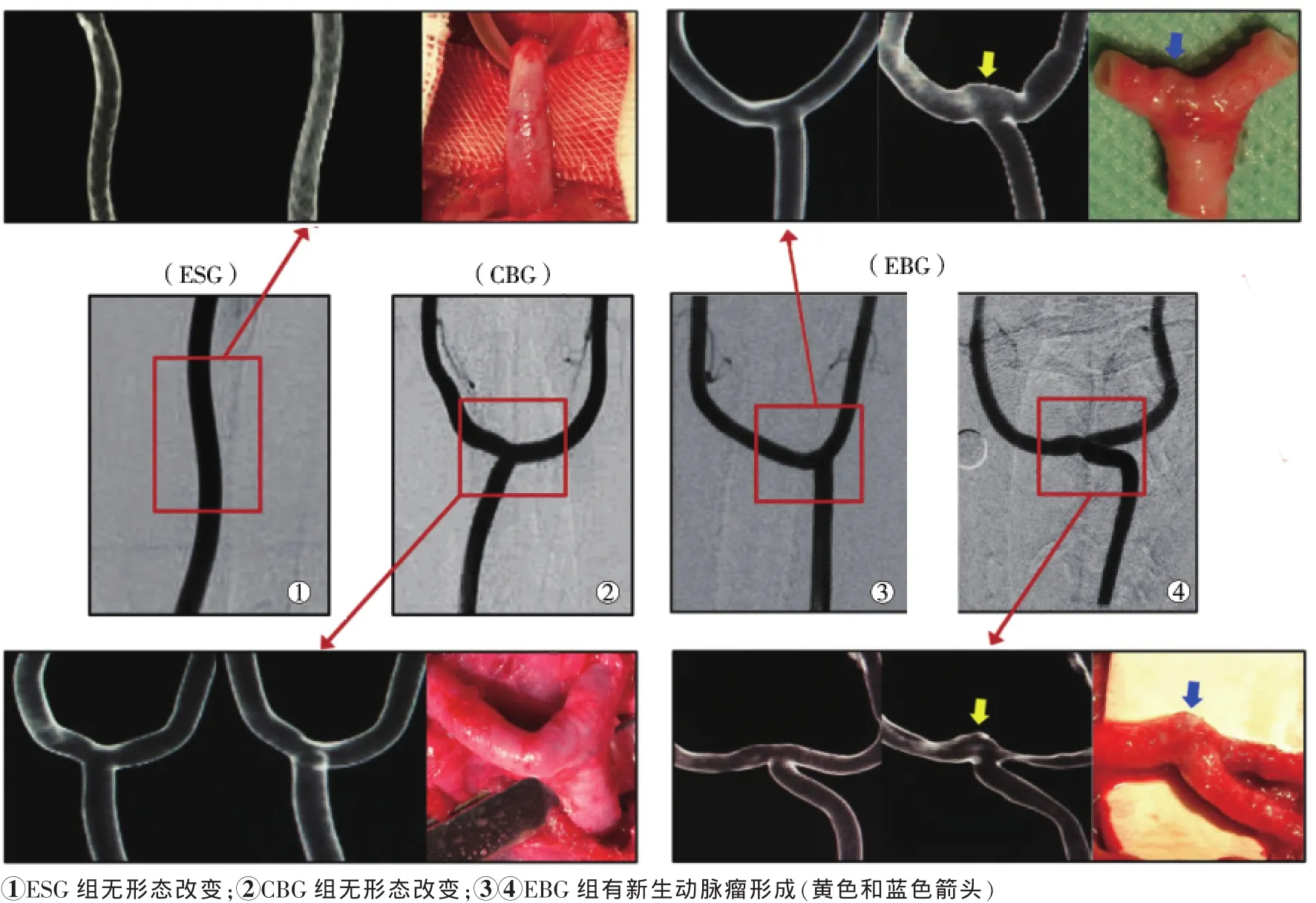
图1 术后二维、三维DSA随访图像和大体解剖图

表1 3组犬模型相关信息总结
2.2 动脉壁组织学改变
活体组织观察形成动脉瘤的5个CCA分叉样本,发现整个血管壁变薄,呈半透明状态,并能观察到内部血流,因而易致使变薄的血管壁膨出,形成分叉部动脉瘤。HE、Masson染色显示 ESG组和EBG组分叉部中膜变薄,平滑肌细胞减少,纤维连接缺失。弹力纤维染色显示ESG组和EBG组IEL不连续,弹力纤维断裂;CBG组3只犬CCA分叉顶部出现内膜轻度损伤。弹力蛋白酶作用降低了中膜弹力纤维层厚,在EBG组、ESG组和CBG组分别为(21.2±15.3)μm、(71.3±19.5)μm和(119.4±29.9)μm(P<0.001)。
免疫组化染色显示,EBG组CCA分叉顶部血管壁α-SMA阳性平滑肌细胞数量减少,PCNA阳性平滑肌细胞数比例明显增加,为(42.0±15.7)%对ESG组(7.3±3.8)%、CBG组(8.0±6.3)%,P<0.001;平滑肌层变薄,(31.3±16.7)μm对ESG组(136.5±25.5)μm、CBG组(133.9±26.1)μm,P<0.001(图2);血管壁炎性细胞浸润程度为(38.4±10.6)%,与ESG组(5.1± 2.1)%、CBG组(2.9±2.4)%相比,P<0.001。巨噬细胞染色显示,EBG组血管壁内有巨噬细胞浸润,分布与白细胞相似。EBG组动脉瘤壁MMP-2表达水平为(21.0±8.7)%,与ESG组(1.2±1.4)%、CBG组(0.8± 1.2)%相比,P<0.001;MMP-9表达水平为(13.6±5.6)%,与ESG组(0.9±0.8)%、CBG组(0.4±0.6)%相比,P<0.001(图3)。
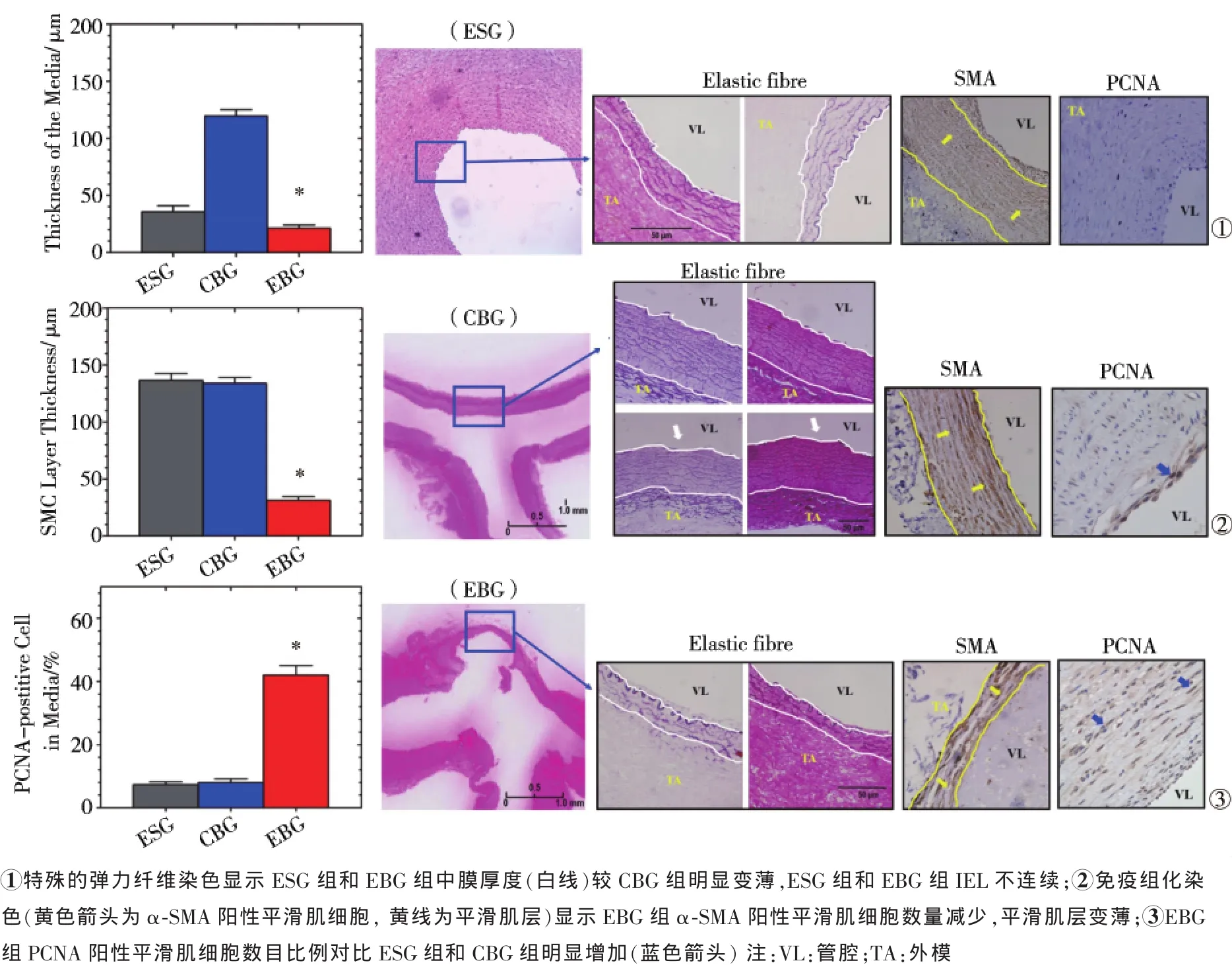
图2 动脉壁组织学改变
2.3 CFD分析
结扎对侧CCA后,分叉载瘤CCA内血流速度由(85.3±7.5)cm/s增长至(128.8±13.1)cm/s。术后CFD分析显示CBG组和EBG组载瘤动脉壁WSS增高,分叉根部区域处于更为复杂的血流动力学环境;分叉顶部WSS减低、血流速度减慢,沿分叉顶部往两侧WSS和血流速度均先增大至最大值,而后下降至与直段动脉相近;分叉顶部相对压力和总压力最高,然后再向动脉分支方向减低至正常值。
术后即刻和术后24周ESG组、CBG组与EBG组中4只未出现形态学改变的模型WSS、血流速度、流线场、表面相对压力场和总压力场参数相似(图4①)。定量分析EBG组中5只产生动脉瘤模型WSS和WSSG显示,术后24周发生明显下降,2mm处平均WSS由(13.74±2.82)Pa/mm降至(5.48±1.14)Pa/mm(P<0.01),1 mm处WSSG由(7.19±3.87)Pa/mm降至(0.85±1.12)Pa/mm(P=0.01),致使囊状动脉瘤形成(图4②③),随访过程中相对压力和总压力也降低;EBG组动脉瘤形成模型WSS(多在2 mm处)、WSSG(0~2mm处)值通常较无动脉瘤形成模型高(图4④)。具有较高WSS、WSSG值的血管壁经血管造影和组织学检查证实均有管壁再塑形改变。由于形成动脉瘤的分叉模型角度较大,分叉顶部邻近血管壁往往有较高的WSS、WSSG值。
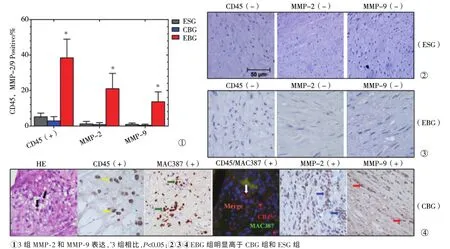
图3 免疫组化染色定量炎性增殖细胞(CD45+/MAC387+)显示MMP-2和MMP-9表达
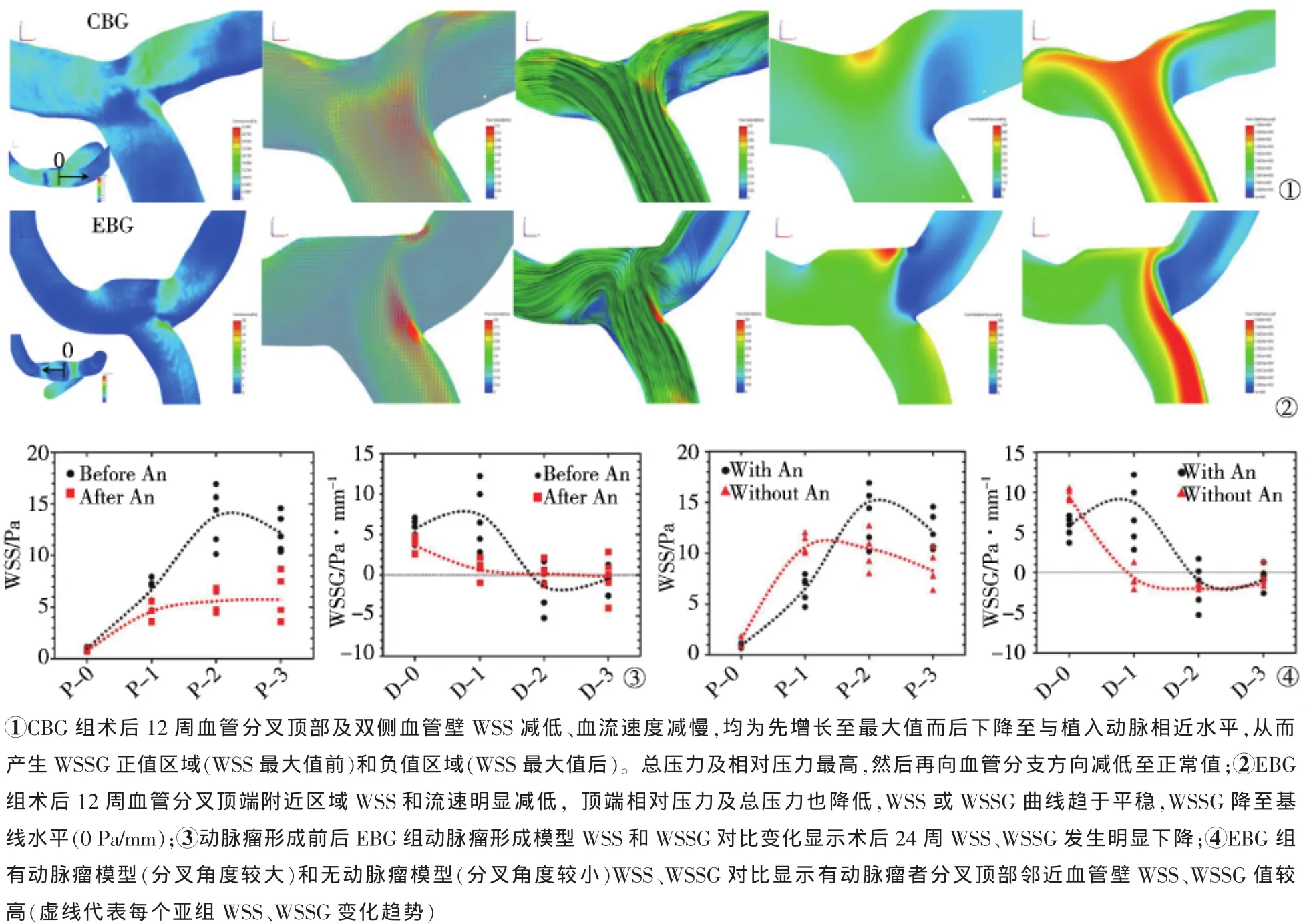
图4 CBG组和EBG组术后12周、24周CFD分析
3 讨论
对动脉瘤发生发展病理学机制的深入研究,使得建立数学模型分析血管性病变发展成为可能。2007年,Meng等[5]通过建立CCA Y形分叉模型发现,高WSS或WSSG值与组织学损伤有关,而管壁损伤并未发展成为动脉瘤。2008年,Gao等[6]通过结扎兔双侧颈内动脉改变血流动力学引发了颅内新生动脉瘤,这与基底动脉血流增加有关。还有一些研究显示动脉分叉部复杂的血流动力学可诱发与人体动脉瘤形成类似的分子水平改变,如高WSS、WSSG区域内皮型一氧化氮合酶(eNOS)减少,CD68缺乏,MMP-2、MMP-9、诱导型一氧化氮合酶(iNOS)、白细胞介素(IL)-1β增加[3-4,7],这表明血流动力学改变从分子水平可能促进了动脉瘤形成。
许多研究证明,除持续血流外,导致血管壁退化的因素是颅内动脉瘤发生的最重要环节[8]。我们在实验中通过弹力蛋白酶诱发IEL和中膜弹力纤维损伤导致血管壁退化,血流冲击引发肌层退化,建立分叉模型模拟分叉部血流动力学环境,结扎对侧CCA增加血流流速,旨在观察CCA分叉部血流动力学改变伴血管壁退化、血流流速增加对犬动脉瘤发生的作用。前期实验中我们发现用弹力蛋白酶消化血管壁内膜极易导致血栓形成,故改用消化外膜方式选择性损伤IEL和弹力纤维模拟血管壁退化;结果表明,犬颈动脉分叉模型顶端经弹力蛋白酶消化所致动脉壁退化可引起新生动脉瘤形成[9]。本实验很关键的是,通过尽可能多去除外膜来加强弹力蛋白酶渗透。
术后24周血管造影及组织病理学检查确认EBG组5/9犬模型成功诱发动脉瘤,因而动脉壁退化加上血流动力学改变可能会有效地诱发动脉瘤。动脉瘤发生及增大是血管壁重塑的一种形式,通过炎性细胞浸润、MMP活动性增加、细胞外基质蛋白合成及平滑肌细胞凋亡抵消了血流改变引起的机械力刺激[10]。炎性细胞浸润表现为动脉壁中膜出现抗CD45抗体染色泛白细胞,在人和动物颅内动脉瘤内也可观察到这一改变[11],证明炎性细胞浸润在动物模型动脉瘤发生中起重要作用,尤其是在动脉瘤形成早期阶段。MMP-2和MMP-9在动脉壁也有表达,通过控制胶原酶活性可降解血管壁细胞外基质成分,如弹力蛋白和胶原蛋白Ⅳ[12]。综合考虑以上研究结果,MMP可能是由炎性细胞释放,MMP-2和MMP-9在动脉瘤进展中发挥重要作用。
本实验虽然对所有模型均通过弹力纤维损伤模拟动脉壁退化,但仅在5/9模型中出现新生动脉瘤。我们认为CCA分叉角度是重要影响因素,T形分叉角度(146.80°±40.84°)比Y形分叉角度(87.25°± 18.87°)更易发生动脉瘤。分叉角度与高速的血流速度和分散的涡流强度紧密相关,角度越大,分叉顶部周围涡流强度越大,层流紊乱,从而产生各种机械刺激如WSS和WSSG[13]。本实验对CCA分叉部WSS和WSSG定量分析证明,较大动脉瘤形成前分叉顶部周围WSS和WSSG较高。WSS或WSSG增高可损伤正常血管内皮功能,激发基因转录,激活离子通道,从而导致细胞骨架重组[3,14]。6个月后与大量结构重塑同时出现的还有MMP-2和MMP-9增加。这些因素均与动脉瘤形成相关[15]。
然而,本实验建立的CCA Y形分叉模型还不能完全模拟真正的颅内动脉瘤模型,因为该模型动脉全层均有损伤,这取决于弹力蛋白酶给药方式与真正颅内动脉瘤形成机制存有差别,而真正的颅内动脉瘤形成是内膜损伤在前。此外,颅内动脉与颅外动脉相比具有特定解剖和生理特点,如内膜层厚,内弹力层发达而中膜和外膜较薄,仅有少量弹力纤维,甚至没有外弹力膜,平滑肌细胞比例较大,其中最重要的是颅内动脉所处脑脊液环境,而本实验模型无法完全模拟之。
总之,本实验建立的较为接近人类动脉的犬CCA Y形分叉模型模拟了人体分叉部构筑,通过弹力蛋白酶诱发IEL及中膜弹力纤维损伤导致的血管壁退化,并在分叉部顶端模拟流速增加的血流动力学行为,在低WSS/WSSG和高压力作用下成功诱发动脉瘤形成。该模型有助于研究动脉瘤发生发展过程的病理生理机制,可用于进一步研究动脉瘤相关基因、蛋白或生理通道等对动脉瘤发生发展和破裂的作用。
[1] Molyneux A,Kerr R,Stratton I,et al.International subarachnoid aneurysm trial(ISAT)of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms:a randomised trial[J].Lancet,2002,360:1267-1274.
[2] Hashimoto T,Meng H,Young WL.Intracranial aneurysms:links among inflammation,hemodynamics and vascular remodeling[J]. Neurol Res,2006,28:372-380.
[3] 王 珏,赵玉武,李明华,等.多发性颅内动脉瘤破裂的危险因素分析[J].介入放射学杂志,2014,23:1-4.
[4] Li YS,Haga JH,Chien S.Molecular basis of the effects of shear stresson vascular endothelial cells[J].JBiomech,2005,38:1949-1971.
[5] Meng H,Wang Z,Hoi Y,et al.Complex hemodynamics at the apex of an arterial bifurcation induces vascular remodeling resembling cerebralaneurysm initiation[J].Stroke,2007,38:1924-1931.
[6] Gao L,Hoi Y,Swartz DD,et al.Nascent aneurysm formation at the basilar terminus induced by hemodynamics[J].Stroke,2008, 39:2085-2090.
[7] Norman PE,Powell JT.Site specificity of aneurysmal disease[J]. Circulation,2010,121:560-568.
[8] Sadamasa N,Nozaki K,Hashimoto N.Disruption of gene for inducible nitric oxide synthase reduces progression of cerebral aneurysms[J].Stroke,2003,34:2980-2984.
[9] 王 珏,赵玉武,朱悦琦,等.颈动脉分叉部动脉瘤模型的建立[J].介入放射学杂志,2015,24:231-235.
[10]Wang J,Tan HQ,Zhu YQ,et al.Complex hemodynamic insult in combination with wall degeneration at the apex of an arterial bifurcation contributes to generation of nascent aneurysms in a caninemodel[J].AJNR Am JNeuroradiol,2014,35:1805-1812.
[11]Tulamo R,Frösen J,Hernesniemi J,et al.Inflammatory changes in the aneurysm wall:a review[J].JNeurointerv Surg,2010,2: 120-130.
[12]Aoki T,Kataoka H,Morimoto M,etal.Macrophage-derivedmatrix metalloproteinase-2 and-9 promote the progression of cerebral aneurysms in rats[J].Stroke,2007,38:162-169.
[13]Markl M,Wegent F,Zech T,et al.In vivo wall shear stress distribution in the carotid artery:effect of bifurcation geometry, internal carotid artery stenosis,and recanalization therapy[J]. Circ Cardiovasc Imaging,2010,3:647-655.
[14]Sharma R,Yellowley CE,Civelek M,et al.Intracellular calcium changes in rat aortic smooth muscle cells in response to fluid flow[J].Ann Biomed Eng,2002,30:371-378.
[15]Negishi M,Lu D,Zhang YQ,et al.Upregulatory expression of furin and transforming growth factor-beta by fluid shear stress in vascularendothelial cells[J].Arterioscler Thromb Vasc Biol,2001, 21:785-790.