制氢过程中一氧化碳氧化反应的局部非线性行为分析
张 蕾
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
氢能源和传统的能源相比较有诸多的优点,它更清洁,燃烧的产物只有水,它的能量利用率更高,单位质量的氢气比其他的能源所产生的能量也更高[1-3]。但是由于氢的储存和输运具有危险性,在线制氢成为一种有效的途径。在线制氢一般通过液体有机燃料、天然气重整或部分氧化,辅助以水煤气变换反应等制得。由于富氢气体中含有微量的CO会使反应催化剂中毒。因此富氢气体需要脱除其中的CO。在脱除CO 的各种方法中,CO 氧化反应最为简单经济。其中CO 在贵金属催化剂作用下催化氧化一直是研究的热点问题[4-5]。钯(pd)族金属是一种比较常见的CO 催化氧化载体,近年来,有关金属氧化物上负载钯族金属催化剂的开发研制与应用已取得了较大进展,但迄今为止该类催化剂一般仍需要较高的反应温度才能达到理想的消除效果。除此之外,CO 在pd(111)催化氧化过程中反应速率存在许多非线性现象,比如滞后现象,在给研究带来困难的同时,也带来了新的研究机遇与思路,因此对于这种滞后形成机制的研究无疑对于CO 反应速率的观测与控制有着重要意义。近几年,CO 在铂族金属催化氧化的非线性动态和稳定点的分岔现象引起了广泛的研究。Hua 等[6]人从蒙特卡洛模拟的角度对催化剂表面的分岔与滞后现象进行了研究;Bar[7]基于双因素的LH 机制研究了CO 在pd(111)催化氧化的不稳定现象;Wehner[8]研究了Ir(111)表面的CO 催化氧化滞后动力学;Mousa[9]研究了单晶合金PdCu(110)表面的催化氧化反应,并通过质谱反应速率测量装置发现了CO 催化氧化的双稳性;Liu[10]证明了在超真空条件下,单晶的Pd(100)表面存在稳定点的分岔状态。Pavlenko[11]证明了pt金属表面吸附的CO 向外扩散是导致这种多稳性的原因;近期的研究通过实验研究了CO 氧化反应的多稳定性与分岔特性[12]以及CO 氧化反应分岔行为的几何规律[13]。本文在文献[13]的基础上基于CO 氧化反应的几何规律,进一步预测CO 氧化反应的多种物理现象,希望为制氢过程中CO 氧化反应的实验研究和工程应用研究提供指导。
1 几何模型
用平均场的方法描述CO 在催化剂钯的催化氧化,其稳态方程为

式中 nco、no2——CO 和O2的表面浓度;
so2、sco——CO 和O2在催化剂钯表面的粘着概率;
Y——CO 和O2的组分比例;
kdes、krea——CO 和O2在催化剂钯表面的解
吸速率和反应速率。用Arrhenius 定律来描述
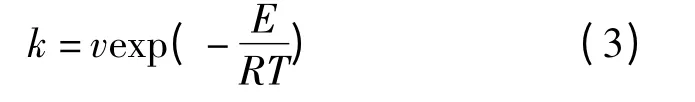
式中
E——活化能;
v——指前系数;
R——气体常数。
此函数描述了CO 和O2在催化剂钯表面的吸附速率,解吸速率和反应速率,可用来描述CO 在催化剂钯表面的催化氧化的分岔行为。

通过解方程(1)中氧的浓度nO2,得到带入方程(2)中,得到一个关于CO 浓度的四阶多项式


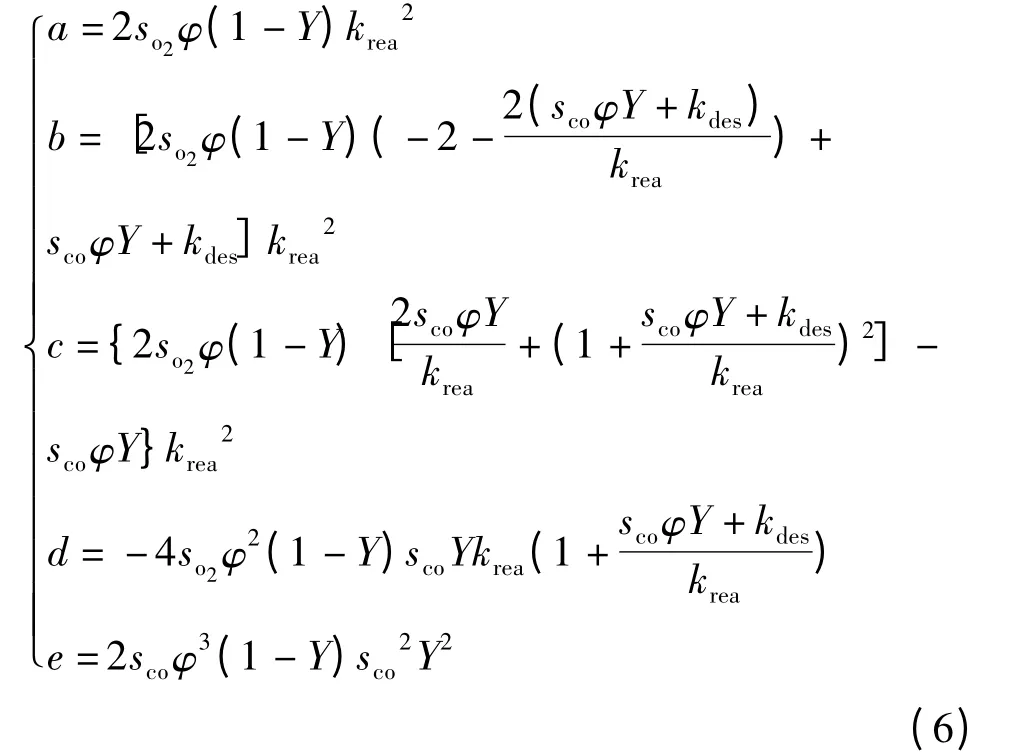
为了简化此方程,引入如下参数根据文献[13],方程(5)变为
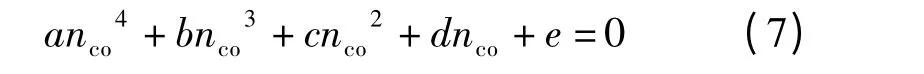
根据奇异理论,定义势函数U

积分得到

定义微分同胚
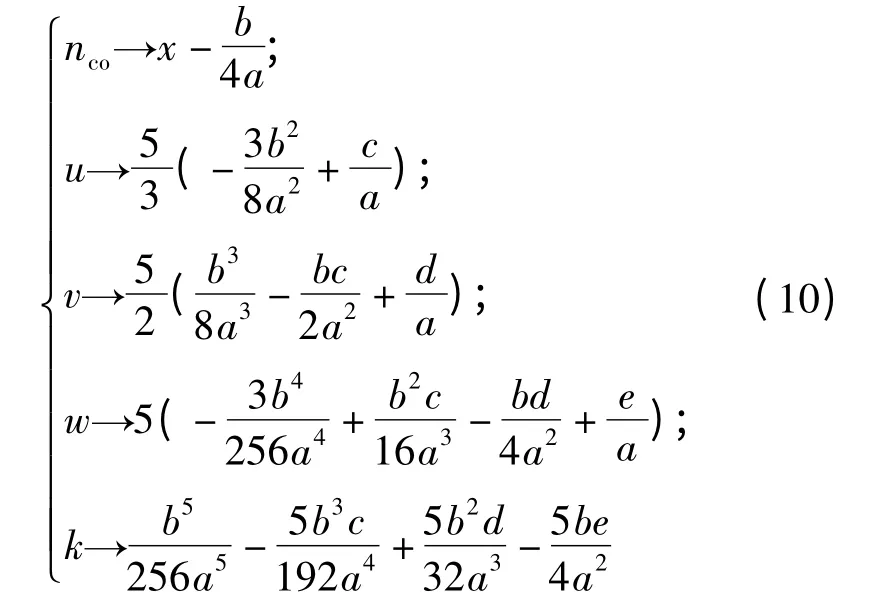
得到了势函数U 的标准形式
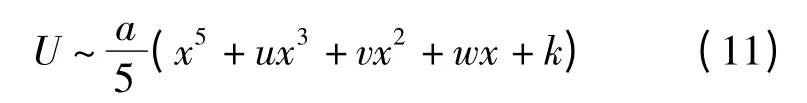
显然可见,方程(11)为燕尾突变型势函数U。其平衡曲面M 为
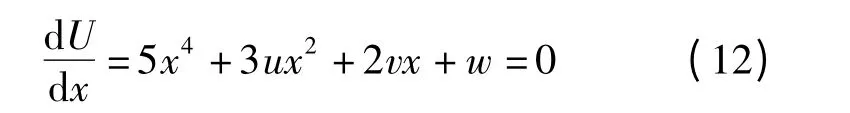
奇点集S 为
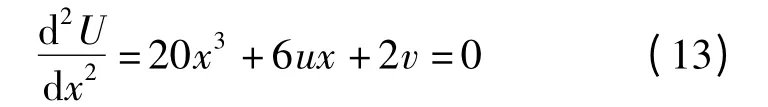
由方程(12)和方程(13)可以直接消去x 而得到分岔点集B 的方程,它是三维控制空间中的一个曲面。因此,根据文献[13],用上述几何分析方法,得到了CO 催化氧化反应所属的奇异分类为有3 个余维数的燕尾奇异类型。因此,燕尾突变模型的模型结构可用来描述CO 催化氧化反应的分岔行为。
2 非线性行为分析
几何学模型是用几何概念描述物理系统的物理规律,它是对一类系统的物理相似性的数学描述,所构造的其中一个代表性的几何结构被称为规范型或标准模型。这个规范型模型所具有的几何性质也就是它所对应某一具体物理系统的几何性质。如图1(a)给出了燕尾突变模型的一条突变边界线,根据该标准几何模型的几何性质,预测实际物理系统也存在类似的突变边界。基于这一理论指导,图1(b)给出了CO 氧化反应的突变边界线,它和图1(a)中的突变边界线均为封闭的曲线。这种由理论预测的几何相似性以及所计算出来的CO 氧化反应突变边界可以用于分析反应过程可能出现的系统行为。

图1 CO 氧化反应突变边界和标准几何模型中突变边界的几何相似性
众所周知,突变边界是临界点的组合,一旦任何控制路径经过突变边界,就会有滞后和突变发生。因此,突变边界的几何结构可用来研究CO 氧化反应中的非线性行为。
根据图1(b)所示的CO 氧化反应的突变边界,可以预测系统的多种滞后行为。如图2 给出了沿着路径Ⅰ系统状态参数随着控制参数的变化。可以看出,当温度T 较低时,化学反应速度较慢,当温度逐渐增加到一个临界值时,化学反应速率有一个突然的增加,系统呈现突变的属性。此时,如果降低温度,反应速率不会沿原路径返回,而是仍处于较高的反应速度水平,直到温度降低到又一个临界值,反应速率又突然降低到较低水平并在一定范围内维持,系统因此呈现滞后的属性。
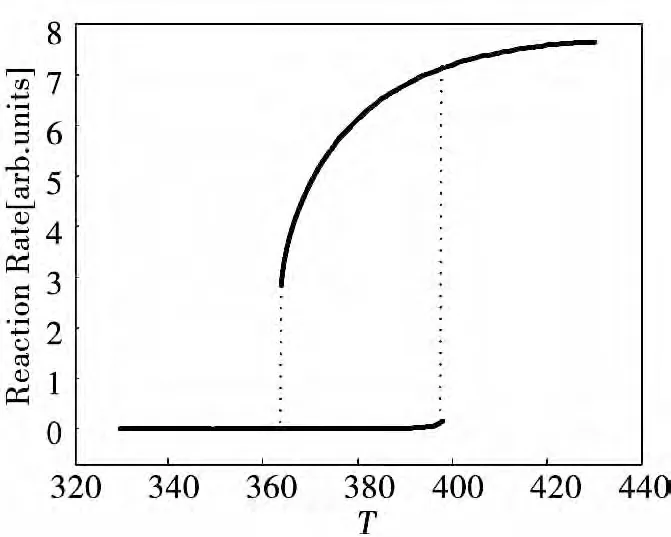
图2 反应速率沿路径Ⅰ的变化曲线
图3 给出了沿着路径Ⅱ系统状态参数随着控制参数的变化。可以看出,当CO 和O2的组分比例Y较低时,化学反应速度较高,当Y 逐渐增加到一个临界值时,化学反应速率有一个突然的下降,系统呈现突变的属性。此时,如果降低Y,反应速率同样不会沿原路径返回,直到降低到又一个临界值,反应速率又突然返回到较低的速度并在一定范围内维持,系统呈现出了类似图2 的滞后行为。

图3 反应速率沿路径Ⅱ的变化曲线
图4 给出了沿着路径Ⅲ系统状态参数随着控制参数的变化。可以看出此时系统呈现出了与图2、图3 不同的系统行为。沿着路径Ⅲ,控制变量T 和Y 同时改变,为了描述方便,图4 只绘制了反应速率随Y 的变化。可以看出,当Y 较低时,化学反应速度较高,当Y 逐渐增加到一个临界值时,化学反应速率有一个突然的下降。此时进一步增加Y,化学反应速率保持在低速阶段直到它增加到另一个临界值,此时反应速率反而有一个再次突变上升的现象。在此之后如果降低Y,反应速率同样不会沿原路径返回,直到降低到又一个临界值,反应速率又突然返回到较低的速度并在一定范围内维持。而进一步的降低Y 则又会在另一个临界点过后,化学反应速率又再次有一个突然上升的过程。在这些过程中伴随了两个滞后现象的出现,系统因此出现了较为复杂的滞后行为。从动力系统理论的观点来看,突变和滞后行为的出现源自于系统稳定性的变化,即系统存在不稳定的正反馈机制,从而造成反应速率的跃变,在此过程中系统能量耗散的不可逆性又使得系统外在呈现出了滞后行为。本文所预测CO 氧化反应的多种物理现象,希望为制氢过程中CO 氧化反应的实验研究和工程应用研究提供指导。
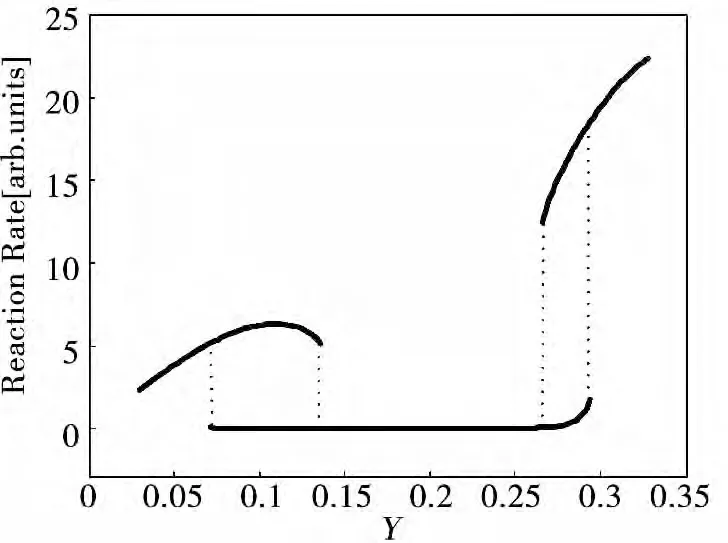
图4 反应速率沿路径Ⅲ的变化曲线
3 结论
本文基于已有的CO 氧化反应几何学模型得到化学反应速率突变边界的局部几何性质,根据该几何性质,预测出CO 氧化反应过程中可能出现的几种较为特殊的非线性滞后行为,这些滞后行为的存在将会对工业制氢过程中过程管理系统产生较大影响,理解和掌握这些特殊的非线性行为将有助于设计安全高效的过程控制策略。
[1]邢春礼,费颖,韩俊,等. 氢能与燃料电池能源系统[J].节能技术,2009,27(3):287 -290.
[2]王建涛,李柯,禹静.生物制氢和氢能发电[J].节能技术,2010,28(1):56 -59.
[3]贾同国,王银山,李志伟.氢能源发展研究现状[J].节能技术,2011,29(3):264 -266.
[4]张晓东,曲振平,于芳丽,王奕.纳米银催化剂上CO氧化反应研究进展[J].催化学报,2013,34(7):1277 -1284.
[5]孙敬方,张雷,葛成艳,等. 董林固相浸渍法和湿浸渍法制备CuO/CeO2催化剂及其CO 氧化性能的对比研究[J].催化学报,2014,35(8):1347 -1353.
[6]Hua DY,Ma YQ.Hysteresis phenomena in CO catalytic oxidation system in the presence of inhomogeneities of the catalyst surface[J].Phys Rev E,2002(66):066103.
[7]Bär M,Zülicke C,Eiswirth M,Ertl G.Theoretical modeling of spatiotemporal self -organization in a surface catalyzed reaction exhibiting bistable kinetics[J]. J Chem Phys,1992(96):8595 -8604.
[8]Wehner S,Baumann F,Küppers J.Kinetic hysteresis in the CO oxidation reaction on Ir(111)surfaces[J]. Chem Phys Lett,2003(370):126 -131.
[9]Mousa MS,Hammoudeh A,Loboda - Cackovic J,Block JH. The CO oxidation on Pd - rich surfaces of PdCu(110):Hysteresis in reaction rate[J]. J Mol Catal A,1995(96):271 -276.
[10]Liu D,Evans JW. Chemical diffusion of CO in mixed CO+O adlayers and reaction-front propagation in CO oxidation on Pd(100)[J].J Chem Phys,2006(125):054709.
[11]Pavlenko N,Evans JW,Liu D,Imbihl R. Catalytic CO oxidation on nanoscale Pt facets:Effect of interfacet CO diffusion on bifurcation and fluctuation behavior[J]. Phys Rev E,2001(130):016121.
[12]Karpitschka S,Wehner S,Küppers J.Reaction hysteresis of the CO + O→CO2reaction on palladium(111)[J]. J Chem Phys,2009(130):054706.
[13]Tao Cui,ShunLin Tang,Lei Zhang,DaRen Yu.Swallowtail model for predicting the global bifurcation behavior of CO oxidation reactions[J]. Science China Chemistry,2011,54(7):1072 -1077.

