响应面法优化石榴皮多酚提取工艺研究
唐远谋,周金洋
(1.成都大学临床医学院,四川 成都 610106;2.西华大学 食品与生物工程学院,四川 成都 610039)
响应面法优化石榴皮多酚提取工艺研究
唐远谋1,周金洋2
(1.成都大学临床医学院,四川 成都 610106;2.西华大学 食品与生物工程学院,四川 成都 610039)
对石榴皮中多酚的提取工艺进行了优化研究.探讨了提取溶剂、乙醇浓度、分离目数、提取时间、料液比和提取温度对石榴皮中多酚提取的影响,并利用响应面法对提取工艺进行了优化.结果表明:当乙醇浓度为72%、提取温度为86℃、料液比为1∶26(w∶v),提取2.5 h,石榴皮中多酚含量最大值为209.055 mg/g.
石榴皮;多酚;提取;响应曲面法
0 引言
石榴作为一种水果,其产地遍布我国四川、云南、安徽、山东与陕西等地,市场上各类石榴加工产品也层出不穷.但在石榴产品的加工过程中,石榴皮几乎都被丢弃,这不仅造成严重的资源浪费,且还对环境造成污染.研究表明,石榴皮中富含多酚类物质,其具有抗氧化、抑菌、抗突变及抗肿瘤等功能[1-4],可广泛应用于食品、医药和日用化学品领域.
响应曲面法(Response Surface Method,RSM)是一种优化生物过程的统计学实验设计方法[5],其中,Box-Behnken响应曲面分析是一种常用的响应面分析法,利用该方法不仅可以建立连续变量的曲面模型,还可以对影响生物过程的因子及其交互作用进行评价.与传统优化方法相比,RSM所需的试验组数相对较少,能确定最佳水平范围,所得结果最优.因此,为了获得最佳的工艺参数,本研究拟采用RSM对石榴皮中多酚的提取工艺进行优化,为实现石榴资源的综合利用及深度开发其副产品提供参考.
1 材料与方法
1.1 材料与仪器
1.1.1 材 料.
实验所用材料包括:石榴皮(成都中药饮片公司),福林—酚试剂(北京奥博星生物技术有限责任公司),其他试剂均为实验室常用试剂(成都科龙化工试剂厂),分析纯.
1.1.2 仪 器.
实验所用仪器包括:DHG-9070A型电热恒温鼓风干燥箱(上海齐欣科学仪器有限公司),ST-02A型多功能粉碎机(永康帅通工具有限公司),80目分样筛(沈阳沈河架线器材厂),TB-214型电子天平(美国丹佛仪器设备厂),HH-S型数显恒温水浴锅(金坛金城国胜实验仪器厂),SHZ-D(Ⅲ)型循环水式真空泵(巩义子华仪器有限公司),UV-2600型紫外可见分光光度计(上海尤尼柯仪器有限公司).
1.2 实验方法
1.2.1 石榴皮中多酚提取工艺流程.
石榴皮中多酚提取工艺流程为:石榴皮→干燥至恒重→粉碎过筛→溶剂提取→抽滤→多酚含量测定.
在“溶剂提取"流程中,首先,通过单因素实验,锁定其他提取参数,逐级考查不同的提取溶剂、乙醇浓度、分离目数、提取时间、料液比和提取温度对石榴皮中多酚提取的影响;然后,在单因素实验结果的基础上,固定其他最佳单因素结果参数,选取对石榴皮多酚提取结果影响较大且好操控的3因素,在其附近各选取3水平进行Box-Behnken响应面分析.
1.2.2 多酚含量的测定.
多酚含量的测定采用福林—酚比色法[6],即:取1 mL样品液加到10 mL比色管中,依次加入去离子水1 mL、福林—酚试液0.5 mL、26.7%碳酸钠溶液1.5 mL,然后用水定容至10 mL,室温下反应2 h,在760 nm下测定其吸光度.测得的吸光度代入标准曲线,y=0.0081x+0.0286,相关系数,R2=0.9999,求得试样中多酚含量,计算公式为,
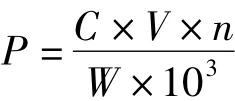
式中,P为多酚含量,mg/g;C为由回归方程计算得到样品中多酚类物质的质量浓度,μg/mL;n为稀释倍数;V为溶液体积,mL;W为投料量,g.
2 结果与分析
2.1 提取溶剂的筛选
用电子天平精确称取粉碎后过80目筛的石榴皮粉样品5.000g,分别用水、70%的甲醇、乙醇、丙酮溶液作为溶剂,采用溶剂水浴浸提,提取时间为2 h,料液比为1∶20,提取温度为80℃,实验结果如图1所示.
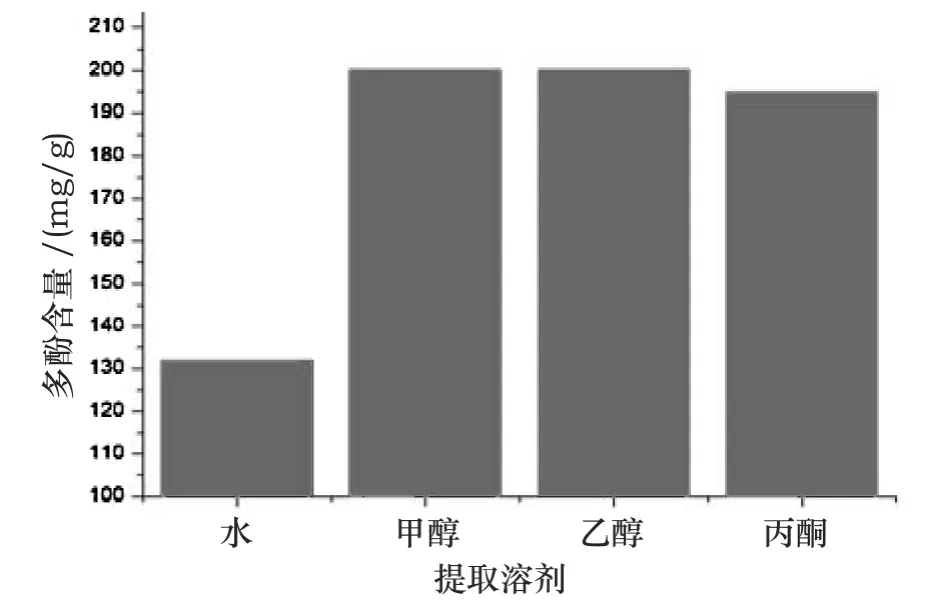
图1 溶剂对石榴皮中多酚提取的影响
由图1可知,提取溶剂为甲醇时,石榴皮中多酚提取率最高,乙醇次之.由于甲醇潜在的毒性,加之乙醇作为提取溶剂时,石榴皮中多酚得率与甲醇作为提取溶剂相当,故选取乙醇作为提取溶剂.
2.2 单因素实验结果与分析
2.2.1 乙醇浓度对石榴皮中多酚提取的影响.
参照“2.1”项下的方法,固定其他提取参数,分别采用浓度为10%、30%、50%、70%、90%的乙醇提取,实验结果如表1所示.
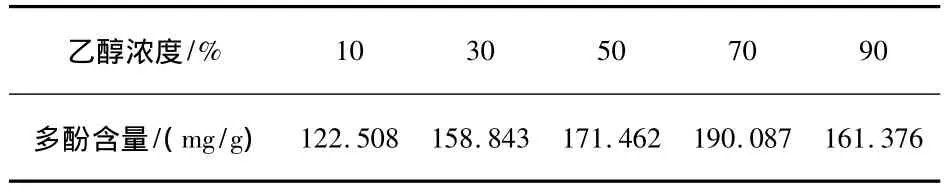
表1 乙醇浓度对提取结果的影响
由表1可知,当乙醇浓度为70%时,石榴皮中多酚的含量最高,故选取70%的乙醇作为提取溶剂.
2.2.2 筛目目数对石榴皮多酚提取的影响.
取乙醇溶度为70%,其他条件如“2.2.1”项,石榴皮粉碎后改变筛目大小,实验结果如表2所示.
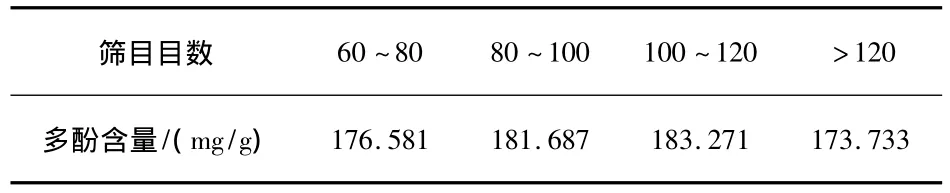
表2 筛目目数对提取结果的影响
不同的筛目孔径得到的石榴皮粉末在提取过程中可能与提取溶剂的接触面积相关.由表2可知,当筛目目数为100~120时,石榴皮中多酚的含量最高,故筛目目数选取为100~120.
2.2.3 提取时间对石榴皮中多酚提取的影响.
筛目目数为100 ~120,其他条件如“2.2.2”项,改变提取时间,实验结果如表3所示.
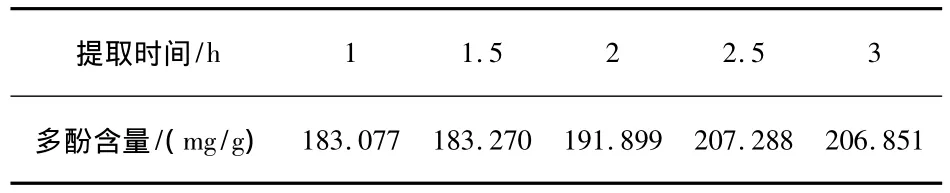
表3 提取时间对提取结果的影响
由表3可知,当提取时间为2.5 h时,石榴皮中多酚的含量最大.当提取时间超过2.5 h后,石榴皮中多酚含量有所减少,这可能是由于石榴皮中多酚部分被氧化所致.
2.2.4 料液比对石榴皮中多酚提取的影响.
提取时间为 2.5 h,其他条件如“2.2.3”项,改变料液比,实验结果如表4所示.

表4 料液比对提取结果的影响
料液比的不同可能造成石榴皮粉末与提取溶剂的接触面积不同,从而影响石榴皮中多酚含量.由表4可知,当料液比为1∶25时石榴皮中多酚含量最高.
2.2.5 提取温度对石榴皮中多酚提取的影响.
料液比为1∶25,其他条件如“2.2.4”项,改变提取温度,实验结果如表5所示.
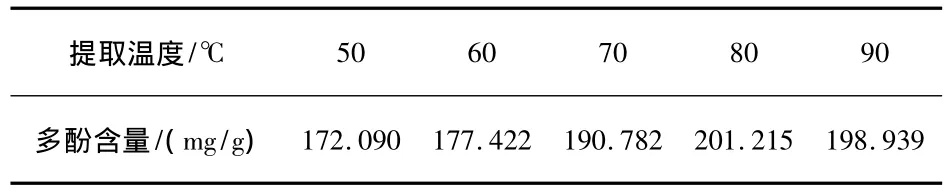
表5 提取温度对提取结果的影响
由表5可知,当提取温度为80℃时,石榴皮中多酚含量最高.过低的温度不能满足石榴皮中多酚从石榴皮粉末中全部溶出,而过高的温度可能会加速石榴皮中多酚的氧化.
2.3 RSM结果与分析
通过单因素实验结果可知,在选取的6个单因素中,乙醇浓度、提取温度和料液比对石榴皮中多酚的提取影响较大,故选择这3个因素做Box-Behnken设计,同时以石榴皮中多酚含量为响应值,实验辅助软件采用Design Expert 8.0,实验结果如表6、7所示.

表6 Box-Behnken设计实验因素水平及编码
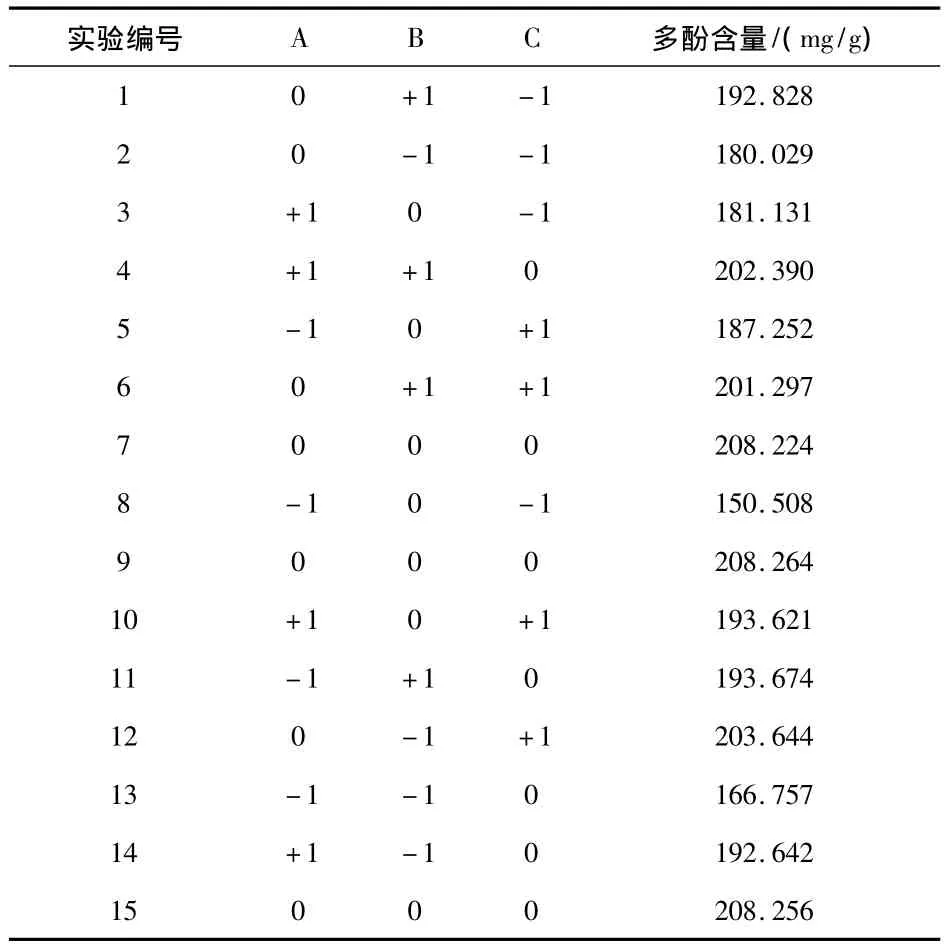
表7 Box-Behnken设计
利用Design Expert 8.0软件对上述结果进行分析,经过拟合,得石榴皮中多酚含量(Y)对乙醇浓度(A)、提取温度(B)、料液比(C)的二次多项回归方程为,
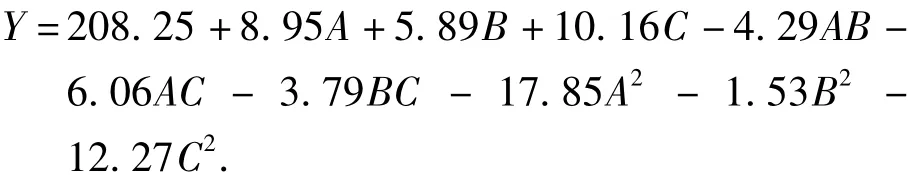
实验所选用模型的p值为0.0033,极显著(p<0.05).模型的确定系数R2=0.9672,模型的调整确定系数R2adj=0.9083,此表明该模型拟合程度良好,实验误差小,且该模型能解释90.83%响应值的变化,完全可用此模型对石榴皮多酚提取工艺进行分析和预测.
回归模型的方差分析如表8所示.
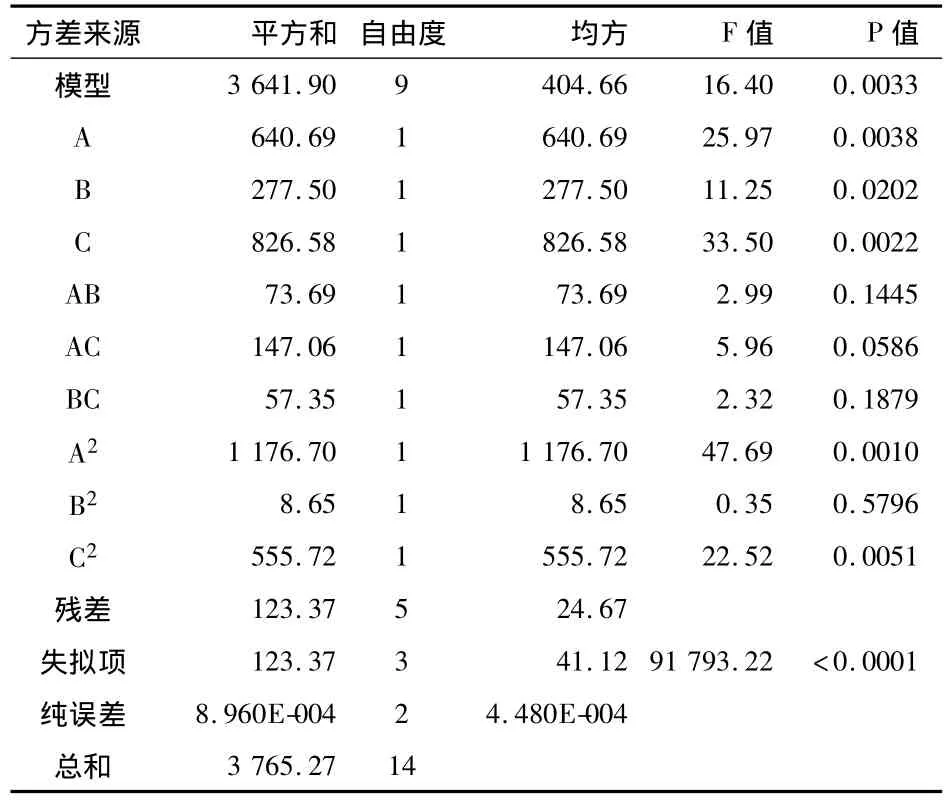
表8 回归模型方差分析结果
响应面图形是响应值对各实验因子X1、X2、X3所构成的三维空间的曲面图,根据回归方程做出不同因子的响应面分析如图2~4所示.

图2 乙醇溶度与提取温度对多酚含量的响应面图
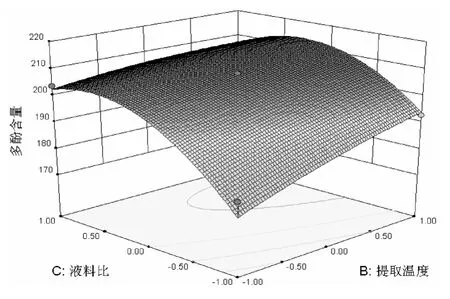
图3 提取温度与料液比对多酚含量的响应面图

图4 乙醇溶度与料液比对多酚含量的响应面图
图2~4中的等高线为各响应面三维图在底面的投影,其形状反映了交互效应的强弱大小,圆形表示两因素交互作用不显著,而椭圆形或马鞍形则表示两因素交互作用显著.由各响应面图可知,其等高线均为椭圆,说明3者彼此间交互效果均显著.由图2可知,乙醇浓度对石榴皮中多酚的提取影响不是很大,曲线表现为较为平缓,乙醇浓度在0水平左右多酚含量较大,而提取温度对石榴皮中多酚含量影响很大,表现为曲线较陡,较高的温度适宜于石榴皮中多酚的提取.从图3可看出,料液比对石榴皮中多酚提取影响不大,曲线较为平缓,此图进一步说明提取温度对石榴皮中多酚提取影响较大,表现为曲线较陡.由图4可进一步看出,乙醇浓度和料液比对石榴皮中多酚的提取影响不大,曲线都较为平缓.
2.4 验证实验
通过实验辅助软件Design Expert 8.0优化提取条件得到多酚含量大于211 mg/g的7组数据,并得到各参数范围:乙醇浓度69.5% ~74.0%,提取温度81.4℃ ~90.0℃,料液比1∶24~1∶28.考虑到可操作性,本实验选择乙醇浓度72%、提取温度86℃、料液比1∶26,即,A=0.2、B=0.6、C=0.25,代入二次多项回归方程,计算得出石榴皮中提取的多酚含量的预测值为212.696 mg/g,同时,做3次平行实验得到实验值为209.055 mg/g,相对误差小于10%,此结果说明利用响应面法优化石榴皮中多酚的提取工艺是可行的.
3 结论
通过单因素实验,确定了石榴皮多酚提取的最佳实验条件为:溶剂为乙醇,乙醇浓度为70%、提取温度为80℃、料液比为1∶25.
通过Box-Behnken响应曲面分析,确定了石榴皮中多酚提取的最佳试验条件为:乙醇浓度为72%、提取温度为86℃、料液比为1∶26.以该优化条件提取2.5 h时,从石榴皮中提取的多酚含量达到209.055 mg/g.
[1]李梦颖,李建科,于振,等.石榴多酚的提取、检测和成分分析研究进展[J].食品工业科技,2013,34(17):384 -388.
[2]田树革,魏玉龙,刘宏炳.Folin-Ciocalteu比色法测定石榴不同部位总多酚的含量[J].光谱实验室,2009,26(2):341-344.
[3]唐鹏程,焦士蓉,唐远谋.石榴皮多酚提取工艺及活性研究进展[J].西华大学学报(自然科学版),2011,30(1):98-102.
[4]彭海燕.石榴不同品种及不同部位多酚含量的比较研究[D].成都:西华大学,2012.
[5]田泱源,李瑞芳.响应面法在生物过程优化中的应用[J].食品工程,2010,38(2):8 -11.
[6]刘佳,焦士蓉,唐远谋,等.苦丁茶多酚的提取及抗氧化活性[J].食品科学,2011,32(14):134 -138.
Optimization of Polyphenols Extraction from Pomegranate Peel by Response Surface Method
TANG Yuanmou1,ZHOU Jinyang2
(1.School of Medicine,Chengdu University,Chengdu 610106,China;2.School of Food and Bioengineering,Xihua University,Chengdu 610039,China)
This paper explored the effects about extraction solvent,ethanol concentration,separation mesh,extraction time,material-liquid ratio and extraction temperature on polyphenols extraction from pomegranate peel.The response surface method(RSM)was used for optimization of the extraction process.The experimental results showed that being extracted for 2.5 h when the ethanol concentration was 72%and the material-liquid ratio was 1∶26(w∶v)at extraction temperature 86℃,the maximum polyphenol content was 209.055 mg/g.
pomegranate peel;polyphenols;extraction;response surface method
TS201.1;TS255.36
A
1004-5422(2015)01-0008-04
2015-01-23.
成都大学校青年基金(2014XJZ12)、药食同源植物资源开发四川省高校重点实验室基金(10Y201404)资助项目.
唐远谋(1986—),男,博士研究生,讲师,从事生物质转化及食品营养与安全研究.

