Kisspeptin在牛卵母细胞体外成熟过程中的表达和功能研究
贺 明,王 军,杨雨江,刘子维,刘 勋,吕文发
(吉林农业大学动物科技学院,吉林长春130118)
Kisspeptin在牛卵母细胞体外成熟过程中的表达和功能研究
贺 明,王 军,杨雨江,刘子维,刘 勋,吕文发*
(吉林农业大学动物科技学院,吉林长春130118)
Kisspeptin(Kp)是KiSS-1基因编码的产物,为明确Kp在牛卵母细胞体外成熟过程中的表达和功能,本文首先利用免疫荧光技术研究了Kp在牛卵母细胞体外成熟0、6、12、18、24 h的表达规律,随后利用体外培养技术研究了添加Kp对牛卵母细胞体外成熟的影响。结果表明:Kp在牛卵母细胞体外成熟0、6、12、18、24 h均有表达,且0~12 h表达量呈递增趋势,12~24 h下降并达到最低;在TCM-199溶液中添加10 nmol/L的Kp可使卵母细胞的成熟率达到80.3%,与同时添加FSH和FBS处理组的结果差异不显著。研究结果提示,Kp在牛卵母细胞中有表达,且在体外成熟过程中呈现规律性变化,其可提高牛卵母细胞体外成熟效率。
kisspeptin;牛卵母细胞;免疫荧光;体外成熟
Kisspeptin(Kp)是KiSS-1基因编码的一种多肤,最初于1996年LEE等人在恶性黑色素瘤细胞上发现,其作用是抑制新陈代谢[1]。2003年,科学家发现Kp在哺乳动物初情期启动上起着关键的“把门”作用[2-4]。目前研究已证实,Kp主要在下丘脑表达,其可与其特异性受体GPR54(G protein-coupled receptor 54)结合,刺激促性腺激素释放激素(GnRH)的释放,进而促进促卵泡素(FSH)和促黄体素(LH)的释放,对哺乳动物生殖活动起中枢调控作用。有研究发现,Kp除在下丘脑表达外,在卵巢也有表达[5-7]。对猪和小鼠的研究表明,Kp和GPR54在卵母细胞上有表达,添加Kp仅可促进猪卵母细胞成熟[8],但对小鼠卵母细胞成熟无作用[9]。近年来,对牛的研究表明,Kp在牛胎盘中表达且可促进胎盘子叶上皮细胞的增殖[10];注射外源Kp可促进卵泡发育[11]。但Kp在牛卵母细胞上是否有表达,其在卵母细胞成熟过程中发挥何种生物学作用,目前尚不清楚。本研究利用免疫荧光和体外培养技术,研究了Kp在牛卵母细胞体外成熟过程中的表达规律,并检测了添加外源Kp对牛卵母细胞体外成熟的影响,以期明确其功能。
1 材料与方法
1.1 试剂及培养液的配制 Kp购自Calbiochem公司;FSH购自宁波市三生药业有限公司;一抗(山羊抗体)购自Santa cruz biotechnology公司;二抗(罗丹明标记兔抗山羊抗体)购自北京中杉金桥生物技术有限公司。卵母细胞缓冲液采用HEPES,血清为胎牛血清(FBS),基础培养液为TCM-199+60 mg/L青霉素+100 mg/L链霉素,FSH处理剂量为10 μg/mL,溶液用微孔直径为0.22 μm的滤膜过滤后使用。
1.2 卵母细胞的获取 卵巢样品取自长春市清真肉业屠宰场,保存在30~36℃的生理盐水中,2~6 h内运回实验室。将样品用生理盐水清洗3次以上,采用抽吸法获取卵母细胞。用装有18号针头的注射器吸取卵巢表面2~8 mm的卵泡,将抽取的卵泡液注入在37℃水浴锅内预热的离心管中。收集全部卵泡液后,挑选3层以上卵丘细胞包裹、胞质均匀的卵丘卵母细胞复合体(COC)。
免疫荧光收集不同培养时间(0、6、12、18、24 h)的COC,用机械吹打方法去除卵丘细胞后放入到4%的多聚甲醛中固定30 min;将固定后的细胞放入含0.2%TritonX-100的PBS中渗透30 min;再放入封闭液(PBS+3%BSA+3%脱脂奶粉+0.18 mol/L甘氨酸+15%山羊血清)中封闭30 min;随后按1∶50的稀释比例在PBS中加入一抗,37℃孵育90 min;将孵育后的细胞加入按1∶200比例稀释且有荧光素(Tetraethylrhodamineisothiocyanate,Tritc)标记的二抗,37℃孵育60 min,于倒置荧光显微镜下观察染色情况。
卵母细胞体外成熟∶首先,将COC随机分为5组,1组设为对照组,用TCM-199+双抗培养,其余4组在此基础上分别添加1、10、102、103nmol/L Kp,进行卵母细胞体外培养,培养22 h后检测卵母细胞成熟率。随后,将成熟率最高组的Kp浓度作为添加Kp的最适浓度,将COC随机分为6组,分别进行以下处理∶TCM-199+Kp+双抗;TCM-199+FSH+双抗;TCM-199+FSH+Kp+双抗;TCM-199+Kp+FBS+双抗;TCM-199+FBS+双抗;TCM-199+双抗。采用6孔板培养,将挑选好的COC清洗后放入培养液中,每孔放入30~50个COC,培养液体积为800 μL,在38.5℃、5%CO2且饱和湿度的培养箱中培养成熟,每组试验重复3次。
1.3 统计分析 采用SPSS16.0统计软件对数据进行分析,利用One-Way ANOVA分析不同处理组间差异的显著性,<0.05为差异显著,<0.01为差异极显著。试验结果均以平均值±标准差表示。
2 结果
2.1 Kp在牛卵母细胞体外成熟过程中的表达规律 由图1可知,Kp在卵母细胞整个体外成熟过程中均有表达,且表达量存在明显差异,体外成熟0~12 h,Kp表达量逐渐增加,12~24 h,Kp表达量下降。
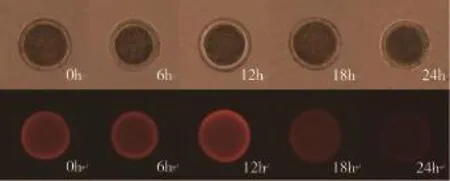
图1 Kp在牛卵母细胞体外成熟过程中的表达规律
2.2 Kp对牛卵母细胞体外成熟的影响 为明确Kp对牛卵母细胞体外成熟的作用,首先研究了1、10、102、103nmol/L的Kp对卵母细胞体外成熟率的影响。由表1可知,Kp对牛卵母细胞体外成熟的作用存在明显的剂量效应,添加10 nmol/L Kp组的卵母细胞成熟率最高,与其他4组差异极显著(<0.01),但所有添加Kp组的卵母细胞成熟率均极显著高于对照组(<0.01)。根据上述结果,确定10 nmol/L为添加外源Kp的最适浓度。
如表2所示,在无FBS的条件下,Kp组与Kp+FSH组的卵母细胞成熟率较高,且两组间差异不显著(>0.05),但均极显著高于只添加FBS组(<0.01);而同时添加FBS和Kp时,成熟率较低,与Kp组差异极显著(<0.01)。

表1 添加不同浓度Kp对牛卵母细胞体外成熟的影响

表 2Kp对牛卵母细胞体外成熟的影响
3 讨 论
本研究通过免疫荧光技术首次发现Kp在牛卵母细胞中有表达,这与以往的研究结果类似。Saadeldin等[8]利用PCR技术研究发现Kp在猪卵母细胞上表达,Rocha等[9]利用PCR技术研究发现小鼠卵母细胞减数分裂过程Kp有表达,Castellano等[12]利用免疫组化技术研究发现Kp在小鼠卵母细胞上有表达。关于Kp在卵母细胞体外成熟过程中的表达规律,对猪的研究发现,体外培养26~30 h有表达,而其他时段不表达[8];对小鼠的研究发现,启动减数分裂时卵母细胞Kp表达显著上调,而当卵母细胞发育到MI期时Kp表达量显著下降,且发育到MII期表达量进一步下降[9]。本实验研究发现,Kp在牛卵母细胞体外成熟过程中均有表达,且表达量在0~12 h增加, 12~24 h显著下降。上述结果的差异可能与物种差异有关。
免疫荧光实验结果提示,Kp可能在牛卵母细胞体外成熟过程中执行某种功能。为明确其功能,首先利用体外成熟试验研究了添加不同浓度Kp对牛卵母细胞成熟率的影响。研究结果表明,添加不同浓度的Kp均可显著提高牛卵母细胞成熟率,但添加10 nmol/L的Kp作用效果显著高于其他浓度处理,提示Kp对牛卵母细胞成熟的影响存在明显的剂量效应。而对猪的研究表明,添加不同浓度Kp(0.5×10-6、1×10-6、2×10-6、4×10-6mol/L)对卵母细胞成熟率的作用无显著差异[8],这可能是由于物种、培养液成分和剂量的选择等实验条件差异造成的。为分析添加Kp是否可用于牛卵母细胞体外成熟培养体系的优化,进一步比较了添加10 nmol/L的Kp与不同组分培养液对牛卵母细胞体外成熟率的影响,研究结果发现,与基础液添加FBS相比,基础液中单独添加10 nmol/L的Kp可显著提高牛卵母细胞成熟率,且与基础液中添加FSH和FBS结果差异不显著。研究结果提示,添加10 nmol/L的Kp可替代培养液中添加FSH和FBS进行牛卵母细胞成熟培养,即可优化牛卵母细胞体外成熟培养体系,使培养液中不含激素和血清,但要想在牛卵母细胞体外成熟培养体系中应用Kp,还需研究Kp处理获得的成熟卵母细胞在体外受精和早期胚胎发育的实际效果。
此外,本研究还发现,Kp与FBS同时添加,反而会降低卵母细胞成熟率,其原因有待于进一步研究。对猪的研究表明,培养液中同时添加FSH和Kp也可提高卵母细胞成熟率,且可上调MOS、GDF9和BMP15基因的表达量[8],而这些基因是卵母细胞发育的关键基因[13],但单独添加Kp并不能提高猪卵母细胞体外成熟率。颗粒细胞对卵母细胞成熟具有重要作用,本实验室以往研究发现,Kp可促进牛卵巢颗粒细胞增殖和孕激素的分泌[14],Kp也可能通过这一途径提高牛卵母细胞成熟率。由于相关报道极少,且现有各报道中实验条件差异较大,添加10 nmol/L的Kp促进牛卵母细胞成熟的作用机制还需要进一步研究。
4 结 论
本研究首次发现Kp在牛卵母细胞体外成熟过程中的表达呈现规律性变化,且添加外源Kp可提高牛卵母细胞的体外成熟效率。
[1] Lee J,Miele M,Hicks D,et al.KiSS-1,a novelhuman malignant melanoma metastasis-suppressor gene[J].J Natl Can I, 1996,88(23):1731-1737.
[2] de Roux N,Genin E,CarelJ,etal.Hypogonadotropic hypogonadism due to loss of function of the KiSS1-derived peptide receptor GPR54[J].P Natl Acad Sci USA,2003,100(19): 10972-10976.
[3] Funes S,Hedrick J,Vassileva G,et al.The KiSS-1 receptor GPR54 is essentialforthe developmentofthe murine reproductive system[J].BiochemBioph Res Co,2003,312(4):1357-1363.
[4] Seminara S,Messager S,Chatzidaki E,et al.The GPR54 gene as a regulator of puberty[J].NEJM,2003,349(17):1614-1627.
[5] Castellano J M,Gaytan M,Roa J,et al.Expression of KiSS-1 in rat ovary:putative local regulator of ovulation?[J].Endocrinology, 2006,147(10):4852-4862.
[6] 刘萍,王海飞,汪劲能,等.Kiss-1基因在猪初情期下丘脑-垂体-卵巢轴中的定位研究[J].安徽农业科学,2008,36(15): 6324-6327.
[7] 王军,孙蕾,周海柱,等.发情周期不同阶段KiSS-1和GPR54 mRNA在小尾寒羊卵巢上表达规律的研究[J].中国畜牧杂志,2012,48(21):32-34.
[8] Saadeldin I M,Koo O J,Kang J T,et al.Paradoxical effects of kisspeptin:it enhances oocyte in vitro maturation but has an adverse impact on hatched blastocysts during in vitro culture[J]. Reprod Fertil Dev,2012,24(5):656-668.
[9] Rocha M,Ding J,Lehman M,et al.Kisspeptin and kisspeptin receptor are expressed in mouse oocytes and participate in meiosis resumption[J].Fertil Steril,2012,98(3):S22.
[10]Martino N A,Rizzo A,Pizzi F,et al.Effects of kisspeptin-10 on in vitro proliferation and kisspeptin receptor expression in primary epithelial cell cultures isolated from bovine placental cotyledons of fetuses at the first trimester of pregnancy[J].Theriogenology,2014,11:033.
[11]Yousuke N,Keisuke N,Shohei S,et al.Effects of Full-Length Kisspeptin Administration on Follicular Development in Japanese Black Beef Cows[J].J Reprod Dev,2013,59:588-594.
[12]Castellano J M,Gaytan M,Roa J,et al.Expression of KiSS-1 in ratovary:putativelocal regulatorofovulation?[J].Endocrinology, 2006,147(10):4852-4862.
[13]McNatty K P,Juengel J L,Reader K L,et al.Bone morphogenetic protein 15 and growth differentiation factor 9 co-operate to regulate granulosa cell function in ruminants[J].Reproduction, 2005,129,481-487.
[14]赵静,王军.KiSS-1/GPR54系统在卵巢的表达和功能研究进展[J].中国畜牧杂志,2014,50(21):82-83.
S823.3
A文献标识码:0258-7033(2015)11-0019-03
2015-01-12;
2015-03-13
吉林省肉牛产业技术体系,吉林省科技厅重大科技攻关专项 (20140203016NY);吉林省科技创新人才培育计划(20150519018JH);吉林省重点科技攻关项目(20150204074NY)
贺明(1989-),男,吉林长春人,在读硕士,研究方向为动物生殖调控,E-mail:hemingbb@126.com
*通讯作者:吕文发,教授,博导,E-mail:wenfa2004@163.com

