电针对吗啡戒断大鼠NAc脑区Ca2+浓度和CaM活性的影响*
孙远征,李 霞,武文鹏△
(1.黑龙江中医药大学附属第二医院,黑龙江哈尔滨150001;2.黑龙江中医药大学,黑龙江哈尔滨150040)
有研究表明,吗啡戒断可使脑内游离Ca2+增加,大量的细胞内Ca2+可以诱导细胞凋亡,成为记忆损伤的病理基础[1]。大量实验研究表明,电针能够改善吗啡戒断大鼠受损的空间记忆能力,但对于其机制尚不十分明确。本实验通过用水迷宫训练观察电针对吗啡戒断大鼠学习记忆的改善,采用流式细胞技术检测对不同组别的细胞内Ca2+浓度、CaM活性的变化,为电针治疗吗啡戒断综合征提供新的科学依据。
1 材料和方法
1.1 实验动物
选取体重在160~210 g之间的56只清洁级雄性SD大鼠,购自北京维通利华实验动物技术有限公司,适应性喂养1周后,随机分为空白组(只注射生理盐水)、模型组(注射吗啡后戒断)、针刺组(戒断后捆绑针刺治疗)与电针组(戒断后捆绑电针治疗),共4组,每组14只。
1.2 试剂和仪器
盐酸吗啡注射液(沈阳第一制药厂,批号:121207-2);盐酸纳洛酮(国药集团国瑞药业有限公司,批号:1403002);KWD808Ⅰ脉冲治疗仪(常州英迪电子医疗器械有限公司);Morris水迷宫(香港友诚生物科技有限公司);FACS Calibur流式细胞仪[碧迪医疗器械(上海)有限公司]。
1.3 造模
[2]进行造模,采用逐日递增法背部皮下注射盐酸吗啡注射液,首日注射20 mg/kg,以后按10 mg/kg逐日递增,第5日同第4日用50 mg/kg,连续注射5天,2次/天,空白组于相同时间注射相同体积生理盐水。最后1日注射吗啡3 h后,予以纳络酮腹腔注射,剂量为3 mg/kg。催促戒断后,随即观察大鼠戒断反应,观察10 min后,用柳田知司法[3]对戒断症状进行评分,以确定大鼠戒断模型是否建立成功。
1.4 处置
大鼠戒断模型建立成功后次日予各组大鼠以处置,4组大鼠捆绑固定。针刺组捆绑后,参照《实验针灸学》[4]针刺大鼠神庭、百会穴、双侧肾俞、足三里并留针15 min,每日针刺1次,连续针刺6天 。电针组固定后,针刺以上穴位,并取神庭、百会穴、同侧肾俞与足三里穴连接电针治疗仪,采用疏密波(频率:2/100 Hz),电流强度按 0.5、1、2 mA 递增,电流每5 min增强1次,持续15 min,每日1次,连续治疗6天。
1.5 Morris水迷宫检测大鼠空间学习记忆
Morris水迷宫装置包括盛水的圆形水池、平台、图像采集及分析系统。池中水温控制在(22±1)℃。水池以4个入水点平均分为4个象限,东(E)、南(S)、西(W)、北(N)。平台置于北象限正中,没于水下1 cm,图像监视及分析系统安置于水池正上方。较为经典的水迷宫测试主要包含定位航行实验与空间探索实验[5]。实验前先让大鼠在平台上适应10 s,随后将其面向池壁放入任一象限的水池内,并开始记录其登上平台所需时间。如60 s内不能登上平台,则将其再放在平台上10 s或引导其游至平台,训练2日后,记录第3、4、5日大鼠登上平台时间即逃避潜伏期;第6日取出平台,进行空间探索实验,将大鼠从远离先前平台位置面向水池壁放入水池中,同时用图像分析系统记录60 s内穿越原平台次数,两个实验结束后分析比较数据,用以评判大鼠的空间学习记忆能力。
1.6 采用流式细胞技术检测不同组别的细胞内Ca2+浓度、CaM活性的变化
参照文献,实验结束后每组大鼠用10%水合氯醛麻醉,将左心室插管后,缓慢推入1000 ml生理盐水,至内脏变白后,剪断头部、剥离出脑,参照大鼠脑立体定位图谱[6],冰浴下取NAc脑区,迅速置于4℃预冷的加入10%胎牛血清DMEM培养基中,分离脑膜、血管,用无钙镁D-Hanks溶液冲洗,将组织充分剪碎、研磨,过200目筛网去除细胞团块,离心后去上清,用Hanks液洗涤1次,用台盼蓝染色[7]。
1.7 统计学方法
戒断症状评分采用单因素方差分析统计,组间比较采用q检验;水迷宫测试采用重复测量的方差分析进行统计;流式细胞术检测结果采用单因素方差分析,组间比较采用t检验;检验的显著水平为P<0.05。
2 实验结果
2.1 各组大鼠戒断症状观察评分比较
除空白组外,各组大鼠均出现不同程度的激惹、湿狗样抖动、上睑下垂、齿颤、稀便、体重下降等戒断反应。模型组、针刺组、电针组与空白组比较,差异有显著统计学意义(P<0.01),表示大鼠吗啡戒断模型建立成功。见表1。
表1 各组大鼠戒断症状观察评分比较(分,±s)
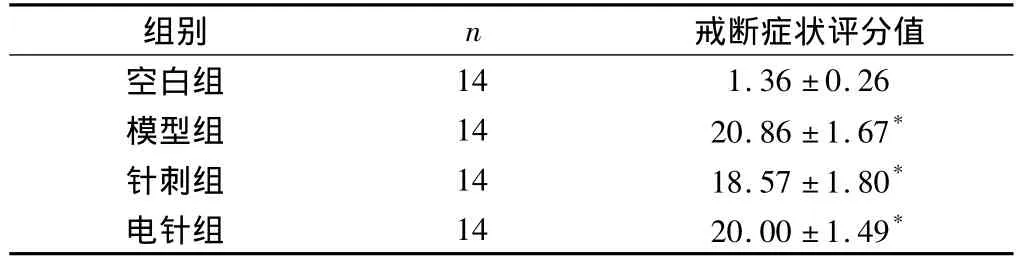
表1 各组大鼠戒断症状观察评分比较(分,±s)
注:与空白组比较,*P <0.01。
戒断症状评分值空白组组别 n 14 1.36 ±0.26模型组 14 20.86 ±1.67*针刺组 14 18.57 ±1.80*电针组 14 20.00 ±1.49*
2.2 Morris水迷宫测试结果比较
在定位航行实验中,各组同模型相比较,逃避潜伏期显著缩短,差异有明显的统计学意义(P<0.01);针刺组与电针组大鼠相比较,差异有统计学意义(P<0.05),以上结果说明,电针及针刺均能有效改善大鼠学习记忆能力,而以电针效果更优。见表2。
表2 各组大鼠逃避潜伏期结果比较(s,±s)
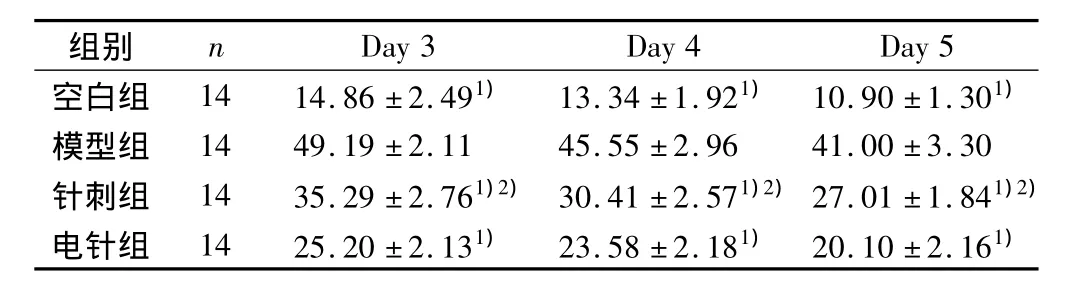
表2 各组大鼠逃避潜伏期结果比较(s,±s)
注:与模型组比较,1)P <0.01:与电针组比较,2)P <0.05。
模型组 14 49.19 ±2.11 45.55 ±2.96 41.00 ±3.30针刺组 14 35.29 ±2.761)2) 30.41 ±2.571)2)27.01 ±1.841)2)电针组 14 25.20 ±2.131) 23.58 ±2.181) 20.10 ±2.161)
在空间探索实验中,各组与模型组相比较,穿越平台总次数明显增多,差异有显著统计学意义(P<0.01),针刺组与电针组相比较差异有统计学意义(P <0.05)。见表3。
表3 各组大鼠穿越平台总次数结果(次,±s)
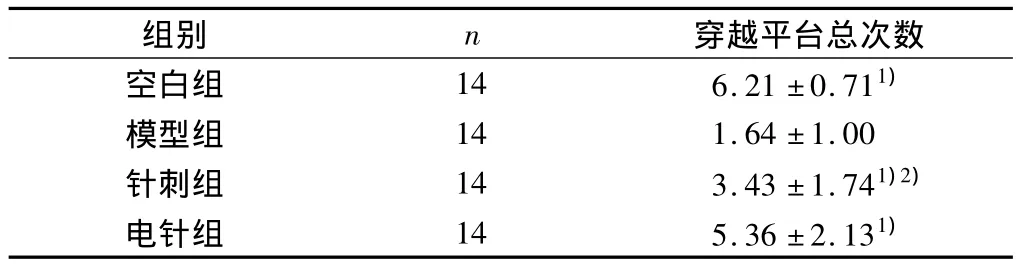
表3 各组大鼠穿越平台总次数结果(次,±s)
注:与模型组比较,1)P <0.01;与电针组比较,2)P <0.05。
穿越平台总次数空白组 14 6.21 ±0.711)组别 n模型组 14 1.64 ±1.00针刺组 14 3.43 ±1.741)2)电针组 14 5.36 ±2.131)
2.3 各组大鼠Ca2+浓度和CaM活性结果比较
在流式细胞术实验中,各组与模型组相比较,Ca2+浓度和CaM活性明显地降低,差异有较显著的统计学意义(P<0.01),针刺组与电针组比较差异有统计学意义(P<0.05)。详见表4。
表4 各组大鼠Ca2+浓度和CaM活性比较(±s,n=14)

表4 各组大鼠Ca2+浓度和CaM活性比较(±s,n=14)
注:与模型组比较,1)P <0.01;与电针组比较,2)P <0.05。
CaM空白组/空白组 1±01) 1±01)组别 Ca2+浓度模型组/空白组 0.726 ±0.151 0.721 ±0.132针刺组/空白组 2.001 ±0.3521)2) 1.764 ±0.2121)2)电针组/空白组 2.654 ±0.4711) 2.211 ±0.4221)
3 讨论
阿片依赖是一种慢性复发性疾病,并与很多健康和社会问题密切相关,因此成为公众健康普遍关注的焦点[8],而戒断后复吸更是不容忽视的问题,如何减轻戒断症状、改善戒断后记忆能力,成为亟待解决的问题。
实验中发现,戒断后大鼠立即表现出戒断症状,时间越久,戒断症状越不明显。关于吗啡成瘾模型的造模方法,国内有不同方法的报道。本研究选取背部皮下注射吗啡逐日递增法,成功地建立了吗啡成瘾模型。有报道称:吗啡戒断造模时,采用剂量递增法诱导成瘾,不仅省时,并且相较剂量恒定法,效果更加明显[9]。传统中医认为:阿片类药物成瘾的主要机理是烟毒内蕴、正气亏虚,从而形成虚实错杂的病症。治疗原则是扶正祛邪,扶助正气、去除烟毒[10]。现代很多研究表明:针刺及电针治疗吗啡戒断有很多优势。实验表明:2 Hz电刺激能促进体内阿片肽的释放[11],电针治疗戒断综合征,能够使大脑局部血流重新分布,从而改善大脑的功能[12],增强记忆及学习能力。
本实验穴位选取肾俞、足三里、百会、神庭。肾俞穴是肾脏精气会聚之处,能有效地补益肾气、调节阴阳。另有实验表明:肾俞穴能有效地改善大鼠学习记忆能力[13];足三里为补益之穴。百会、神庭为督脉要穴,督脉入络于脑,与大脑联系紧密。
药物成瘾的主要特征是失去控制地、强迫性地连续用药,并被公认为是一种慢性复发性脑病。有多种学习记忆系统参与了成瘾行为形成过程[14];伏核是与吗啡依赖密切相关的中枢部位[15]。以往的研究证实:吗啡成瘾时,Ca2+通道开放,大量内流的Ca2+与钙调蛋白结合,激活CaM,从而使CaMKⅡ自我磷酸化而激活 CaMKⅡ[16],而纳洛酮可以翻转以上效应[17],实验结果与文献相吻合,CaMKⅡ的自我磷酸化使它成为学习记忆的分子基础[18],推测这在一定程度上解释了成瘾记忆的形成机制。而本实验针刺组和电针组大鼠脑内Ca2+的浓度和CaM的活性高于模型组,很可能与针刺刺激 Ca2+的释放有关,Ca2+与 CaM结合而激活CaMKⅡ,从而改善学习记忆。
本实验建立了吗啡成瘾戒断模型,给予大鼠针刺及电针治疗,进行定位航行实验及空间探索训练,并且检测了NaC脑区的Ca2+浓度及CaM活性。关于针刺及电针改善吗啡戒断大鼠学习记忆能力的研究目前处于初级阶段,随着研究的进展,可以在针灸阶段基础上进一步阐明吗啡成瘾戒断机制,可以与西医治疗方法对比,进一步明确针灸治疗的优势。
参考文献:
[1] 吴建勇,赵德璋.流式细胞仪检测细胞凋亡的几种方法的比较[J].重庆医科大学学报,2010,35(9):1386 -1404
[2] 纪家涛,王新华,由振东,等.吗啡依赖大鼠模型的建立[J].第二军医大学学报,1997,18(1):81 -82
[3] 柳田知司,有村庆子,清源广子.ラシトヘフ镇痛药短效频回注入はたゐ身体依存つ形成[J].実中研.前臨床研究報,1979(5):139-143
[4] 林文注,实验针灸学[M].上海:上海科学技术出版社,1994:286
[5] 胡镜清,温泽淮,赖世隆.Morris水迷宫检测的记忆属性与方法学初探[J].广州中医药大学学报,2001,27(2):117 -119
[6] 包新民,舒斯云.大鼠脑立体定位图谱[M].北京:人民卫生出版社,1991:32-35
[7] 张雅静,马兴友,文迪.八肽胆囊收缩素及其受体拮抗剂对吗啡戒断大鼠脑内[Ca2+]i和CaM活性的影响[J].中国药理学通报,2014,30(1):35 -38
[8] Ghamati L,Hajali V,Sheibani V,et al.Single and repeated ultra -rapid detoxification prevents cognitive impairment in morphine addicted rats:a privilege for single detoxification[J].Addict Health,2014,6(1-2):54-64
[9] 赵杨,朱峰,阎春霞,等.阿片类药物依赖建模和戒断症状评价方法研究进展[J].中国药物依赖性杂志,2012,21(6):401 -405
[10]高学敏,宋树立,百晓菊.浅析中医药戒毒的科学性[J].中国药物滥用防治杂志,2001(1):3-9
[11]崔彩莲,吴鎏桢,韩济生.电针抑制阿片依赖的研究进展[J].中国药物依赖性杂志,2006,15(3):226 -229
[12]张杰,王兰琼,曾林,等.国内应用针灸戒除海洛因及治疗戒断综合征研究进展[J].湖南中医药导报,2004,10(8):45 -47
[13]刘胜,路镇穗,周文华,等.电针对吗啡慢性注射大鼠成瘾记忆的良性调节[J].中国药物依赖性杂志,2013,22(2):98-101
[14]肖琳,隋南.成瘾行为形成过程中学习记忆的参与及其相关的脑机制[J].中国神经科学杂志,2003,19(1):50 -53
[15]闫玉仙.CCK受体拮抗剂对吗啡戒断大鼠海马神经元的抑制作用及信号转导机制研究[D].石家庄:河北医科大学,2006:149-153
[16]梁建辉,叶向锋,郑继旺.钙调素与吗啡依赖[J].中国药物依赖性杂志,2001,10(1):10 -12
[17]胡晓东,李凤源.阿片类对钙通道的影响[J].中国药物依赖性杂志,1999,8(3):169 -171
[18]肖琳,隋南.成瘾行为形成过程中学习记忆的参与及其相关的脑机制[J].中国神经科学杂志,2003,19(1):50 -53

