搅拌釜中铁基催化剂费托合成宏观动力学研究
颜 芳,潘 壮,钱炜鑫,孙启文,张海涛,应卫勇*,房鼎业
(1.华东理工大学 大型工业反应器工程教育部工程研究中心,化学工程联合国家重点实验室,上海200237;2.煤液化及煤化工国家重点实验室,上海 201203)
搅拌釜中铁基催化剂费托合成宏观动力学研究
颜 芳1,2,潘 壮1,钱炜鑫1,孙启文2,张海涛1,应卫勇1*,房鼎业1
(1.华东理工大学 大型工业反应器工程教育部工程研究中心,化学工程联合国家重点实验室,上海200237;2.煤液化及煤化工国家重点实验室,上海 201203)
采用0.5L机械搅拌釜式反应器,在温度为210℃~250℃,压力0.5MPa~4.5MPa,流量为62.6mL/min~125.2mL/min和原料气中H2/CO物质的量比为1.0~2.5的条件下,实验测定了CO转化率和CO消耗速率随温度、压力、空速和H2/CO比的变化规律,研究了低温沉淀铁基催化剂的费托合成反应CO消耗动力学。采用采用全局算法和Levenberg-Maquardt算法对动力学参数进行拟合,得到搅拌釜中低温沉淀铁基催化剂费托合成反应的宏观动力学模型。统计检验和相对误差分析显示该模型是适宜的,模型计算值与实验值吻合良好。
搅拌釜;费托合成;铁基催化剂;宏观动力学
费托合成过程是将煤、生物质等转化而来的合成气用于直接合成液体燃料的过程,所得产物具有无硫、无芳烃、对环境友好等特点,因此受到越来越多人的关注[1,2]。在对费托合成反应过程进行放大及工艺优化的过程中,需要对反应动力学有准确掌握,但是费托合成产物种类繁多,若对每一种产物生成速率进行考察存在较大困难[3-5]。根据反应过程中合成气或CO的消耗速率以及经过集总的产物分布的考察推导产物生成速率是经常采用的一种费托合成动力学研究方法,可大大简化费托合成动力学研究的复杂程度[6-8]。同时,根据是否考虑传质、扩散等因素,费托合成动力学可分为本征动力学及宏观动力学。本征动力学是在排除了反应过程中传质、扩散等物理过程对反应的影响,研究反应的本质过程,而宏观动力学则是包含了传质、扩散等因素对反应过程的影响,是描述传质与反应的综合过程的反应特性[9]。一般在工业浆态床反应器模拟、放大等过程中,宏观反应动力学的应用较多。
本文在0.5L的机械搅拌釜中研究了低温沉淀铁基催化剂上的费托合成宏观反应动力学,基于H2在催化剂表面的不同吸附形态的假定,推导得到了费托合成反应宏观动力学方程,并通过全局算法以及Levenberg-Maquardt算法回归模型参数,得到适合于低温沉淀铁基催化剂的费托合成反应宏观动力学模型。
1 实验部分
1.1 催化剂制备
实验中使用的低温铁基催化剂采用共沉淀法制备。金属硝酸盐首先配制成均匀混合溶液,采用氨水作为沉淀剂。硝酸盐溶液与沉淀剂逐滴滴入到一置于恒温水浴中的玻璃烧杯中,并连续搅拌,烧杯中的浆液pH值维持在9.0左右。共沉淀完成后,继续搅拌浆液2h后静置12h并抽滤、洗涤至中性。滤饼经110℃恒温干燥24h,在马弗炉中500℃焙烧4h后研磨、筛分,取60~80目的颗粒备用。采用等体积浸渍法在颗粒上负载K2CO3,搅拌后静置过夜,120℃干燥24h,500℃焙烧4h,即得到所需配比的催化剂。
1.2 动力学实验
宏观动力学实验在大连自控设备厂生产的GCF-0.5型高压搅拌釜式反应器中进行,釜的有效容积为0.5L。原料气经稳压减压阀、质量流量计计量流量后进入净化器脱除微量氧,由高压搅拌釜反应器的底部的进气管进入到反应器中进行反应,催化剂依靠搅拌悬浮于浆液中。反应器中生成的气态产物随未反应的原料气从反应器的顶部排出,经过热阱(185℃)和冷阱(0℃)分别收集蜡相、油相以及水相产物,未冷凝气体经皂膜流量计计量流量后排空或进入气相色谱仪在线分析。
催化剂性能评价需在稳态反应条件下进行,不仅包括操作条件的稳定,也包括催化剂颗粒表面微观晶相的稳定。一般认为,反应器内温度到达反应温度后,需进行较长时间的反应(~200h),方可认为催化剂的反应性能进入稳态[10]。当操作条件改变后,需稳定24h以上,经色谱分析尾气组成稳定后方可视为反应达到稳态。
实验中,催化剂的装填量为18.78g。反应产物主要包括尾气、水相、油相以及蜡相,均通过气相色谱进行分析。尾气中主要为C1~C6等气态产物、CO2以及未反应的原料气等,通过HP-AL/S毛细管柱以及5A分子筛、Propack Q填充柱等色谱柱的组合实现分离,并分别在FID和TCD检测,通过外标法分析各组分含量。水相中主要含有少量的含氧化合物,如醇、酸、酯等,在低温铁基催化剂上的费托合成反应中生成量较少,可予以忽略。油相、蜡相中主要包括碳数不一的直链烃类,可在HP-5毛细管柱中在不同的柱箱温度及升温程序下实现分离,FID检测,采用面积百分比法分析其组成。
2 结果与讨论

表1 宏观动力学实验条件
2.1 操作条件对催化剂反应性能的影响
在反应过程中,产物中一部分分子量较大的重质烃在反应温度下无法挥发成气体组分离开反应器,从而残留在反应器中,因此实验过程中仅对尾气以及由热阱和冷阱中得到的产物进行分析。宏观动力学实验条件如表1所示。其中Qin、Qout分别为原料气及尾气的流量。
2.1.1 反应温度对催化剂反应性能的影响
在2.5MPa、n(H2)/n(CO)为2.21、Qin为93.9mL/min的操作条件下,考察了反应温度对催化剂的CO转化率和消耗速率的影响,结果如表2所示。由表2可知,随着反应温度的升高,CO消耗速率及转化率均随之增大。在温度较低时,CO转化率和消耗速率增加的幅度较大,而随着反应温度的升高,CO转化率及消耗速率增加的幅度有所减小。费托合成反应过程是强放热的过程,同时也包含多个可逆反应步骤,热力学和动力学因素均会对其产生影响,温度升高对反应活性的影响程度也能反映出费托合成反应受动力学因素和热力学因素的影响程度。随着反应温度从210℃升至250℃,反应逐渐趋向平衡。根据以上分析,可见反应温度对该催化剂反应活性影响较大,尤其是在温度较低时,反应温度的变化会导致催化剂活性的较大改变。

表2 不同反应温度下的CO转化率和CO消耗速率
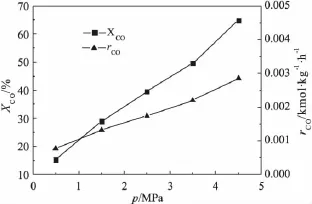
图1 反应压力对CO转化率及消耗速率的影响
2.1.2 反应压力对催化剂反应性能的影响
在240℃、n(H2)/n(CO)为1.99、Qin为93.9mL/min的反应条件下,考察了反应压力对CO转化率及消耗速率的影响,结果如图1所示。由图1可见,随着反应压力的增大,CO消耗速率和转化率均随之增大,在保持其他操作条件不变的情况下,升高反应压力有利于催化剂反应活性的提高。原因在于,该反应是一个体积缩小的反应,此外压力升高也有利于原料气在浆液中的溶解吸收,使得反应气体与催化剂的接触几率大大增加。因此,在设备及成本等因素限制的情况下,费托合成反应可选择在较高的压力下进行。
2.1.3 原料气流量对催化剂反应性能的影响
在240℃、3.5MPa、n(H2)/n(CO)=2.49的反应条件下,进气流量对催化剂的CO转化率及消耗速率的影响如图2所示。由图2可见,随着进气流量的增大,CO转化率呈现下降趋势,而CO消耗速率则随之增大。这是由于,随着进气流量的增大,CO和H2在催化剂表面的停留时间缩短,使得其在催化剂活性位上发生反应的概率减小,从而导致转化率下降,同时进气流量的增大意味着催化剂表面的原料气不断更新,气相主体与催化剂表面的反应气体浓度差增大,推动反应进行,使得CO的消耗速率增大。因此,合适的原料气进气流量可根据实际生产对产物选择性及收率等要求进行选择。
2.1.4 原料气中H2/CO比对催化剂反应性能的影响
在240℃、3.5MPa、进气流量93.9mL/min的反应条件下,考察了原料气中H2/CO比对CO转化率以及CO消耗速率的影响,结果如表3所示。由表3可知,CO消耗速率以及转化率随着原料气中H2/CO比值的增大而增大。H2/CO比的增大意味着原料气以及反应器中H2的分压增大,有利于推动H2与吸附在催化剂活性中心的碳组分进行反应,增大了反应速率,但H2/CO比的过度增大,由于催化剂表面活性位被H2的占据影响碳组分的吸附,从而使得CO消耗速率下降。根据表2数据,随着原料气中H2/CO比的增大,CO转化率及消耗速率均有所增大,可见n(H2)/n(CO)在0.93~2.21范围内不会导致H2在催化剂表面的过度吸附。

表3 H2/CO对CO转化率和CO消耗速率的影响
2.2 CO消耗速率模型
2.2.1 模型建立
通过假设H2在催化剂表面的吸附形态及速率决定步骤,推导得到基于H2解离吸附与非解离吸附的CO消耗速率模型,如式(1)~(2)。模型推导过程在之前的工作中已有描述[11]。

此外,较常见的CO消耗速率模型也包括采用幂函数形式的经验模型,即:

式中,k为反应动力学常数。
2.2.2 模型选取及参数估值、模型检验
在搅拌釜式反应器中,流型接近全混流,CO转化率及消耗速率可根据进出口条件计算。

式中:Nin、Nout-分别为合成气进、出口摩尔流量,kmol/h;W-催化剂装填量,kg。
采用全局算法及Levenberg-Maquardt算法对式(1)~(3)进行参数回归,并对参数进行相关性及统计检验,主要考察指标为相关系数ρ2和F值,其具体的计算式为:


式中:M-实验组数;Mp-模型参数个数;F-回归均方和与模型残差均方和之比;F0.05-显著水平为5%的相应自由度。
目标函数为CO转化率的实验值与模型值得残差平方和最小,即:最小。
回归得到的参数见表4。

表4 动力学模型参数回归及检验结果
根据表4的回归结果可见,式(1)具有较高的关联性,相关系数ρ2=0.959>0.90,F=107.5>10F0.05,这表明该模型在统计意义上差异很小,模型是适宜的。这也说明在费托合成过程中,H2更大可能是以解离态的形式吸附到催化剂表面并参与反应。将各参数代入模型方程中,可以得到CO消耗速率方程:
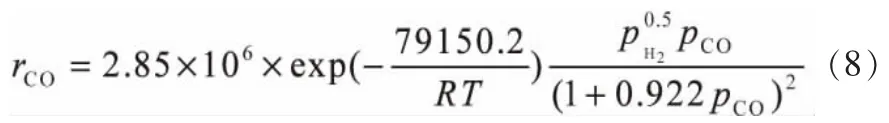
式中,rCO为CO消耗速率,kmol·kg-1·h-1。
CO消耗速率的实验值与计算值比较如图3所示。

图3 CO消耗速率的实验值和计算值的比较
由图3可知,CO消耗速率的实验值和计算值分布在对角线的两侧,且大部分实验点都位于± 20%误差范围以内,由此可见CO消耗速率的计算值和实验值符合较好,该宏观动力学模型是合适的, 其适用的操作条件范围为:210℃~250℃,0.5MPa~4.5MPa,流量 62.6mL/min~125.2mL/min,n(H2)/n(CO)比1.0~2.5。在该低温沉淀铁基催化剂上的费托合成反应活化能为79.15kJ/mol,符合文献所报道的60kJ/mol~140kJ/mol的范围[12]。
3 结论
在机械搅拌釜中考察了低温沉淀铁基催化剂的费托合成反应性能,较高的反应温度、反应压力、H2/CO比有利于提高催化剂的反应活性以及CO转化率和消耗速率,原料气流量的增大使得CO消耗速率增大而转化率则随之减小。
采用通过假设氢气以解离吸附或分子态吸附形式参与反应所推导得到的费托合成宏观动力学模型并利用Levenberg-Maquardt算法回归得到模型参数,相对误差分析及统计分析结果表明,假设氢以解离态参与反应所推导得到的CO消耗速率方程具有较好的模型值与实验值的相符性,反应活化能为79.15kJ/mol,在文献报道范围以内。
低温沉淀铁基催化剂的宏观动力学方程如式(8)所示。
[1]Dry M E.The Fischer-Tropsch process:1950-2000[J]. Catal Today,2002,71(3-4):227-241.
[2]应卫勇,曹发海,房鼎业.碳一化工主要产品生产技术[M].北京:化学工业出版社,2004,1-2.
[3]孙启文.煤炭间接液化 [M].北京:化学工业出版社, 2012:39-62.
[4]Mao W Y,Sun Q W,Ying W Y,et al.Mechanism of oxygenates formation in high temperature Fischer-Tropsch synthesis over the precipitated iron-based catalysts[J].J Fuel Chem Technol,2013,41(3):314-321.
[5]Qian W X,Zhang H T,Ying W Y,et al.The comprehensive kinetics of Fischer-Tropsch synthesis over a Co/AC catalyst on the basis of CO insertion mechanism[J]. Chem Eng J,2013,228:526-534.
[6]鲁丰乐.费托合成催化剂反应动力学研究与反应器数学模拟[D].上海:华东理工大学,2010.
[7]高琳,徐元源,李永旺.工业Fe-Mn催化剂上费托合成反应动力学的研究[J].燃料化学学报,2009,37(6):717-721.
[8]钱炜鑫,张海涛,应卫勇,等.活性炭负载钴基催化剂费托合成本征动力学 [J].天然气化工 (C1化学与化工), 2012,37(2):1-6.
[9]朱炳辰.化学反应工程 [M].第五版.北京:化学工业出版社,2012:34-68.
[10]Itoh H,Nagano S,Takeda K,et al.Catalytic properties and crystalline structures of manganese-promoted iron ultrafine particles forliquid-phase hydrogenation of carbon monoxide[J].Appl Catal,A,1993,96:125-134.
[11]潘壮.机械搅拌反应器内费托合成宏观动力学研究[D].上海:华东理工大学,2013.
[12]Withers H P Jr,Eliezer K F,Mitchell J W.Slurry-phase Fischer-Tropsch synthesis and kinetic studies over support cobalt carbonyl derived catalysts[J].Ind Eng Chem Res,1990,29:1807-1814.
Global kinetics of Fischer-Tropsch synthesis over an iron catalyst in a stirred tank reactor
YAN Fang1,2,PAN Zhuang1,QIAN Wei-xin1,SUN Qi-wen2,ZHANG Hai-tao1,YING Wei-yong1,FANG Ding-ye1
(1.Engineering Research Center of Large Scale Reactor Engineering and Technology,Ministry of Education,State Key Laboratory of Chemical Engineering,East China University of Science and Technology,Shanghai 200237,China;2.State Key Laboratory of Coal Liquefaction and Coal Chemical Technology,Shanghai 201203,China)
The effects of operating conditions containing reaction temperature,pressure,gas flow rate and mole ratio of H2to CO on the conversion and consumption rate of CO and the global kinetics of Fischer-Tropsch synthesis over a low temperature precipitated iron-based catalyst were studied in a stirred tank reactor with a 0.5L volume under the operating condition ranges of 210 to 250℃,0.5 to 4.5MPa,gas flow rate 93.9 to 125.6mL·min-1,H2/CO mole ratio 1.0 to 2.5.Global algorithm and Levenberg-Maquardt algorithm were adopted to fit the kinetic parameters,and a global kinetic model of Fischer-Tropsch synthesis over the ironbased catalyst was obtained.The statistical analysis and relative error analysis indicated that the model was reasonable and the calculated values of CO consumption rate were in good agreement with the experimental values.
stirred tank reactor;Fischer-Tropsch synthesis;iron catalyst;global kinetics
O643;TQ426;TQ013.2
A
1001-9219(2015)05-53-05
2015-01-23;基金项目:国家高技术研究发展计划(863计划)(No.2011AA05A204);作者简介:颜芳(1974-),女,博士研究生,电邮 yanfzn@163.com;*联系人:应卫勇,电话/传真021-64252192,电邮 wying@ecust.edu.cn。

