酶解辅助提取山药多糖的研究
董 义,沈才洪,曾 里,黄张君,刘晓碧,刘文虎,何 强,曾凡骏*
(1.四川大学 食品工程系,四川 成都 610065;2.国家固态酿造工程技术研究中心,泸州老窖集团,四川 泸州 646000;3.泸州老窖集团养生酒业有限责任公司,四川 泸州 646000)
0 引言
山药(Dioscorea opposita),学名薯蓣,又名山薯、山芋、玉延,为薯蓣科薯蓣属植物的块茎,属于药食两用资源.
山药多糖是山药中重要的活性物质之一,与山药的增强免疫力、降血糖等众多保健功能具有一定量效关系.其结构组成较为复杂,具有水溶性和醇不溶性特点,一般采用水提醇沉的方式进行提取获得粗多糖.然而,山药中含有大量淀粉,占干物质质量的59.12%~78.85%[1],且与多糖性质相似.在提取过程中如果温度过高,则会有大量淀粉糊化溶解,醇沉后混入粗多糖中,并造成粗多糖量值的虚高[2].另一方面,由于山药淀粉颗粒的存在,提取温度低于淀粉糊化温度时,淀粉颗粒的包裹阻碍了山药多糖的释放,造成山药多糖提取的不完全.由此作者通过研究酶解辅助提取山药多糖工艺,提高了山药多糖的提取率,为原料资源的充分利用及相关保健食品的开发提供依据.
1 材料与方法
1.1 主要试剂与仪器
α-淀粉酶(3 700 U/g)、糖化酶(10 万U/g):北京奥博星生物技术有限责任公司;无水葡萄糖、苯酚、浓硫酸、无水乙醇、碘、碘化钾等试剂均为分析纯;试验用水为双蒸水;山药干粉:山药饮片打粉,过40 目筛.
UV-1100 型紫外可见光分光光度计:上海美谱达仪器有限公司;DSY-1-4 型电热恒温水浴锅:北京爱琦霞商贸中心;LD5-2B 型低速离心机:北京雷勃尔离心机有限公司.
1.2 试剂准备
6%苯酚溶液(W/V):取6.0 g 苯酚加水溶解,定容至100 mL,密封冷藏保存.
0.1mg/mL 葡萄糖标准溶液:准确称取干燥至恒质量的葡萄糖0.500 0 g 加水溶解,并定容至50 mL,即为10 mg/mL 葡萄糖溶液.取1.0 mL 该溶液,加水稀释并定容至100 mL.
碘-碘化钾溶液:称取碘化钾3.0 g,加水溶解完全后,加入碘1.0 g,振荡溶解后定容至100 mL.
1.3 试验方法
1.3.1 检测方法
1.3.1.1 粗多糖检测标准曲线的绘制
准确吸取葡萄糖标准溶液0.0 mL、0.1 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL 分别置于25 mL 具塞比色管中,再加入6%苯酚溶液1 mL、水1.0 mL,混匀.加入12.0 mL 浓硫酸,小心混匀后置于80 ℃中水浴4 min.取出冷却至室温后,用分光光度计在波长485 nm 处测定吸光度.
1.3.1.2 粗多糖含量的测定
取待测液100 mL 左右,加入α-淀粉酶0.2 g,混匀,置于60 ℃水浴中45 min,再加入糖化酶15 mg,混匀,60 ℃水浴中45 min 后取出煮沸,待其冷却后抽滤并收集滤液,准确吸取滤液(不多于5.0 mL)于离心管中,加入无水乙醇至25 mL,混匀后置于冰箱中冷藏4 h 以上.取出后以4 000 r/min离心5 min,用胶头滴管小心吸取20 mL 上清液弃去,再加入20 mL 无水乙醇洗涤离心两次后,小心去除上清液,收集沉淀,加水溶解并定容.
取所得溶液1.0 mL 于25 mL 具塞比色管中,按1.3.1.1 中方法添加后续试剂,并测定吸光度.所得吸光度根据标准曲线计算粗多糖含量,计为纯粗多糖含量.
1.3.1.3 粗多糖纯度的测定
准确吸取待测液(不多于5.0 mL)于离心管中,加入无水乙醇至25 mL,混匀后置于冰箱中冷藏4 h 以上.取出后以4 000 r/min 离心5 min,用胶头滴管小心吸取20 mL 上清液弃去,再加入20 mL 无水乙醇洗涤离心两次后,小心去除上清液,收集沉淀,加水溶解并定容.取该溶液1.0 mL 于25 mL 具塞比色管中,按1.3.1.1 中方法添加后续试剂,并测定吸光度.所得吸光度根据标准曲线计算粗多糖含量,计为粗多糖总量.
剩余待测液按1.3.1.2 中方法测粗多糖含量,计为纯粗多糖总量.用纯粗多糖含量除以粗多糖总量,所得值为粗多糖纯度.
1.3.1.4 溶解淀粉的定性判断
吸取待测液各3.0 mL,加入碘-碘化钾溶液2~3 滴,根据其颜色变化判断是否有淀粉.
1.3.2 酶解辅助提取工艺优化
以α-淀粉酶添加量、糖化酶添加量、α-淀粉酶酶解时间、糖化酶酶解时间作为4 个单因素分别进行考察.各因素变化范围为:α-淀粉酶添加量为80、100、120、140、160、180、200、220 mg,糖化酶添加量为40、60、80、100、120、140 mg,水浴时间为30、45、60、75、90 min.
准确称取山药干粉5.00 g,加水100 mL,加入α-淀粉酶,搅拌混匀后,置于60 ℃水浴一定时间,再加入糖化酶,继续水浴一定时间,完成后取出煮沸.待其冷却后,以4 000 r/min 离心5 min,收集上清液抽滤并收集滤液.取该滤液3.0 mL 并按1.3.1.4 中所述方法判断是否溶有淀粉,剩余滤液按1.3.1.3 中方法测定纯粗多糖含量和粗多糖总量,计算粗多糖的得率及纯度.
粗多糖得率=纯粗多糖含量×提取液体积÷山药粉质量×100%.
1.3.3 酶解辅助提取多糖工艺与温水浸提工艺对比
山药多糖水浸提液的制备:根据本试验所得温水浸提山药多糖的最优工艺进行提取.准确称取山药干粉5.00 g,加水150 mL,于70 ℃中水浴30 min 后,离心分离,沉淀再以相同条件提取分离,收集合并两次上清液抽滤后,减压浓缩至100 mL,即为山药多糖水浸提液.
山药多糖酶解辅助提取液的制备:根据试验所得酶解辅助山药多糖的最优工艺进行提取.
取两种提取液按1.3.1 中方法分别测定纯粗多糖含量及纯度,并按1.3.2 中方法计算粗多糖得率.
2 结果与分析
2.1 粗多糖检测方法
采用葡萄糖作为标准品,苯酚-硫酸法显色得到标准曲线如图1 所示.葡萄糖在0.01~0.1 mg 范围内,吸光度呈良好线性关系,回归方程为y=0.348 9x-0.004 8,r=0.998 9,y 为吸光度值,x 为0.1 mg/mL 葡萄糖标准溶液体积.
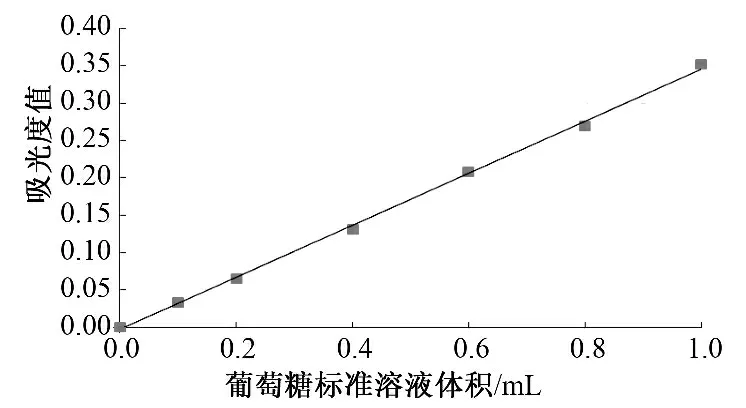
图1 苯酚-硫酸法测粗多糖的标准曲线Fig.1 The standard curve of the polysaccharides using phenol-sulfuric acid determination method
2.2 淀粉的定性判断
通过碘溶液判断淀粉残留试验结果得出,各单因素试验中所得酶解辅助提取液碘色反应变蓝,即各提取液中均含有淀粉;其各自再经酶解纯化后的纯粗多糖待测溶液中,碘色反应不变蓝,即不含淀粉,内容物为纯化后的多糖.
2.3 α-淀粉酶添加量对山药多糖得率和纯度的影响
α-淀粉酶添加量对山药多糖得率及纯度的影响如图2 所示.随着α-淀粉酶添加量的增加,提取液粗多糖得率由2%左右逐渐上升至3%以上.粗多糖纯度由30%左右明显上升至50%以上并保持相对稳定.
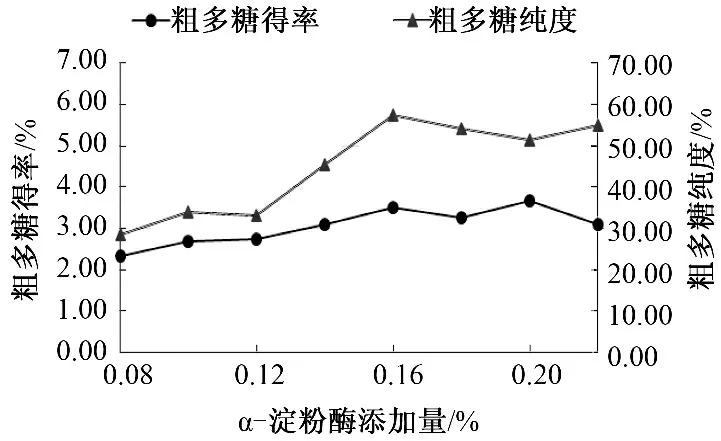
图2 α-淀粉酶添加量对山药多糖得率及纯度的影响Fig.2 The effect of the α-amylase dosage on the yield and purity of polysaccharides in Chinese yam
由于苯酚-硫酸法的局限性,淀粉在该体系中会同多糖一样,经硫酸放热水解成糠醛类化合物,并与苯酚显色.结合提取液中碘色反应与图2 可知,经过酶解辅助提取过程,山药中淀粉并未完全酶解糖化,所得的山药提取液中仍有部分淀粉混入,以该液直接采用醇沉苯酚硫酸显色所得粗多糖总量中,有淀粉混入所致的虚高;经过精制酶解去除淀粉后所测得的粗多糖含量,为除去了淀粉的纯多糖,其与粗多糖总量之比即为提取液中粗多糖的纯度.由图2 可知,随着α-淀粉酶添加量的增加,粗多糖的溶出也逐渐增加并保持在一定区间内,而混入提取液中的淀粉量逐渐下降至较为平稳的状态,即提取液中粗多糖的纯度有明显提高并保持稳定.α-淀粉酶添加量在0.16%左右时,山药中粗多糖的释放量达到最大值,纯度也最高,混入的淀粉量最少.
2.4 糖化酶添加量对山药多糖得率和纯度的影响
糖化酶添加量对山药多糖得率及纯度的影响如图3 所示.随着糖化酶添加量的增加,提取液粗多糖得率由5%逐渐下降至3.5%左右.粗多糖纯度由40%左右明显上升至60%以上并保持相对稳定.
由图3 可知,随着糖化酶添加量的增加,粗多糖的得率逐渐降低并保持在一定区间内即粗多糖在一定程度上会被糖化酶酶解而精制,剩余为对酶解反应稳定的纯多糖;而混入提取液中的淀粉量迅速下降,即提取液中粗多糖的纯度有明显提高.在糖化酶添加量为0.12%左右时,山药中粗多糖的得率达到较稳定状态,纯度较高,混入的淀粉量较少.
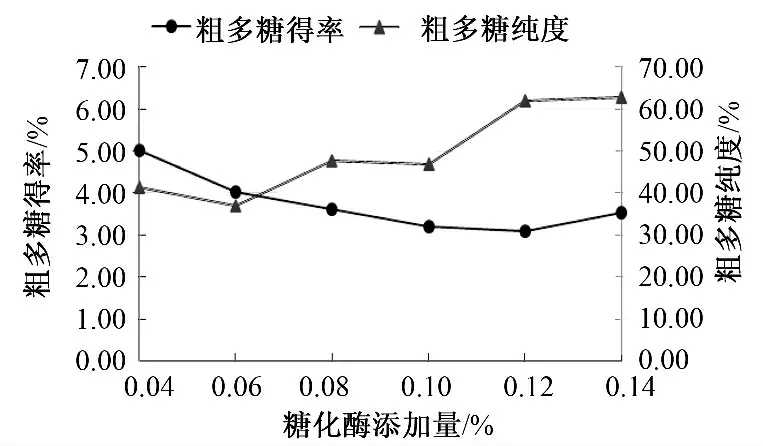
图3 糖化酶添加量对山药多糖得率及纯度的影响Fig.3 The effect of the saccharifying enzyme dosage on the yield and purity of polysaccharides in Chinese yam
2.5 α-淀粉酶酶解时间对山药多糖得率和纯度的影响
α-淀粉酶酶解时间对山药多糖得率及纯度的影响如图4 所示.随着α-淀粉酶酶解时间的延长,提取液粗多糖得率由5%左右逐渐下降至4%左右.粗多糖纯度由60%以下缓慢上升至60%以上并保持相对稳定.

图4 α-淀粉酶酶解时间对山药多糖得率及纯度的影响Fig.4 The effect of the α-amylase hydrolysis time on the yield and purity of polysaccharides in Chinese yam
由图4 可知,随着α-淀粉酶酶解时间的延长,粗多糖的得率与纯度均逐渐趋于平稳状态,即山药中粗多糖的释放逐渐达到最大值,对混入淀粉的消除均逐渐达到最优的平稳状态.即在α-淀粉酶酶解时间60 min 左右时,山药中粗多糖的得率达到较稳定状态,山药淀粉得到了最大程度的水解去除,粗多糖纯度较高,混入的淀粉量较少.
2.6 糖化酶酶解时间对山药多糖得率和纯度的影响
糖化酶酶解时间对山药多糖得率及纯度的影响如图5 所示.随着糖化酶酶解时间的延长,提取液粗多糖得率由5%以上逐渐下降至4%左右.粗多糖纯度维持在60%以上并保持在较小区间内.
由图5 可知,随着糖化酶酶解时间的延长,粗多糖的得率与纯度均逐渐趋于平稳状态.由于糖化酶的作用为继续水解淀粉酶水解出的淀粉支链片段,则其反应时间对于溶解淀粉的含量及粗多糖得率的变化较为不明显,可能对真正的多糖有过度水解作用,从而使得粗多糖得率降低.即在糖化酶酶解时间60 min 时,山药中粗多糖的得率达到较为稳定状态,且被过度水解部分不多,山药淀粉得到了最大程度的水解去除,粗多糖纯度较高,混入的淀粉量较少.
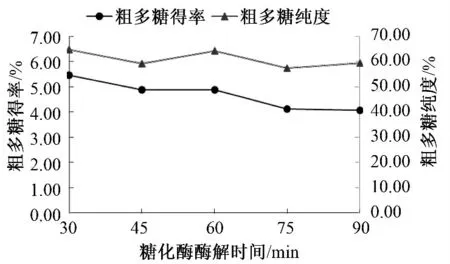
图5 糖化酶酶解时间对山药多糖得率及纯度的影响Fig.5 The effect of the saccharifying enzyme hydrolysis time on the yield and purity of polysaccharides in Chinese yam
综合前面各单因素试验结果可得出酶解辅助提取山药多糖的最优工艺为:以含山药原料质量浓度5%的提取溶剂计,α-淀粉酶添加量为0.16%,淀粉酶酶解时间为60 min,糖化酶添加量为0.12%,糖化酶酶解时间为60 min.
2.7 酶解辅助提取多糖工艺与温水浸提工艺对比
根据前面所得酶解辅助提取最优工艺,提取所得粗多糖与温水浸提粗多糖,在得率及纯度方面的对比结果如图6 所示.
由图6 可知,酶解辅助提取工艺粗多糖得率为4.36%,温水浸提工艺得率为1.23%.即在酶解辅助下,粗多糖的得率提高了2.5 倍左右;酶解辅助提取的多糖纯度为61.02%,较温水浸提工艺所得多糖纯度高30 个百分点,提高了1 倍左右.
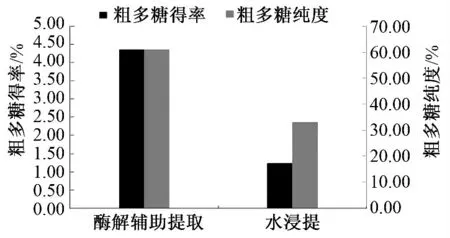
图6 酶解辅助提取工艺与温水浸提工艺粗多糖得率及纯度的对比Fig.6 The comparison of the enzymolysis-assistant extracting method and normal immersing extracting method on the yield and purity of polysaccharides in Chinese yam
3 结论
山药的提取目前多为水提,受限于较低的水提温度和淀粉的干扰,山药多糖的得率、纯度并不高,由浸提所测得的山药多糖含量也相对较低,为2.15%~2.92%[3].且由于检测方法的局限性,其所测得的山药多糖含量会由于混有淀粉而偏高.曾凡梅等[4]则采用了超声波协同纤维素酶解共同辅助提取山药多糖,使其多糖得率达到2.48%.但其所得多糖的纯度并未测定,其多糖检测方法没有排除淀粉混入带来的干扰.张卫明等[2]在测定山药中粗多糖含量时采用了淀粉酶进行辅助提取,并对比了温水浸提和开水煮提所得结果,得出与本试验相似的结论,即开水煮提会使淀粉溶出导致多糖值的虚高,温水浸提则得率过低,酶解法则能较为准确地反映出山药多糖的含量,其得出多糖含量为3.53%.但该文未对酶解所得山药多糖的纯度进行进一步研究,也未对酶解辅助提取工艺进行深入探索.在本试验中,将淀粉酶、糖化酶运用到了对多糖的辅助提取中,从多糖得率和多糖纯度两方面,与普通水浸提工艺进行了对比研究.从产物山药多糖方面来看,酶解辅助提取工艺无论从得率还是纯度上,都较普通水浸提有明显优势.从工艺条件方面来看,两种提取方式在溶剂消耗、时间消耗和工艺复杂性上各有优缺点.综合产物及工艺两方面对比结果认为,酶解辅助有助于山药多糖的提取,该工艺优于普通水浸提工艺.
采用α-淀粉酶、糖化酶辅助提取山药多糖,得率明显提高的原因可能与山药中淀粉颗粒有关.山药中淀粉颗粒外形随品种不同而有很大的差异,颗粒平均粒径最大为36.96 μm,最小为23.39 μm[5],整体平均粒径小于马铃薯淀粉,且呈圆形、椭圆形、不规则的多角形和立方形等多种形态,淀粉颗粒表面光滑无裂痕[6].山药多糖的多级结构与淀粉颗粒在空间上可能有一定交叉,且淀粉颗粒可能对山药多糖形成包裹状态.采用单纯水浸提,不破除淀粉颗粒包裹束缚,山药多糖则无法完全释放;而经过淀粉酶、糖化酶的酶解,淀粉颗粒破裂,促进了山药多糖的溶出,从而达到了辅助提取的目的.同时,经过淀粉酶、糖化酶的初步酶解,对混入提取液中的淀粉也进行了有效地清除,大大提高了所得提取液中粗多糖的纯度.
[1]高鑫.山药块茎抗性淀粉形成的影响因素及理化特性的研究[D].呼和浩特:内蒙古农业大学,2012.
[2]张卫明,单承莺,杭悦宇,等.温度因素对薯蓣多糖测定的影响研究[J].食品科学,2008,29(5):393-395.
[3]王震宙,黄绍华.山药中的功能保健成分及其在食品加工中的应用[J].食品工业,2004(4):51-52.
[4]曾凡梅,张恒,孔明航.超声波协同纤维素酶提取山药多糖的工艺及组分测定研究[J].江西食品工业,2010(2):32-39.
[5]王旭.山药淀粉改性及山药蛋白复合物的研究[D].天津:天津大学,2008.
[6]孟祥艳,赵国华.山药淀粉的特性及应用研究[J].食品工业科技,2008,29(1):292-294.

