拉米夫定与原儿茶酸药物组合体内抗鸭乙肝病毒研究
张建武,马恒,魏一,王玲,孟沫然,韩凤梅,陈勇
(湖北省中药生物技术重点实验室(湖北大学),湖北省生物资源绿色转化协同创新中心(湖北大学),湖北武汉430062)
0 引言
拉米夫定(lamivudine,简称3TC)作为一种口服抗病毒药物是第一个获FDA批准的,它对患者血清HBV(乙型肝炎病毒)-DNA呈现快速显著的抑制作用,但是对抗原的抑制作用较低,而且停药后症状易复发,长期用药会引起DNA聚合酶区YMDD基序变异,可增大病毒对该药的耐受性,因此限制了其临床应用[1-2].原儿茶酸(protocatechuic acid,PA)具有一定的抗HBV的作用,且叶下珠、丹参、五味子等有效抗HBV的中药提取物中均含有PA,前期有研究表明,PA体外对HepG2.2.15细胞中HBV DNA的抑制率高达46.54%,而且对HBsAg和HbeAg均具有一定的抑制作用[3-5].
本实验室前期研究表明,3TC联合PA可抑制HepG 2.2.15细胞分泌HBV DNA和抗原[6],同时对HBV X蛋白入核[7]及感染鸭乙型肝炎病毒(DHBV)吸附、进入和感染鸭原代肝细胞[8]均有一定的协同抑制作用,同时还可降低血清AST和ALT[8].在药动学方面:二者联用后3TC和PA的吸收速度均降低,同时3TC的吸收总量增大,PA消除减慢,即可延长二者其在体内作用的时间[9].本实验主要是以樱桃谷鸭雏鸭为研究对象,通过感染DHBV进行造模,结合实验室前期的研究,进一步考察3TC和PA药物组合体内抗DHBV的作用及其保肝护肝的作用.
1 材料与方法
1.1 主要试剂 拉米夫定(纯度≥98%)、原儿茶酸(纯度≥98%)购于武汉施瑞科技有限公司;门冬氨酸鸟氨酸颗粒剂(简称门鸟)受赠于武汉启瑞药业有限公司;阿昔洛韦受赠于邦伦来福药业;重组质粒PCR211-DHBV115(DQ276978片段,含3 024 bp[10])及DHBV强阳性血清(病毒拷贝数>5×109/mL)受赠于同济医院临床免疫研究室(质粒拷贝数为7.06×1010/mL);PCR引物是由上海英骏生物技术有限公司合成;SYBR Green qPCR mix购自于TOYOBO(上海)生物科技有限公司;谷草转氨酶(AST)试剂盒、谷丙转氨酶(ALT)试剂盒、碱性磷酸酶(ALP/AKP)测定试剂盒、白蛋白测定试剂盒(ALB)及总胆红素(TBil)测定试剂盒购自于南京建成生物工程研究所;乙肝表面抗原(HBsAg)测定试剂盒购自于上海自科华生物工程股份有限公司;病毒DNAout购自于北京天恩泽基因科技有限公司.
1.2 主要仪器 TriStar LB941多功能酶标仪(德国Berthold公司);MJ-Mini Option Real-Time PCR system(美国Bio-Rad公司);超低温冰箱(法国Jouan公司).
1.3 动物模型 樱桃谷鸭,1~3日龄(简称雏鸭,雌雄不限),颈静脉采血后分离血清,以灭菌双蒸水作为空白对照、DHBV强阳性血清作为阳性对照,采用荧光定量PCR扩增血清中DHBV DNA特异序列,从而筛选出血清中DHBV DNA拷贝数<104/mL的雏鸭.筛选后的雏鸭以0.2 mL/只的剂量经腿静脉注射DHBV强阳性血清(DHBV DNA拷贝数>5×109/mL)进行感染,7 d后,采血分离血清,用RT-PCR筛选拷贝数在108/mL左右的雏鸭,即造模成功的模型动物.
1.4 RT-PCR标曲的制备[11]首先,找出重组质粒PCR211-DHBV115 DNA的保守序列(primer-BLAST软件),根据该保守序列设计出荧光定量PCR检测DHBV引物序列(primer3.0软件):Ps1 5′-GCCTTAGCCAATGTGTATGATC-3′,Ps2 5′-CGTGCTGAATAAGATAACCTGTG-3′;然后配制一系列的标准溶液(质粒拷贝数依次为103、104、105依次至1010/mL),再加入DHBV引物,最后进行RT-PCR.PCR扩增条件为:首先94℃预热5 min,再按照94℃50 s,51℃45 s,72℃20 s的条件进行40次PCR扩增循环.以纵坐标为质粒拷贝数对数(log拷贝数),横坐标为样品到达对数期的循环数(Ct值),分别建立给药周期的RT-PCR标曲:log拷贝数=-0.285 7Ct+13.650,r=0.997 8和不同给药剂量的RT-PCR标曲:log拷贝数=-0.375 7 Ct+13.076,r=0.997 3.
1.5 血清中DHBV DNA定量分析[12]用乙醚将雏鸭麻醉之后,经腿经脉采血0.5 mL,12 000 r/min离心10 min,分离血清,再用一管式病毒DNAout试剂盒提取血清中的病毒DNA进行RT-PCR.根据前期已建立的RT-PCR标曲,可测定待测样品中的DHBV DNA拷贝数.
1.6 体内量-效实验方法[13]实验分组:感染DHBV模型雏鸭对照组(灌胃等量0.85%氯化钠),阿昔洛韦100.0 mg/kg组,门冬氨酸鸟氨酸(简称门鸟)5.0 g/kg组,以及3TC/PA(1∶1)分别为12.5、25.0、50.0、100.0、150.0 mg/kg的合用组,将感染后的雏鸭进行随机分组、每组10只.各组一日灌胃一次,连续灌胃给药14 d.分别在给药之前(T0)、给药后第7天(T7)、给药后第14天(T14)以及停药后的第3天(P3),每只雏鸭经腿经脉采血0.5 mL,然后分离血清进行肝功能相关的生化指标和DHBV DNA拷贝数的检测.
1.7 体内时-效实验方法[14]实验分为感染DHBV模型雏鸭对照组,正常雏鸭对照组,阿昔洛韦100.0 mg/kg组,门鸟5.0 g/kg组,以及3TC/PA(1∶1)50.0 mg/kg合用组,随机分组、每组10只.每日灌胃给药一次,连续给药28 d.对照组灌胃等量0.85%氯化钠.分别于给药前(T0)、给药7 d(T7)、给药14 d(T14)、给药21 d(T21)、给药28 d(T28)和停药5 d(P5),经腿静脉采血,每只0.8 mL,然后分离血清进行DHBV DNA拷贝数和ALT、AST以及DHBsAg检测.
1.8 统计学分析 使用SPSS 17.0统计软件对每组数据进行单因素方差分析.
2 结果
2.1 不同的给药剂量对病毒抑制作用及肝功能的影响 研究不同的给药剂量情况下,血清中DHBV DNA含量的变化,结果见表1.

表1 每组用药前后血清中DHBV DNA的含量(Xˉ±s)
模型对照组和门鸟5.0 g/kg组在用药T0~T14及P3时,血清DHBV DNA含量没有出现显著变化(P>0.05).阿昔洛韦100.0 mg/kg组给药T7、T14时血清DHBV DNA含量显著下降(P<0.05),P3后DHBV DNA含量与用药T14相比显著升高(P<0.05),出现明显“反跳”.3TC/PA的各个剂量组于用药第T7、T14时对血清DHBV DNA含量均有显著的抑制作用,并且抑制作用随着给药剂量的加大而增强;P3时对DHBV DNA的抑制率分别为15.8%、17.0%、21.7%、20.7%、21.5%,其中25.0、50.0、100.0 mg/kg组P3时DHBV DNA含量无明显反跳,12.5、150.0 mg/kg组有较明显反跳.另外,3TC/PA50.0 mg/kg给药T14及P3时血清DHBV DNA含量均显著低于阿昔洛韦100.0 mg/kg组(P<0.05或P<0.01).
研究了给药剂量对雏鸭肝功能的影响,各组用药前后血清中各项肝功能生化指标测定结果见表2.
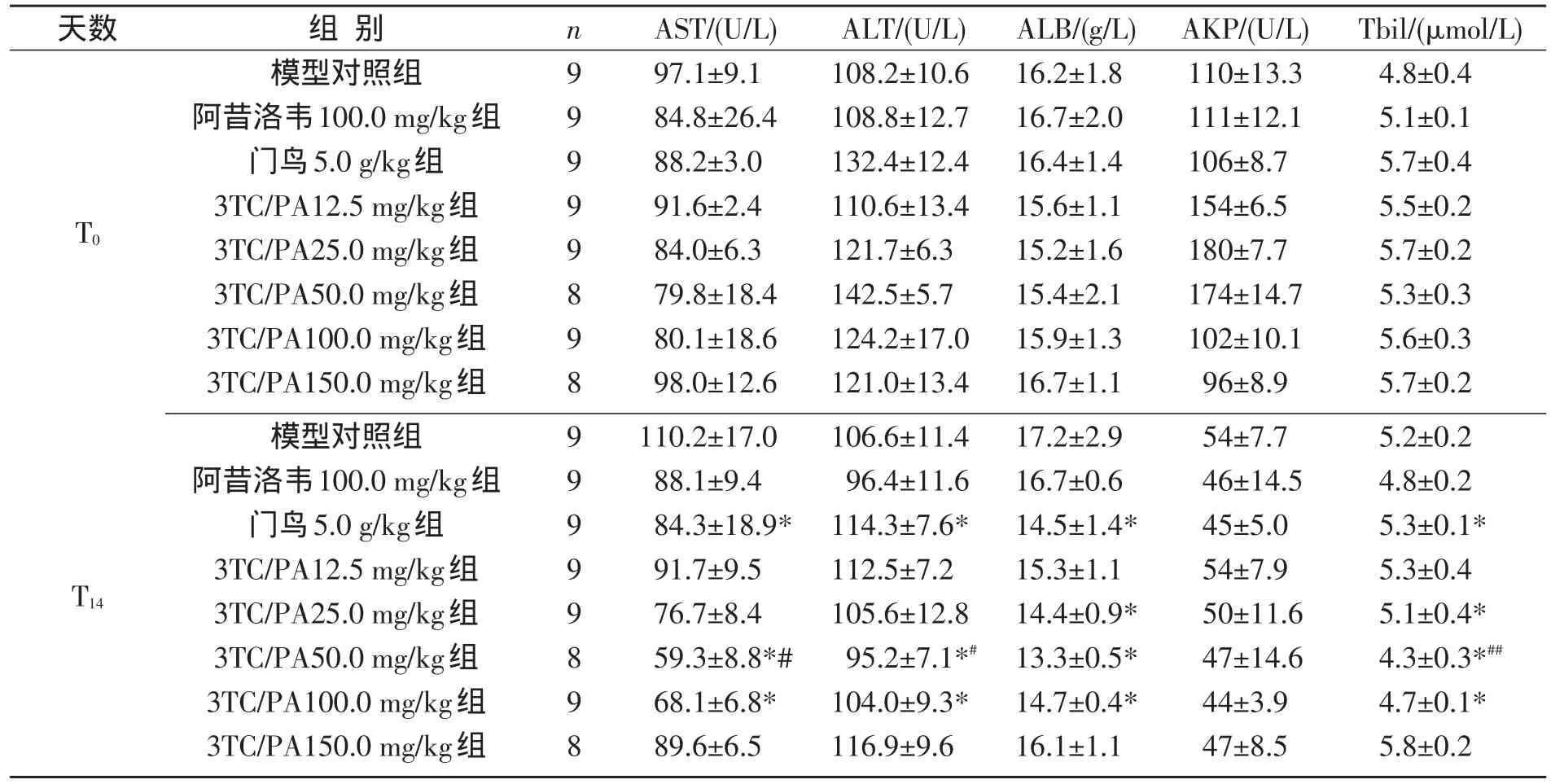
表2 各组用药前后血清中肝功能生化指标(Xˉ±s)
结果显示,在T14后,门鸟5.0 g/kg、3TC/PA(1:1)50.0及100.0 mg/kg组血清中的ALT、AST、ALB及TBil与同组给药前水平相比,均显著低于给药前水平(P<0.05),3TC/PA 25.0 mg/kg组ALB、Tbil亦显著低于同组给药前水平(P<0.05);各组AKP活性较用药前均大幅下降,即使模型对照组也不例外(原因尚不明确);阿昔洛韦100.0 mg/kg组给药前后各项指标(除AKP外)无显著变化(P>0.05).另外,T14时50.0 mg/ kg 3TC/PA组AST、ALT和Tbil值亦显著低于5.0 g/kg门鸟组(P<0.01或P<0.05).
2.2 给药周期对病毒抑制作用及肝功能的影响 研究给药期间对血清DHBV DNA、DHBsAg含量的影响,其结果分别见于表3和表4.结果显示,100.0 mg/kg剂量组的阿昔洛韦给药T7~T28及和P5后的血清DHBV DNA含量与同组用药前相比较具有显著性降低(P<0.05或P<0.01),但是在P5后DHBV DNA含量与同组给药T28时的水平相比,出现反跳现象,显著高于给药前水平(P<0.05).50.0 mg/kg剂量组的3TC/PA在给药T28内,血清中DHBV DNA的水平均显著低于同组给药前水平(P<0.01),虽然在P5后DHBV DNA含量出现一定的反跳现象,但与T28时的DHBV DNA水平相比并没有显著差异(P>0.05).而且50.0 mg/kg剂量组的3TC/PA在给药T21、T28以及P5的血清DHBV DNA水平均显著低于100.0 mg/kg剂量的阿昔洛韦组(P<0.05或P<0.01).

表3 各组给药前后血清中DHBV DNA的含量(Xˉ±s)

表4 各组给药前后血清中DHBsAg水平(Xˉ±s)
结果显示,100.0 mg/kg剂量组的阿昔洛韦给药T7~T28以及P5后血清DHBsAg含量与同组用药前相比较具有显著性降低(P<0.05或P<0.01),但是在P5后DHBsAg含量与同组T28时的水平相比出现反跳现象,显著高于T28时水平(P<0.05).50.0 mg/kg剂量的3TC/PA组给药T7~T28以及P5后血清DHBsAg含量与同组用药前相比较具有显著性降低(P<0.01),且P5后与同组T28时水平无显著差异,并无明显的反跳.另外,50.0 mg/kg剂量的3TC/PA组在给药的T21、T28及P5的血清DHBsAg水平均显著低于100.0 mg/kg剂量的阿昔洛韦组(P<0.05或P<0.01).
研究给药周期对雏鸭肝功能的影响,各组给药前后血清AST、ALT测定结果见表5和表6.
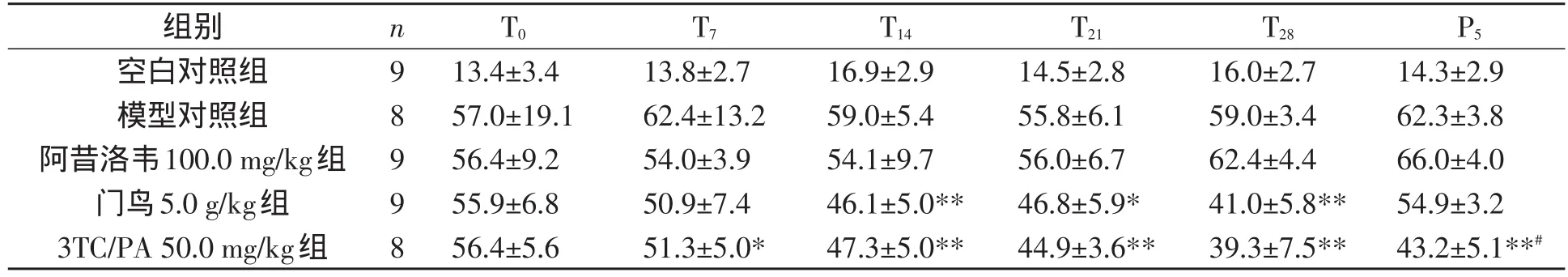
表5 各组用药前后血清中ALT(U/L)水平(Xˉ±s)
结果显示,100.0 mg/kg剂量组的阿昔洛韦对血清中的ALT含量没有明显的影响(P>0.05).5.0 g/kg剂量组的门鸟在给药的T14、T21及T28血清中的ALT值同给药前水平比较均显著性降低(P<0.05或P<0.01),但是在P5后ALT值同组T28时水平相比较,具有明显反跳.50.0 mg/kg剂量组的3TC/PA在给药T7~T28期间的ALT值同给药前水平相比较,均显著降低(P<0.05或P<0.01),并且P5后血清ALT值无明显反跳.另外,P5后50.0 mg/kg剂量3TC/PA组的血清ALT水平亦显著低于5.0 g/kg剂量门鸟组(P<0.05).
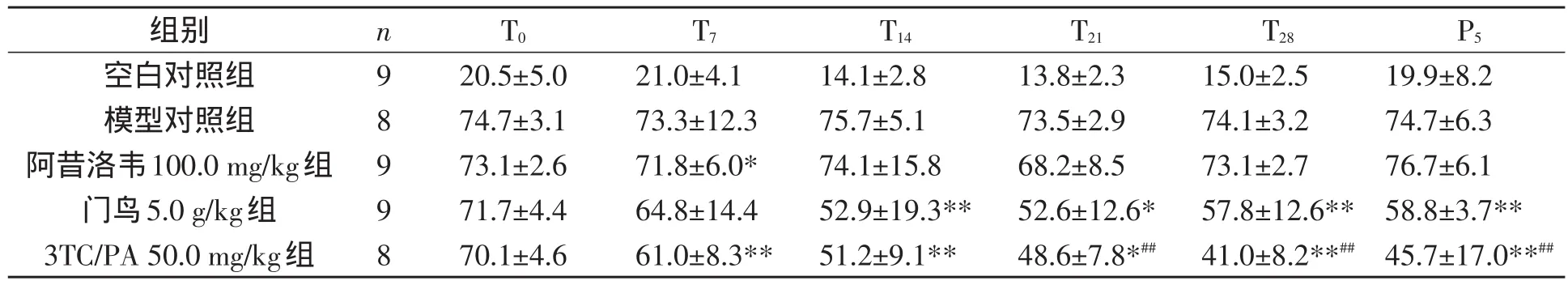
表6 各组用药前后血清中AST(U/L)水平(Xˉ±s)
结果显示,100.0 mg/kg剂量的阿昔洛韦在给药期间对血清AST值水平没有显著性影响(P>0.05).5.0 g/kg剂量的门鸟在给药T14、T21和T28时AST值与给药前水平相比较,均显著降低(P<0.05或P<0.01),同时在P5时AST水平值与T28时水平相比并无显著差异.50.0 mg/kg剂量的3TC/PA在给药T7、T14、T21和T28时AST水平值与同组给药前水平相比较均有显著性降低(P<0.05或P<0.01),在P5后AST值水平具有一定程度的反跳.另外,在给药的T14、T28及P5时,50.0 mg/kg剂量的3TC/PA组血清AST值均显著低于5.0 g/ kg剂量的门鸟组(P<0.01).
3 讨论
本实验室前期研究工作表明,3TC与PA的联合给药,当二者的剂量比(质量分数)为1∶1时,对DHBV DNA的抑制作用最好,同时具有较好的保肝护肝作用[12].本实验选用门鸟[15]为保肝护肝的阳性对照药,阿昔洛韦为抗DHBV的阳性对照药[13]、结合实验室前期的研究,进一步考察3TC和PA药物组合体内抗DHBV及其保肝护肝的作用.
量-效关系研究表明,3TC/PA对血清中DHBV DNA的抑制作用随着给药剂量(12.5~150 mg/kg)的加大而增强,其中100.0 mg/kg和150.0 mg/kg剂量组在P5后DHBV DNA量出现明显的反跳现象.50.0 mg/ kg剂量组在给药的T7~T14期间及P5时DHBV DNA的含量显著低于对照组阿昔洛韦,ALT、AST及Tbil值水平均显著低于门鸟对照组,该结果说明3TC/PA体内抗DHBV的最佳给药剂量为50.0 mg/kg.时-效关系研究表明,在给药的T0~T28期间,3TC/PA在50.0 mg/kg时,对血清中DHBV DNA、DHBsAg、AST和ALT的抑制作用随着给药周期的延长而增强,并且在给药周期中以及P5后血清中DHBV DNA和DHBsAg的水平均显著低于阿昔洛韦对照组,同时血清AST和ALT的水平也显著低于门鸟对照组.该实验结果再次表明,3TC/PA体内抗DHBV的最佳给药剂量为50.0 mg/kg,一方面其抗病毒效果优于阿昔洛韦,另一方面保肝护肝效果优于门鸟.结合早期大量的研究工作,本实验结果进一步证明了3TC联合PA用于抗HBV的科学性与合理性.
[1]Chang CN,Skalski V,Zhou H,et al.Biochemical pharmacology of(+)and(-)-2,3-dideoxy-3-thiacytidine as antihepatitis B virus agents[J].J Biol Chem,1992,276:22414-22420.
[2]Severint A,Liu X Y.Mechanism of inhibition of duck hepatitis B virus polymerase by(-)-2,-3-dideoxy-3-thiacytidine[J]. Antimicrobial Agents and Chemotherapy,1995,39:1430-1435.
[3]刘厚佳,胡晋红,孙莲娜,等.原儿茶酸等化合物对HBV DNA转染人肝癌细胞株的作用[J].第二军医大学学报,2001,22(7):661-663.
[4]ZHOU Zhe,ZHANG Yi,DING Xiao-Ran,et al.Protocatechuic aldehyde inhibits hepatitis B virus replication both in vitro and in vivo[J].Antiviral Research,2007,74:59-64.
[5]Li J,Huang H,Feng M,et al.In vitro and in vivo anti-hepatitis B virus activities of a plant extract form Geranium carolinianum L[J].Antiviral Research,2008,79:114-200.
[6]吴文华,张晓雷,韩凤梅.原儿茶酸与拉米夫定体外联合抗HBV药效学研究[J].湖北大学学报:自然科学版,2011,33 (2):193-196.
[7]朱文婷,陈勇,吴建国,等.拉米夫定与原儿茶酸药物组合对HBV X蛋白入核的影响[J].中国药学杂志,2010,45 (11):832-834.
[8]王玲,陈勇,韩凤梅,等.拉米夫定联合原儿茶酸在鸭原代肝细胞中抗鸭乙肝病毒的研究[J].中华中医药杂志,2012,27(9):2308-2312.
[9]柳力,蔡文涛,陈勇,等.拉米夫定与原儿茶酸在大鼠体内的药动学相互作用[J].中国药学杂志,2010,6(46):450-453.
[10]胡权,张正茂,张小勇,等.鸭乙型肝炎病毒全基因质粒构建及表达[J].中国公共卫生,2007,23(5):562-564.
[11]Wang Chi-Young J,Giambrone Joseph J,Smith Bruce F,et al.Comparison of cell culture systems for duck hepatitis B virus using SyBr green quantitative PCR[J].Journal of Virological Methods,2002,106:175-184.
[12]潘琪,王玲,陈勇,等.拉米夫定与原儿茶酸药物组合体内抗鸭乙肝病毒研究[J].中华中医药杂志,2011,11(26): 2500-2504.
[13]王健,张士军,巫世红,等.岩黄连提取物体内抗乙型肝炎病毒作用研究[J].中国药业,2009,11:7-9.
[14]李小月.叶下珠复方Ⅱ号抗乙肝病毒及免疫性肝损伤药效学及机理研究[D].广州:广州中医药大学,2009.
[15]陈明妃,李如成,陈长虹,等.左旋门冬氨酸鸟氨酸治疗肝硬化合并肝性脑病疗效观察[J].第一军医大学学报,2005,26(6):718-722.

