一种新型ATP-依赖型ClpP家族蛋白质水解酶PlclpP基因的克隆、表达和酶学特性
龚 丽, 李云霞
(农业部水产品贮藏保鲜质量安全风险评估重点实验室<上海>,上海海洋大学食品科学与技术学院,上海 201306)
蛋白质水解酶占据全球酶制剂市场约60%,广 泛应用于食品、医药、洗涤剂、农业等领域[1]。微生物是水解酶的主要来源,探索、开发微生物水解酶新基因资源对于解决目前商品化酶制剂种类和来源较少、底物单一、价格昂贵等问题具有重要意义。
ClpP(Caseinolytic peptidase)家族ATP-依赖型伴侣分子相连(Chaperone-linked)的酪蛋白水解肽酶广泛存在于原核和真核生物中[2]。它们利用ATP驱动蛋白质底物解折叠并转位进入蛋白质水解腔(Chamber)中将蛋白质降解成小分子肽[3]。ClpP蛋白酶于1988年首次发现于Escherichia coli中[4]。此后的大量研究结果表明,E.coli中ClpP蛋白酶(EcClpP)由蛋白质水解核心ClpP和依赖ATP的伴侣分子ClpA或ClpX组成,其蛋白质水解腔由催化位点序列形成的2个反向同型七聚体环构成[2]。在国外ClpP蛋白酶已商品化,可是在国内,迄今为止,尚无涉及ClpP家族蛋白酶的研究报道。此外,有关Paenibacillus spp.中clpP基因功能的研究国内外均无报道。本研究采用基因克隆技术,以本实验室分离鉴定获得的蛋白质水解酶高活性Paenibacillus lautus CHN26菌株基因组 DNA为模板,克隆PlclpP基因,并在E.coli BL21中进行异源表达,为ClpP家族蛋白酶基础理论研究和应用研究奠定基础。
1 材料与方法
1.1 试验材料
MiniBEST细菌基因组DNA提取试剂盒和质粒提取试剂盒、Premix Ex Taq Verision 2.0、T4 DNA ligase均购自TaKaRa宝生物工程(大连)有限公司;限制性核酸内切酶BamH I和Hind III购自Promega公司(美国);Luria-Bertani(LB)培养基购自北京陆桥技术有限责任公司;卡那霉素和氨苄青霉素、聚丙烯酰胺和N,N′-亚甲双丙烯酰胺等SDS-PAGE试剂,以及蛋白质定量检测试剂盒等购自生工生物工程(上海)有限公司;蛋白裂解试剂BugBuster Protein Extraction和纯化试剂Ni-NTA His·Bind®resin购自Merck Millipore公司(德国);β-酪蛋白为Sigma-Aldrich公司产品(美国)。
E.coli TOP10和E.coli BL21,以及基因克隆载体pGM-T(Ampr)购自天根生物技术有限公司;基因表达载体pET-28a(Kmr)购自Merck Millipore(德国)公司;蛋白质水解酶高活性类芽孢杆菌(P.lautus)CHN26菌株由本实验室分离鉴定保存[5]。
1.2 试验方法
1.2.1 PlclpP基因的克隆 采用Primer5.0软件(http://www.premierbiosoft.com/)设计PlclpP基因PCR扩增上、下游引物ClpP-P1f(5′-ATGGAGGATGAAACCATGAA-3′)和ClpP-P1r(5′-TCACAGTTTGGTGACGATGT-3′),以及在5′端分别引入限制性核酸内切酶BamH I和Hind III酶切位点(以下划线表示)的上、下游引物ClpP-P2f(5′-CG GGATCCATGGAGGATGA-3′)和ClpP-P2r(5′-CCC AAGCTTCAGT TTGGTGAC-3′)。寡核苷酸引物合成和DNA序列测定由生工生物工程有限公司(上海)完成。基因组和质粒DNA的提取方法参考试剂盒说明书,参考Shi等的方法[6]进行 PCR反应、产物纯化、酶切、DNA片段连接、转化以及菌落PCR检测等,利用CLUSTAL 2.1软件(www.ebi.ac.uk/Tools/services)进行多序列比对分析。
1.2.2 蛋白质表达、纯化 参考Li等的方法[5]进行PlclpP基因表达质粒的构建,蛋白质的诱导表达,组氨酸标签(His-tag)亲和纯化以及 SDSPAGE等。
1.2.3 蛋白质水解酶活性的检测 用β-酪蛋白为底物,在150 μl酶反应液[含2.7 μg β-casein、5 μl 0.1 mol/L ATP、2 mmol/L ZnCl2、50 mmol/L Tris-HCl(pH 7.3)]中加入50 μl纯化酶进行反应。在40℃、pH 7.0条件下,30 min内水解β-酪蛋白使OD562值增加0.01的酶量,定义为1个酶活力单位(U)[7]。参考Li等的方法[5]测定温度、pH值、表明活性剂(SDS、Tween-20、Tween-80)和蛋白酶抑制剂(Phenylmethanesulfonyl fluoride,PMSF)对PlClpP复合物酶活性的影响。
2 结果
2.1 P.lautus CHN26菌株PlclpP基因的分子克隆及其序列分析
根据 GenBank数据库中 Paenibacillus sp.Y412MC10菌株(GenBank:NC_013406.1)clpP基因序列,设计PCR扩增引物 clpP-P1f/r。提取P.lautus CHN26基因组DNA并以其为模板,进行PCR扩增,获得585 bp的单一PCR扩增产物。PCR产物经纯化后与克隆载体pGM-T连接,转化E.coli TOP10感受态细胞。筛选、提取Ampr阳性转化子重组质粒,经 DNA序列测定,发现克隆获得的 P.lautus CHN26 clpP基因(命名为PlclpP)编码194个氨基酸,预测蛋白质分子量约为2.1×104。
BLAST序列比对分析结果显示,PlclpP序列与GenBank数据库中Paenibacillus的ATP-依赖型ClpP蛋白酶水解亚单位氨基酸序列相似性为 71%~ 98%,而与EcClpP的氨基酸序列相似性仅为62%。可是,clpP基因多序列比对分析结果显示,PlclpP基因序列含有 S14_ClpP家族特征性八肽结构域(KDIHMYIN,59~66 aa)(图1)。其中位于第59位的赖氨酸(Lys59,K)、第60位的天冬氨酸(Asp60,D)以及第64位的催化亲核物质(Catalytic nucleophile)酪氨酸(Tyr64,Y)为高度保守的催化三分体残基(Catalytic triad residues),在酪蛋白水解中发挥重要作用[8]。此外,PlclpP序列还含有丝氨酸蛋白水解酶高度保守的催化活性位点(Ser99-His124-Asp173) (图1)。

图1 ClpP蛋白酶多序列比对分析Fig.1 Multiple sequence alignment of caseinolytic peptidase(ClpP)
2.2 PlclpP基因表达质粒pET-28a-PlclpP的构建与鉴定
基于本研究获得的PlclpP基因序列,我们设计了携带限制性核酸内切酶BamH I和Hind III酶切位点的引物 clpP-P2f/r,采用 PCR方法扩增PlclpP基因,获得了单一PCR产物。采用BamH I和Hind III双酶切PCR产物,回收纯化酶切产物。同时,提取表达载体 pET-28a的质粒 DNA,经BamH I和Hind III双酶切为线性的DNA片段,酶切产物的琼脂糖凝胶电泳鉴定结果如图2所示。
将上述纯化后的酶切片段经T4-DNA连接酶连接后,转化E.coli BL21感受态细胞,在含有30 μg/ml卡那霉素的LB琼脂平板上,采用菌落PCR方法筛选获得阳性转化子克隆(图2)。提取阳性转化子重组质粒 DNA,经BamH I和Hind III双酶切验证为单一DNA片段插入,大小约0.6 kb(图2)。经DNA序列测定验证插入片段为PlclpP基因。
2.3 PlclpP基因的表达和纯化
采用LB液体培养基(含30 μg/ml卡那霉素)于20℃培养含有重组表达质粒的E.coli BL21(pET-28a-PlclpP),通过0.6 mmol/L IPTG诱导表达18 h,获得含有组氨酸标签的重组PlClpP蛋白质,分子量约为2.1×104,与预测的ClpP蛋白质分子量大小相一致(图3)。同时还获得了分子量约为2.5×104的复合PlclpP蛋白质。利用Ni-NTA-His·Bind resin纯化法,纯化E.coli BL21菌体裂解后的无细胞提取液,经SDS-PAGE分析洗脱液各组分,获得纯 化的目标蛋白质PlClpP(图3)。

图2 Paenibacillus lautus CHN26 PlclpP基因表达质粒pET-28a-PlclpP的构建与鉴定Fig.2 Construction and identification of the expression plasmid pET-28a-PlclpP of Paenibacillus lautus CHN26 PlclpP
2.4 PlClpP复合物的蛋白水解酶活性
以非折叠态模式底物β-酪蛋白为底物,在含有2.5 mmol/L ATP的反应液中分析了纯化PlClpP复合物在不同温度下的蛋白水解酶活性,结果显示PlClpP复合物的最适反应温度为40℃(图4),明显高于P.lautus CHN26和E.coli BL21的最适生长温度37℃。分析该复合物在不同温度下的稳定性,发现PlClpP复合物在10~40℃条件下处理3 h后相对酶活性仍高于90%,说明PlClpP复合物具有嗜中温反应特性(图4)。此外,还分析了pH对PlClpP复合物蛋白水解酶活性的影响,结果显示,该复合物的最适反应pH值为7.0。在酸性(pH≤6.0)和碱性(pH≥7.0)条件下40℃处理12 h后相对酶活性迅速下降,而在pH 6.0~7.0条件下相对酶活性大于87%,证明PlClpP复合物为中性反应特性。
2.5 表面活性剂和蛋白酶抑制剂对PlClpP复合物酶活性的影响
用表面活性剂SDS、Tween-20、Tween-80于40℃条件下分别处理纯化的PlClpP复合物1 h,然后在最适温度和pH条件下测定残余酶活性,结果显示,终浓度为0.5%的表面活性剂强烈抑制PlClpP复合物酶活性50%~60%。相反,PlClpP复合物对常规的丝氨酸蛋白酶抑制剂具有较强抗性,10 mmol/L PMSF处理PlClpP复合物1 h对酶活性无明显影响。
3 讨论
迄今为止,国内外涉及P.lautus中clpP基因功能的研究尚无文献报道。本研究克隆鉴定了P.lautus CHN26的一种新型蛋白水解酶基因PlclpP,编码194个氨基酸,蛋白质分子量约为2.1×104。采用E.coli pET表达系统,构建PlclpP基因表达质粒pET-28-PlclpP,在E.coli BL21中实现了重组Pl-ClpP蛋白质的表达。利用组氨酸标签(His-tag)亲和纯化法,获得了PlClpP纯化蛋白质。意外发现,在E.coli BL21中异源表达的 PlClpP蛋白质在SDS-PAGE图谱上呈现2条带,分子量分别约为2.1×104和2.5×104。鉴于E.coli EcClpP蛋白酶伴侣分子ClpA或ClpX分别为8.0×104和4.6× 104[9-10],推测PlClpP可能与E.coli BL21中未知伴侣分子形成复合物。未知伴侣分子的序列和功能有待进一步的研究。采用BCA蛋白质定量试剂盒检测了PlClpP的表达量,结果显示,每1 g湿细胞可以产生纯化的重组PlClpP蛋白质复合物约0.54 mg,占细胞总蛋白质约5.25%。PlClpP复合物具有ATP-依赖型酪蛋白水解酶活性,最适反应温度为40℃,明显高于P.lautus CHN26和E.coli BL21的最适生长温度。此外,终浓度为0.5%的表面活性剂SDS、Tween-20、Tween-80强烈抑制PlClpP复合物的酶活,而常规丝氨酸蛋白酶抑制剂(PMSF)对其活性无抑制作用,表明PlClpP属于一类非常规的丝氨酸蛋白酶。
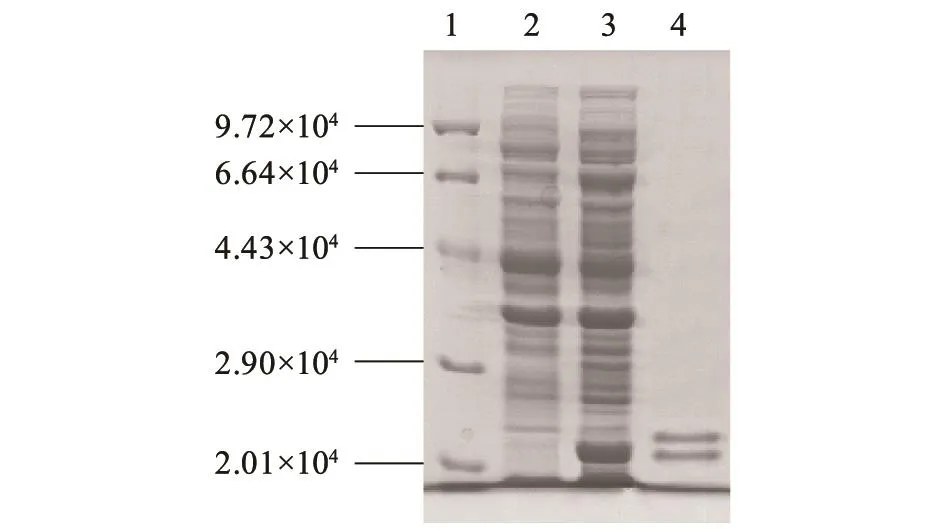
图3 SDS-PAGE检测PlClpP的表达及其纯化Fig.3 The expression and purification of PlClpP detected by SDS-PAGE
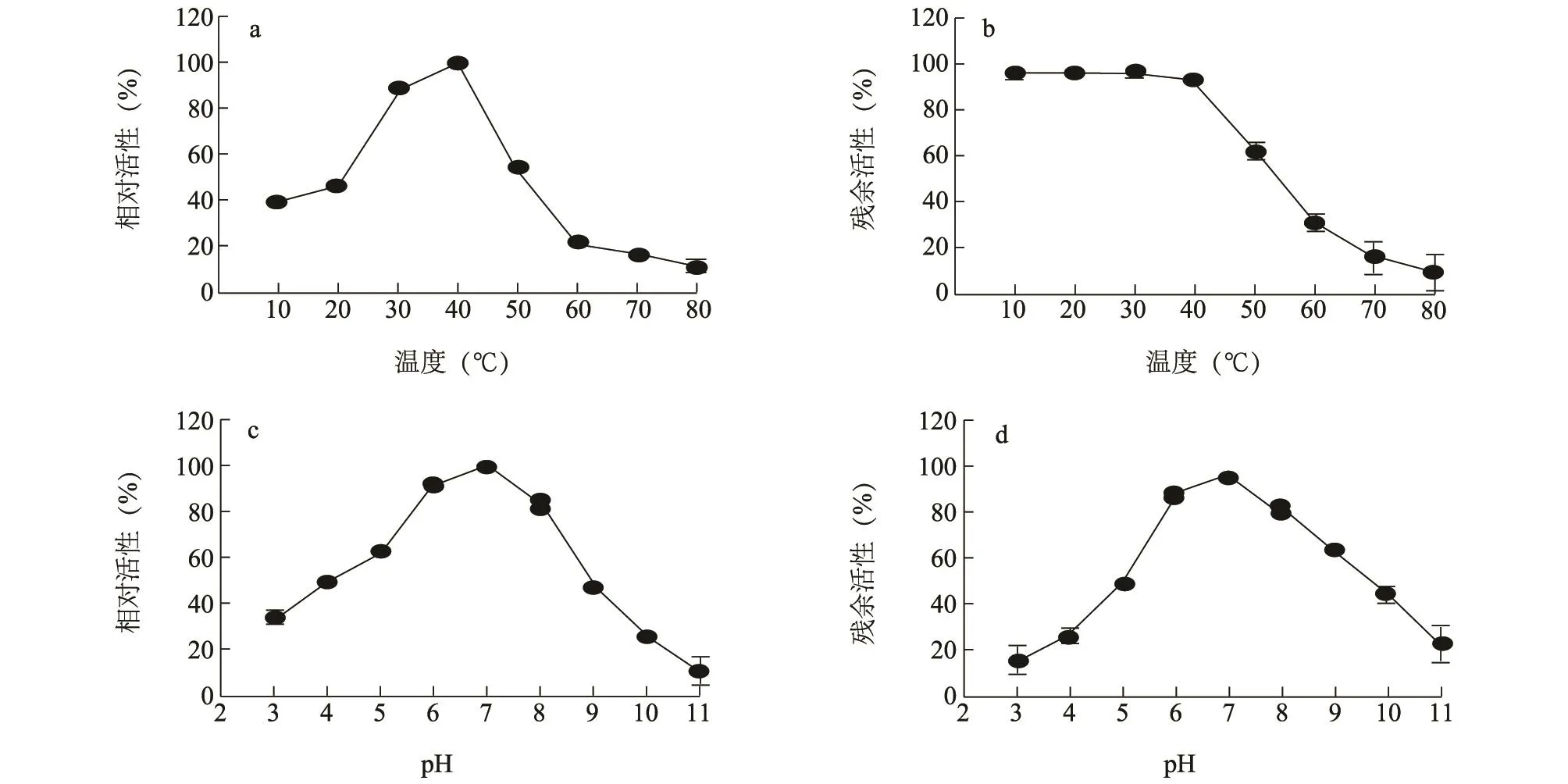
图4 温度和pH对PlClpP复合物蛋白水解酶活性的影响Fig.4 Effects of the temperature and pH on proteolytic activity of PlClpP complex
[1] KRIK O,BORCHERT T V,FUGLSANG C C.Industrial enzyme applications[J].Current Opinion Biotechnology,2002,13(4): 345-351.
[2] KRESS W,MAGLICA Z,WEBER-BAN E.Clp chaperoneeproteases:structure and function[J].Research in Microbiology,2009,160:618-628.
[3] SCHMITZ K R,CARNEY D W,SELLO J K,et al.Crystal structure of Mycobacterium tuberculosis ClpP1P2 suggests a model for peptidaseactivation by AAA+partner binding and substrate delivery[J].Proceedings of the National Academy of the Sciences of the United States of America,2014,111(43):4587-4595.
[4] HWANGS B J,WOOS K M,GOLDBERG A L,et al.A new ATP-dependent protease in Escherichia coli,contains protein-activated ATPase and proteolytic functions in distinct subunits[J].The Journal of Biological Chemistry,1988,263(18):8727-8734.
[5] LI Y,PAN Y,SHE Q,et al.A novel carboxyl-terminal protease derived from Paenibacillus lautus CHN26 exhibiting high activities at multiple sites of substrates[J].BMC Biotechnology,2013,13: 89.
[6] SHI Y,PAN Y,LI B,et al.Molecular cloning of a novel bioH gene from an environmental metagenome encoding a carboxylesterase with exceptional tolerance to organic solvents[J].BMC Biotechnology,2013,13:13.
[7] KASANA R C,YADAV S K.Isolation of a psychrotrophic Exiguobacterium sp.SKPB5(MTCC 7803)and characterization of its alkaline protease[J].Current Microbiology,2007,54(3): 224-229.
[8] BEWLEY M C,GRAZIANO V,GRIFFIN K,et al.Turned on for degradation:ATPase-independent degradation by ClpP[J].Journal of Structural Biology,2009,165:118-125.
[9] GRIMAUD R,KESSEL M,BEURON F,et al.Enzymatic and structural similarities between the Escherichia coli ATP-dependent proteases,ClpXP and ClpAP[J].The Journal of Biological chemistry,1998,273(20):12476-12481.
[10]WOJTKOWIAK D,GEORGOPOULOS C,ZYLICZ M.Isolation and characterizatioonf ClpX,a new ATP-dependent specificity component of the Clp protease of Escherichia coli[J].The Journal of Biological Chemistry,1993,268(30):22609-22617.

