不同功率高强度聚焦超声治疗人胰腺癌移植瘤初步实验研究
洪立立, 郭 志, 邢文阁, 王绍山, 杨雪玲, 王海龙
胰腺癌为常见消化道恶性肿瘤,首选治疗方式是外科手术切除,但约80%患者就诊时已失去手术切除机会[1]。对于不可手术切除的胰腺癌,美国国立综合癌症网络(NCCN)每年发布的各种恶性肿瘤临床实践指南倡导应用多学科技术控制肿瘤生长,改善患者生活质量。近年采用高强度聚焦超声(HIFU)治疗胰腺癌已获得良好效果[2-3],但如何改进HIFU治疗方式,对进一步提高疗效仍有重要意义。本研究观察不同功率HIFU治疗人胰腺癌移植瘤的有效性和安全性,以期为临床应用提供理论依据。
1 材料与方法
1.1 实验动物和人胰腺癌细胞系
BALB/c-nu裸小鼠30只(SPF级,购自北京大学医学部实验动物科学部,许可证号SCXK京2006-0008),雌雄各半,5~6 周龄,体重 18~20 g。人胰腺癌YY-1细胞系源于人胰腺癌导管上皮癌(天津医科大学附属肿瘤医院惠赠)。FEP-BY02型HIFU治疗系统由北京源德医疗设备有限公司提供。
1.2 方法
1.2.1 细胞培养 人胰腺癌YY-1细胞系接种于含10%胎牛血清的McCoy5A培养基中,置于37℃、5%CO2绝对湿度培养箱中培养,每日在倒置显微镜下观察,确保细胞贴壁生长;以0.125%胰蛋白酶消化传代,48~72 h 换液。
1.2.2 BALB/c-nu裸小鼠胰腺癌移植瘤模型建立及实验方法 将处于对数生长的瘤细胞用胰蛋白酶液消化、收集,加入PBS缓冲液制成2×107个/ml细胞悬液;于每只裸小鼠右侧背部皮下注射0.2 ml细胞悬液,接种后3~4周出现肉眼可见肿瘤,模型建立成功。待移植瘤生长至直径约1 cm,随机将裸小鼠分为低功率HIFU治疗组(低功率组)、高功率HIFU治疗组(高功率组)、空白对照组,每组10只。
1.2.3 治疗方法 裸小鼠以10%水合氯醛腹腔注射麻醉,固定于自制鼠板,肿瘤表面皮肤涂耦合剂,水囊充满脱气水后轻压于皮肤表面。定位确定HIFU治疗区域后,于HIFU治疗系统选择肿瘤中心点并设置靶皮距,以连续扫描方式启动手动治疗程序。设置输出功率:低功率组为200 W,高功率组为300 W;其它治疗参数设置:单元发射时间(t1)为990 ms,占空时间(t2)为 10 ms(t2/t1=1/99),总发射次数为4次。对照组同样行麻醉、上机程序,但治疗时关闭电功率。
1.2.4 疗效判定 每2天用游标卡尺测量肿瘤最长径(L)和垂直方向最大横径(W);计算肿瘤体积(V):V(mm3)=LW2/2;不同时间所测 V 与治疗前肿瘤体积(V0)之比为肿瘤生长速率(f)。
1.2.5 不良反应观察 术后1周内观察治疗区皮肤受损情况,声通道上组织有无损伤,内脏有无损伤,腹腔内有无出血、腹水等。
1.2.6 原位杂交技术检测肿瘤细胞凋亡率 HIFU辐照治疗后7 d、14 d,低功率组、高功率组、对照组分别处死5只裸小鼠,获取标本制备肿瘤组织石蜡切片,每片加25~50μl辣根过氧化酶抗体,二氨基联苯胺(DAB)显色后用苏木精对比复染、脱水、透明、固封;末端脱氧核苷酸转移酶-生物素dUTP切口末端标记法(TUNEL)检测切片,阳性表达显示肿瘤细胞核为棕色;400倍显微镜下每张切片取5个不同视野,分别计数高倍视野下阳性表达细胞所占癌细胞比例,取平均值作为最终值并作统计分析。
1.3 统计学方法
所得全部资料建立数据库,采用SPSS 17.0版统计学软件对数据进行分析,计量资料以均数±标准差(x±s)表示,各组间差异的比较用ANOVA方差分析,组内两两比较用最小显著差数法(LSD),P<0.05视为差异有统计学意义。
2 结果
2.1 肿瘤体积变化
HIFU治疗前、治疗后7 d,低功率组、高功率组、对照组裸小鼠肿瘤体积变化见表1。HIFU治疗前各组肿瘤体积变化,无统计学差异(P>0.05);治疗后7 d低功率组和高功率组肿瘤体积与对照组比较均缩小,差异有统计学意义(P<0.05);治疗后7 d低功率组与高功率组肿瘤体积比较,差异无统计学意义(P>0.05)。

表1 HIFU治疗前后各组裸小鼠肿瘤体积变化 cm3
2.2 肿瘤生长速率
低功率组、高功率组、对照组裸小鼠经HIFU治疗后人胰腺癌YY-1细胞移植瘤生长曲线见图1。HIFU 治疗后 3、7、14 d,低功率组、高功率组肿瘤生长速率均明显低于对照组,差异有统计学意义(P<0.05);低功率组肿瘤生长速率与高功率组比较,差异无统计学意义(P>0.05)。

图1 HIFU治疗后各组肿瘤生长曲线
2.3 局部不良反应
HIFU治疗后,高功率组10只裸小鼠中6只(60%)即刻出现术区皮肤水肿,提示伴随皮肤灼伤,约2 d后结痂,其中1只伴随皮肤溃烂;低功率组中2只裸小鼠(20%)出现皮肤灼伤,均于3 d内自愈。高功率组3只(30%)裸小鼠出现声通道组织损伤,低功率组中未见声通道组织损伤。各组裸小鼠均未见内脏损伤、出血、腹水等不良反应(表2)。

表2 HIFU治疗后各组裸小鼠不良反应观察 例(%)
2.4 肿瘤细胞凋亡率
HIFU治疗后7 d,低功率组、高功率组、对照组裸小鼠肿瘤组织细胞凋亡率分别为(63.6±15.2)%、(75.2±11.1)%、(19.0±2.43)%,低功率组、高功率组肿瘤细胞凋亡率明显高于对照组(P<0.05),两组间肿瘤细胞凋亡率差异无统计学意义(P=0.185);治疗后14 d,低功率组、高功率组、对照组裸小鼠肿瘤组织细胞凋亡率分别为(41.4±7.3)%、(55.2±8.9)%、(18.0±2.4)%,低功率组、高功率组凋亡率明显高于对照组(P<0.05),两组间肿瘤细胞凋亡率差异无统计学意义(P<0.05)(图 2)。
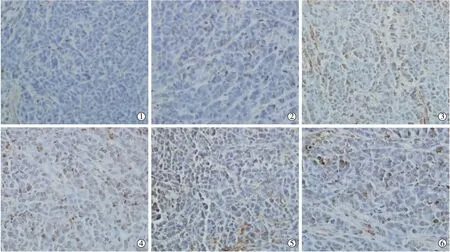
①治疗后7 d,对照组无肿瘤细胞凋亡有表达;②治疗后14 d,对照组无肿瘤细胞凋亡表达较前无明显变化;③低功率组治疗后7 d,肿瘤细胞凋亡表达;④低功率组治疗后14 d,肿瘤细胞凋亡表达减低;⑤高功率组治疗后7 d,肿瘤细胞凋亡表达;⑥高功率组治疗后14 d,肿瘤细胞凋亡表达减低图2 HIFU治疗后各组裸小鼠肿瘤细胞凋亡免疫组化染色(×200)
3 讨论
HIFU治疗作用机制包括热效应、机械效应、空化效应等[4],其中热效应被认为是HIFU最重要作用。有研究表明,消融效应取决于温度和暴露时间2个因素,杀灭肿瘤细胞所需温度与时间呈负相关[5]。但通过提高HIFU治疗功率获取消融温度的方法,不仅患者依从性差,安全性上也存在诸多隐患,动物实验及临床研究中均有皮肤灼伤、术区腹壁疼痛麻木、胃壁灼伤、肠穿孔及肠系膜上动脉栓塞等严重并发症的报道[6-7]。我们在前期临床实践中尝试用降低HIFU功率的方法进行治疗并取得良好疗效[8-9],但尚缺乏相关基础研究证据。
本研究采用提高单元发射时间(t1=990 ms)、缩短占空时间(t2=10 ms)的HIFU辐照模式,该治疗参数2012年由Yuan等[10]报道用于治疗胰腺癌,由于大大缩短了占空时间,使脉冲式发射方式更接近于连续发射模式,利于热量在靶区沉积、减少热量丢失,同时通过降低治疗功率让患者获得更好的依从性。本研究结果表明,低功率组、高功率组HIFU治疗后与对照组相比肿瘤体积缩小、生长速度减慢(P<0.05),说明不同功率HIFU辐照均能有效控制肿瘤生长;低功率组与高功率组间肿瘤体积及生长速率变化之差异无统计学意义(P>0.05),提示降低HIFU治疗功率也可获得同样疗效;治疗后8 d,低功率组和高功率组肿瘤均呈缓慢生长趋势,这可能与治疗中未对肿瘤进行完全消融有关。
本研究中观察到HIFU治疗的不良反应主要为皮肤灼伤和声通道组织损伤,未见内脏损伤、出血及腹水等;与低功率组相比,高功率组不良反应明显增多(P<0.05),说明低功率HIFU治疗方法相对有更好的安全性。高功率组与低功率组均发生皮肤灼伤的原因与下列因素有关:①移植瘤体积相对较小,与皮肤距离较近(靶皮距<1 cm);②声阻抗差异导致超声波进入组织时在水(或空气)和皮肤界面处产生发射、折射等现象,可使局部热能聚集,导致皮肤烧伤[11];③HIFU治疗系统在靶区转化的热量偏向分布于前场。相对于移植瘤实验研究环境,临床上声环境更为复杂,通过降低治疗功率、缩短占空时间的HIFU辐照模式能否有效减少声通道组织损伤,避免因空化效应导致含气的胃肠道发生损伤、穿孔等并发症,有待于进一步研究。
凋亡为细胞程序性死亡,其特征性变化为细胞膜快速起泡及核裂解。HIFU辐照除了使靶组织升温而导致凝固性坏死,还可产生细胞凋亡。有研究证实,HIFU辐照温度接近热凝固温度时可最大程度地诱导细胞凋亡[12]。为观察不同功率HIFU对肿瘤组织细胞凋亡的作用,本研究用TUNEL方法检测细胞凋亡率,结果表明不同功率HIFU均可诱导肿瘤细胞凋亡,HIFU治疗后7 d,低功率组与高功率组肿瘤细胞凋亡率均达到高峰,提示该时间可能是结合放、化疗的最佳时机;治疗后7 d、14 d低功率组与高功率组间肿瘤细胞凋亡率差异均无统计学意义,提示低功率HIFU同样可有效地诱导肿瘤细胞凋亡,利于临床治疗。
综上,适当降低HIFU功率有利于在确保人胰腺癌移植瘤治疗效果的前提下减少不良反应,具有一定的可行性,但仍需要进一步实验研究,以寻找适合的治疗功率。本研究尚存在一些不足之处,如皮下移植瘤模型尚不能精确模拟临床声环境,HIFU治疗功率、治疗剂量及辐照模式之间关系还需要更深入研究。
[1]Saif MW.Advancements in the management of pancreatic cancer:2013[J].JOP,2013,14:112-118.
[2]Wu F,Wang ZB,Zhu H,et al.Feasibility of US-guided highintensity focused ultrasound treatment in patients with advanced pancreatic cancer:Initial experience[J].Radiology,2005,236:1034-1040.
[3]张一平,赵景志,乔新荣,等.动脉灌注化疗联合高强度聚焦超声治疗胰腺癌的临床研究[J].介入放射学杂志,2011,20:964-967.
[4]Zhou YF.High intensity focused ultrasound in clinical tumor ablation[J].World JClin Oncol,2011,2:8-27.
[5]Clarke RL,ter Haar GR.Temperature rise recorded during lesion formation by high-intensity focused ultrasound [J].Ultrasound Med Biol,1991,23:299-306.
[6]熊六林,于晋生,费兴波,等.建立猪胰腺高强度聚焦超声通道的探讨[J].中国超声医学杂志, 2006, 22: 736-738.
[7]Li JJ,Xu GL,Gu MF,et al.Complications of high intensity focused ultrasound in patients with recurrent and metastatic abdominal tumors[J].World J Gastroenterol,2007,13:2747-2751.
[8]洪立立,郭 志,于海鹏,等.低功率高强度聚焦超声联合SOX方案治疗结直肠癌伴盆腔转移的初步观察[J].中华医学杂志,2014,94: 1929-1932.
[9]洪立立,郭 志,司同国,等.高强度聚焦超声补救治疗TACE失败肝癌的临床应用[J].介入放射学杂志,2014,23:1044-1047.
[10]Yuan Y,Shen H,Hu XY,et al.Multidisciplinary treatment with chemotherapy,targeted drug,and high-intensity focused ultrasound in advanced pancreatic carcinoma[J].Med Oncol,2012,29:957-961.
[11]吴 蓉,胡 兵,姜立新,等.高强度聚焦超声治疗裸鼠卵巢癌皮下移植瘤的初步观察[J].中国医学影像技术,2007,23:31-33.
[12]郭 倩,姜立新,胡 兵.不同辐照模式聚焦超声诱导人胰腺癌细胞凋亡的量效关系[J].中国医学影像技术,2011,27:479-482.

