肾移植术后CYP3A5基因多态性对他克莫司血药浓度的影响
王 曙,赖柳生,眭维国,陈洁晶,陈怀周,郭骏军,李 飞,李典鹏
·论著·
肾移植术后CYP3A5基因多态性对他克莫司血药浓度的影响
王 曙,赖柳生,眭维国,陈洁晶,陈怀周,郭骏军,李 飞,李典鹏
目的 探讨肾移植术后细胞色素P450酶(CYP)3A5基因多态性对他克莫司血药浓度的影响。方法 选择解放军181医院全军器官移植与透析治疗中心2012年11月—2013年11月符合条件的行同种异体肾移植术患者63例,采用随机数字表法分为观察组(n=32)和对照组(n=31),比较两组CYP3A5基因型,住院期间服用他克莫司剂量、血药浓度、调整剂量的次数,急性排斥反应及不良反应发生情况。结果 观察组术后第7天达到他克莫司目标浓度患者比例高于对照组、需要调整他克莫司剂量患者比例低于对照组,差异有统计学意义(P<0.05);术后1个月内观察组急性排斥反应和他克莫司不良反应发生率均低于对照组,差异有统计学意义(P<0.05)。与CYP3A5*3/*3基因型肾移植患者比较,CYP3A5*1/*1 & *1/*3基因型肾移植患者术后1个月内急性排斥反应发生率高、不良反应发生率低,差异均有统计学意义(P<0.05)。结论 肾移植术后根据患者CYP 3A5基因型的不同建立他克莫司个性化给药方案,可使其血药浓度保持稳定,从而减少移植肾的急性排斥反应及不良反应。
肾移植;他克莫司;细胞色素P450酶3A5;基因多态性;血药浓度;临床方案
近半个世纪以来,肾移植已成为治疗终末期肾病的有效方法,该技术很大程度上得益于高效安全的免疫抑制剂的发展和应用。他克莫司因免疫抑制效果好、肝肾毒性较小已成为目前肾移植术后首选的免疫抑制治疗药物[1],但他克莫司的有效治疗窗狭窄、药代动力学个体差异大等特点,导致个体之间给药剂量存在很大差异,难以建立一个客观用药的方案[2-3]。临床一般根据血药浓度来调整用药剂量,但是他克莫司的用药剂量与血药浓度之间缺乏紧密的相关性。他克莫司在体内主要通过肝脏的细胞色素酶P450亚家族CYP3A同工酶代谢[4-5],CYP3A共有4个同工酶:CYP3A4、CYp3A5、CYP3A7和CYP3A43。他克莫司主要由结构和生物活性相近的CYP3A4和CYP3A5代谢[6-8]。近几年的药物遗传学研究发现编码CYP3A亚家族的基因具有多个单核苷酸多态性(SNPs),CYP3A5*3等位基因往往产生异常的剪切位点而使CYP3A5表达受阻,在CYP3A5*3/*3纯合子基因型几乎检测不到CYP3A5的表达,CYP3A5的代谢酶活性完全丧失;只有至少存在一个CYP3A5*1等位基因才能产生并表达CYP3A5[9]。因此CYP3A5基因的遗传多态性可能与他克莫司个体间用药差异具有一定相关性[10]。本研究通过随机对照试验收集受者的临床资料,对受体的CYP3A5基因进行多态性分析(包括快代谢型和慢代谢型),研究肾移植术后免疫抑制剂他克莫司用药剂量的个体间差异与血药浓度、急性排斥反应、不良反应发生率之间的关系。
1 资料与方法
1.1 临床资料 选择解放军181医院全军器官移植与透析治疗中心于2012年11月—2013年11月行同种异体肾移植术的患者63例,男39例,女24例;年龄16~62岁。入选标准:①患者均因肾功能不全尿毒症期需进行肾移植手术,术前疾病为慢性肾小球肾炎、高血压肾病、多囊肾或者梗阻性肾病;②年龄16~62岁,性别不限,均为首次行同种异体肾移植术,供体均为公民逝世后器官捐献(DCD)供体;③肾移植术后采用他克莫司缓释胶囊(安斯泰来制药有限公司,规格:1mg,批号:1M4101B)、吗替麦考酚酯(MMF)和甲泼尼龙三联免疫抑制药物方案;④患者本人自愿参加本研究并签署知情同意书,所有患者的治疗方案均获得本院伦理委员会批准。排除标准:①肾移植术后3个月内接受过其他药物的临床研究,未完成或者从该研究退出的患者;②术前用抗胸腺细胞球蛋白(ATG)或抗淋巴细胞球蛋白(ALG)等其他生物制剂进行免疫诱导的患者;③手术前后存在肝脏疾病,研究期间丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)或者总胆红素(TBIL)持续升高,超过正常值2倍以上的患者;④研究期间存在严重心、肺疾病的患者;⑤再次移植或者接受其他器官移植的患者;⑥尸体供肾移植患者;⑦接受了ABO血型不符的供肾者;⑧群体反应性抗体(PRA)>10%者;⑨测定血药浓度前后2周内使用过CYP3A5抑制剂:炔雌醇、孕二烯酮炔诺酮、氟康哇、酮康哇、克霉哇、维拉帕米、尼莫地平等钙拮抗剂,红霉素、西咪替丁、环丙沙星、小檗碱、利福平、苯妥英钠、卡马西平等对他克莫司代谢有显著影响的药物,和(或)使用增加他克莫司不良反应的药物如氨基糖苷类、两性霉素B、更昔洛韦、环孢素等的患者;⑩严重贫血患者;有严重腹泻或者呕吐,活动性消化道溃疡,有神经性厌食症、吸收不良综合征或胃肠切除术影响药物吸收的患者;有使用他克莫司治疗的禁忌证,对他克莫司或者其他大环内酯类药物过敏者,对胶囊中其他成分过敏者;有严重过敏史或过敏体质患者;精神异常被认为依从性差的患者;肾移植手术过程中热缺血、冷缺血时间明显延长,移植术中出现超急性排斥反应摘除肾脏的患者,移植手术过程中出现严重手术并发症影响移植肾功能的患者。
1.2 分组及肾移植术后免疫抑制剂方案 采用随机数字表法将63例分为观察组和对照组。所有患者移植术后采用他克莫司缓释胶囊、吗替麦考酚酯和甲泼尼龙三联免疫抑制药物方案进行治疗。观察组受者根据CYP3A5基因型的不同调整他克莫司缓释胶囊的起始剂量,快代谢型(CYP3A5*1/*1型与CYP3A5*1/*3型)受者为0.10 mg/(kg·d),慢代谢型(CYP3A5*3/*3型)受者为0.05 mg/(kg·d);对照组无论是快代谢型或慢代谢型,他克莫司的起始剂量均为0.067 mg/(kg·d)。两组吗替麦考酚酯和甲泼尼龙的应用方案无差异。
1.3 主要观察指标 收集两组CYP3A5*3基因型,住院期间服用他克莫司剂量、血药浓度、调整剂量的次数,术后定期随访,并记录随访时他克莫司剂量、浓度、体重以及肝肾功能、血糖、血脂等生化指标,记录有无发生急性排斥反应,有无失眠、手颤等不良反应的发生。比较两组肾移植术后第7天全血他克莫司浓度,以后根据目标浓度来调整他克莫司剂量,术后1个月内将他克莫司浓度控制在8~12 ng/ml[11]。观察术后7 d内达到目标血药浓度范围(8~12 ng/ml)例数的百分比、需调整药物剂量例数的百分比及1个月内急性排斥反应和药物不良反应(神经毒性、高血糖等)发生率。
1.4 统计学分析 应用SPSS 17.0软件对两组间的非连续性变量进行卡方(χ2)检验,对于连续性变量进行t检验,α=0.05为检验水准。
2 结果
2.1 两组基本资料比较 两组基本资料包括年龄、体重、性别等进行比较,差异无统计学意义(P>0.05),具有可比性,见表1。

表1 两组肾移植患者基本资料比较
63例肾移植受体CYP3A5*3基因型分布:*1/*1型为16例(25.4%),*1/*3型为23例(36.5%),*3/*3型为24例(38.1%),CYP3A5*3基因突变频率为74.6%。两组等位基因频率的比较差异无统计学意义(P>0.05),见表2。

表2 两组肾移植患者CYP3A5*1/*3基因分布
基于表1和表2,对两组不同基因型与年龄、体重、性别等基本资料的相关性进行统计,结果显示差异均无统计学意义(P>0.05),见表3。
2.2 术后第7天两组他克莫司血药浓度比较 术后第7天,观察组他克莫司浓度为(9.69±2.04)μg/L,其中达到目标浓度者有25例,占78.1%;对照组他克莫司浓度为(9.48±4.88)μg/L,其中达到目标浓度的受者有12例,占38.7%。两组术后第7天达到他克莫司目标浓度患者比例比较差异有统计学意义(χ2=10.1,P<0.05)。
2.3 术后第7天两组需要调整他克莫司血药浓度患者比例比较 术后第7天,他克莫司浓度不达标需要调整剂量者观察组有7例(21.8%),对照组有19例(61.3%),两组比较差异有统计学意义(χ2=7.69,P<0.05)。
2.4 两组急性排斥反应发生情况比较 术后1个月内,观察组与对照组患者急性排斥反应的发生率分别为6.3%(2/32)和22.6%(7/31),差异有统计学意义(χ2=3.60,P<0.05)。
2.5 两组不良反应发生情况比较 术后1个月内,观察组与对照组不良反应的发生率分别为6.3%(2/31)和25.8%(8/32),差异有统计学意义(χ2=4.77,P<0.05),其中观察组有2例出现血糖升高(空腹血糖最高达11.2 mmol/L);对照组有2例出现血糖升高(空腹血糖最高达18.9 mmol/L),3例明显手颤,2例血压升高(超过基础血压30%),1例失眠。上述不良反应均由他克莫司血药浓度偏高引起,予减少他克莫司药量及对症治疗后均治愈。
2.6 不同基因型患者急性排斥反应及不良反应发生情况比较 与CYP3A5*3/*3基因型肾移植患者比较,CYP3A5*1/*1 & *1/*3基因型肾移植患者术后1个月内急性排斥反应发生率高、不良反应发生率低,差异均有统计学意义(P<0.05),见表4。
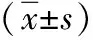
表3 两组肾移植患者组内CYP3A5等位基因型基本资料比较

表4 不同基因型肾移植患者术后1个月内急性排斥反应与不良反应发生情况比较
注:与*3/*3基因型患者比较,aP<0.05
3 讨论
肾移植术已成为治疗终末期肾病最有效的方式,术后需要长期使用免疫抑制剂预防排斥反应,以保护移植肾[12-13]。移植肾的保护效果跟免疫抑制剂的血药浓度密切相关。他克莫司作为新型的免疫抑制剂,具有免疫抑制效果好、肝肾毒性较小等优点,但因有效治疗窗狭窄、药代动力学个体差异大、血药浓度波动大等特点导致个体之间给药剂量存在很大差异。他克莫司在体内主要通过肝脏的细胞色素酶P450亚家族CYP3A同工酶代谢,近来的药物遗传学研究发现编码CYP3A亚家族的CYP3A5基因遗传多态性影响细胞色素酶P450的代谢。本中心通过收集肾移植受者的CYP3A5基因型,采用随机对照试验对受者他克莫司血药浓度的初步研究表明,两组他克莫司血药浓度的差异导致了术后移植肾急性排斥反应的发生率及不良反应发生率的显著差异。
CYP3A5*l基因型影响CYP3A5酶的表达水平,同时参与CYP3A4和CYP3A5酶的协同调节过程,只有存在至少一个CYP3A5*l等位基因才能产生并表达CYP3A5[14]。除此之外,假基因CYP3AP1因为与CYP3A5高度连锁,其44A/G位点多态性也影响CYP3A5的表达和活性[15]。已有研究已经证实他克莫司的药代动力学个体差异与CYP3A5基因多态性密切相关[16]。CYP3A5*3等位基因可以影响CYP3A5的表达,进而影响其活性。韩国最近一项研究显示CYP3A5基因多态性与他克莫司的浓度与剂量比(C/D)值相关,受者为CYP3A5*3*3基因型的C/D值较其他基因型高,而多药耐药基因1(ABCB1)多态性与他克莫司浓度之间的关系不确定[17]。目前有部分学者认为CYP3A4*1G对他克莫司药代动力学的影响受CYP3A5的影响。一项对健康者的研究认为CYP3A4*1G和CYP3A5*3基因多态性影响他克莫司的药代动力学,然而ABCB1多态性与之无关,同时发现CYP3A4*1G和CYP3A5两者联合较单一基因的影响更大[18]。但是关于肾移植受者CYP3A4*1G与CYP3A5*3连锁的研究很少。至于ABCB1多态性与肾移植术后他克莫司浓度的关系,大部分研究认为无关。许多研究显示CYP3A5*3多态性影响他克莫司药代动力学参数,携带CYP3A5*1等位基因的肾移植患者,他克莫司的清除率要高25%~40%,在肾移植术后1年内的不同时期,携带CYP3A5*1的患者剂量校正后他克莫司谷浓度显著低于CYP3A5*3突变纯合子受者[19]。根据遗传药理学的研究成果,测定肾移植受体的CYP3A5多态性为实现肾移植术后他克莫司个体化治疗提供了新的方向[20-22]。本研究结果显示,术后第7天,观察组与对照组达到目标浓度患者的比例及需要调整剂量受者比例差异有统计学意义,与文献报道结果相符。
CYP3A5多态性影响了他克莫司的血药浓度,浓度过高易导致不良反应,浓度过低易引起急性排斥反应。本研究结果显示,63例肾移植患者中,术后出现急性排斥反应9例,其中观察组2例,对照组7例,急性排斥反应发生率分别为6.3%和22.6%。而本研究监测到的不良反应主要为神经毒性、高血糖,63例肾移植患者中,术后出现不良反应10例,其中观察组2例,对照组8例,不良反应发生率分别为6.3%和25.8%。进一步对63例肾移植患者不同基因型急性排斥反应和不良反应发生率进行统计发现,与CYP3A5*3/*3基因型肾移植患者比较,CYP3A5*1/*1 & *1/*3基因型肾移植患者术后1个月内急性排斥反应发生率高、不良反应发生率低,差异均有统计学意义,可见急性排斥反应和不良反应发生率与CPY3A5基因多态性存在一定的相关性,但由于本研究样本量较少,结果可能存在一定偏差,是否存在直接相关性有待进一步行大样本随机试验研究。
[1] Jacobson P, Uberti J, Davis W,etal. Tacrolimus: a new agent for the prevention of graft-versus-host disease in hematopoietic stem cell transplantation[J].Bone Marrow Transplant, 1998,22(3):217-225.
[2] 周晔,傅尚希,朱有华,等.CYP3A5基因型与肾移植受者他克莫司药物代谢的相关性研究[J].中国实验诊断学,2013,17(5):900-902.
[3] Musuamba F T, Mourad M, Haufroid V,etal. Time of Drug Administration, CYP3A5 and ABCB1 Genotypes, and Analytical Method Influence Tacrolimus Pharmacokinetics: A Population Pharmacokinetic Study[J].Ther Drug Monit, 2009,31(6):734-742.
[4] 王婷,欧阳仁荣.细胞色素P450的3A亚家族与肿瘤的个体化治疗[J].上海医学,2003,26(6):336-338.
[5] 吴存造,杨亦荣,潘晓东,等.他克莫司对肾移植受者血脂的影响及其与GNB3基因C825T多态性的相关性研究[J].中华器官移植杂志,2014,35(3):129-132.
[6] He P, Court M H, Greenblatt D J,etal. Genotype-phenotype associations of cytochrome P450 3A4 and 3A5 polymorphism with midazolam clearance in vivo[J].Clin Pharmacol Ther, 2005,77(5):373-387.
[7] Fukuda T, Onishi S, Fukuen S,etal. CYP3A5 genotype did not impact on nifedipine disposition in healthy volunteers[J].Pharmacogenomics J, 2004,4(1):34-39.
[8] Yamamoto T, Kubota T, Ozeki T,etal. Effects of the CYP3A5 genetic polymorphism on the pharmacokinetics of diltiazem[J].Clin Chim Acta, 2005,362(1):147-154.
[9] Kuehl P, Zhang J, Lin Y,etal. Sequence diversity in CYP3A promoters and characterization of the genetic basis of polymorphic CYP3A5 expression[J].Net Genet, 2001,27(4):383-391.
[10]Utecht K N, Hiles J J, Kolesar J. Effects of genetic polymorphisms on the pharmacokinetics of calcineurininhibitors[J].Am J Health Syst Pharm, 2006,63(23):2340-2348.
[11]中华医学会器官移植学分会肾移植学组.他克莫司在临床肾移植中的应用指南[J].中华器官移植杂志,2010,31(9):565-566.
[12]Shabir S, Kaul B, Pachnio A,etal. Impaired Direct Priming of CD8 T Cells by Donor-Derived Cytomegalovirus Following Kidney Transplantation[J].J Am Soc Nephrol, 2013,24(10):1698-1708.
[13]Valdez Ortiz R, Bestard O, Llaudo I,etal. Induction of suppressive allogeneic regulatory T cells via rabbit antithymocyte polyclonal globulin during homeostatic proliferation in rat kidney transplantation[J].TransplInt, 2015,28(1):108-119.
[14]林玲,宋文利,沈中阳,等.肾移植受者CYP3A5*3和CYP3A4*18B对他克莫司药动学的影响[J].中华器官移植杂志,2012,33(4):220-224.
[15]Finta C, Zaphiropoulos P G. The human cytochrome P450 3A locus.Gene evolution by cpatuer of downstream exons[J].Gene, 2000,260(l-2):13-23.
[16]Mae Phee I A, Ferderieks S, Mohamed M,etal. TacorlimusPhmaraeogeneties: polymorphisms assocated with the expression of cytochrome p4503A and P-glycoprotein correlatd with dose requirement[J].Transplantation, 2005,79(4):499-502.
[17]Kim I W, Moon Y J, Ji E,etal. Clinical and genetic factors affecting tacrolimus trough levels and drug-related outcomes in Korean kidney transplant recipients[J].Eur J Clin Pharmacol, 2012,68(5):657-669.
[18]Shi X J, Geng F, Jiao Z,etal. Association of ABCB1, CYP3A4* 18B and CYP3A5* 3 genotypes with the pharmacokinetics of tacrolimus in healthy Chinese subjects: a population pharmacokinetic analysis[J].J Clin Pharm Ther, 2011,36(5):614-624.
[19]袁梅,郭媛媛,裴广辉,等.CYP3A5*3基因多态性指导肾移植受者他克莫司个体化用药的前瞻性对照研究[J].中华器官移植杂志,2014,35(9):523-527.
[20]冯时,羊仙,黄洪锋,等.细胞色素P450 3A5基因分型对肾移植受者他克莫司剂量的影响[J].中华器官移植杂志,2014,35(1):25-28.
[21]林玲,宋文利,沈中阳,等.肾移植受者CYP3A5*3和CYP3A4*18B对他克莫司药动学的影响[J].中华器官移植杂志,2012,33(4):220-224.
[22]潘晓东,陈文伟,倪晓洁,等.药物代谢酶CYP3A5基因多态性与肾移植术后他克莫司和环孢素A早期临床疗效的相关性[J].中国药理学与毒理学杂志,2014(6):892-897.
Effect of CYP3A5 Polymorphisms on the Plasma Concentration of Tacrolimus Spansule in Patients after Renal Transplantation
WANG Shu1, LAI Liu-sheng1, SUI Wei-guo1,2, CHEN Jie-jing2, CHEN Huai-zhou2, GUO Jun-jun2, LI Fei2, LI Dian-peng3
(1. Southern Medical University, Guangzhou 510630, China; 2. Department of Nephrology Center of Organ Transplantation and Dialysis of PLA Key Laboratory of Metabolic Disease of Guangxi, 181 Hospital of PLA, Guilin, Guangxi 541002, China; 3. Key Laboratory of Research and Utilization for Plant Functional Materials in Guangxi, Guilin, Guangxi 541006, China)
Objective To investigate the effect of Cytochrome P450(CYP)450 3A5 polymorphisms on the plasma concentration of Tacrolimus spansule in patients after renal transplantation. Methods A total of 63 patients with allograft renal transplantation during November 2012 and November 2013 were divided into experiment group (n=32) and control group (n=31) by random digits table method. The CYP3A5 genotype, Tacrolimus dose during hospital stay, plasma concentration, times of modifying dosage and the incidence rates of acute rejection (AR) and adverse reactions in the two groups were compared. Results Compared with those in the control group, on postoperative 7thd, in the experiment group the ratio of finishing target concentration was significantly higher, and the ratio of patients with modifying dosage was significantly lower (P<0.05); the incidence rates of acute rejection (AR) and adverse reactions within postoperative 1 month were lower, and the differences were statistically significant (P<0.05). The AR incidence rate was higher, and the incidence rate of adverse reactions was lower within postoperative 1 month in renal transplantation patients with CYP3A5*1/*1 & *1/*3 genotype than those in postoperative patients with CYP3A5*3/*3 genotype, and the differences were also statistically significant (P<0.05). Conclusion Individuation of Tacrolimus dose regimen should be established based on the CYP3A5 genotype for patients after renal transplantation, which can keep stable plasma concentrations of Tacrolimus, and reduce incidence rates of acute rejection and adverse reactions of the patients.
Kidney transplantation; Tacrolimus; Cytochrome P4503A5; Genic polymorphisms; Plasma concentration; Clinical protocols
广西自然科学基金(2011GXNSFB018105);广西植物功能物质研究与利用重点实验室开放基金(FPU2011-②)
510000广州,南方医科大学(王曙、赖柳生、眭维国);541002 桂林,解放军181医院肾脏科 全军器官移植与透析治疗中心 广西代谢性疾病研究重点实验室(陈洁晶、陈怀周、郭骏军、李飞、眭维国);541006桂林,广西植物功能物质研究与利用重点实验室(李典鹏)
李典鹏,E-mail:ldp@gxib.cn
R699.2;R979.5
A
2095-140X(2015)08-0009-05
10.3969/j.issn.2095-140X.2015.08.003
2015-06-19 修回时间:2015-07-05)

