拟南芥AtLCR67干扰质粒的构建及转基因植株的鉴定
郭 磊,胡 佳,肖文娟,刘春林*
(1 作物资源创新与利用湖南省重点实验室,长沙 410128; 2 湖南农业大学生物科学技术学院,长沙 410128)
拟南芥AtLCR67干扰质粒的构建及转基因植株的鉴定
郭 磊1,胡 佳1,肖文娟2,刘春林1*
(1 作物资源创新与利用湖南省重点实验室,长沙 410128; 2 湖南农业大学生物科学技术学院,长沙 410128)
种子发育过程是植物整个生长周期最重要的阶段,涉及到一系列功能物质的合成和转化,是由各种相互关联的基因共同控制完成的,因此,研究该阶段特异性表达的基因对研究种子发育过程非常重要。以种子特异性表达的基因AtLCR67为研究对象,通过构建RNAi干扰质粒,借助根癌农杆菌介导的浸花法,将AtLCR67基因的RNAi表达框转到拟南芥基因组中;经过PPT抗性筛选与PCR鉴定,成功获得了8株转基因植株。对其中的3株进一步作RT-PCR检测,显示有2株中的AtLCR67基因表达被完全抑制,另一株的基因表达水平被抑制了大约70%,结果完全实现了设计目标;同时还发现T2代植株有晚花表型。这两株转基因植株为进一步研究AtLCR67功能与作用机制提供了良好的遗传材料。
拟南芥;AtLCR67基因;RNAi质粒;遗传转化;基因沉默
LCR(LOW-MOLECULAR-WEIGHTCYSTEINE-RICH)家族在拟南芥中有86个成员,其家族蛋白通常含有一段信号肽序列,一般都属于分泌蛋白,分子量较小,都不超过12 kDa。多序列比对结果表明,除都含有8个高度保守的半胱氨酸外,家族成员的同源性较低。除LCR27和LCR71外,LCR家族其他基因都在靠近5′端有一段长约75~275 bp的内含子序列[1]。LCR家族基因成员众多,但是功能已知的不多。目前,在LCR家族中,了解的基因功能有两个方面:植物防御和自交不亲和。拟南芥LCR基因家族包含DEFL (Defensin-like)亚家族,称为类防御蛋白,这一类蛋白与病原菌抗性相关,又称为抗菌肽[2]。此外,LCR基因家族中还包含一些编码PCP蛋白(Pollen coat protein)成员的亚家族。PCP蛋白是一种富含半胱氨酸的小分子量花粉外包壁蛋白,能与SLG(S-locus glycoprotein)和SLR1(S locus-related 1)相互作用,使成熟的花粉可以粘着在柱头上顺利完成花粉管的萌发以及受精[3],避免了自交不亲和现象(self-incompatibility,SI)。AtLCR67(AT1G75830),又名AtPDF1.1,为拟南芥(Arabidopsisthaliana)LCR家族中DEFL亚家族的一员。氨基酸序列亲缘关系分析结果,将AtLCR67聚类到DEFL亚家族,编码了一种PR(pathogenesis-related) 蛋白,属于植物防御(PDF)家族。AtLCR67在种子中特异性表达[4],且在拟南芥种子发育过程中的第8~10阶段表达量最高,在干种子与吸胀种子中有表达,其它组织中不表达(http://www. arabidopsis.org/)。但是有研究证实用真菌感染拟南芥的叶片,在感染的部位AtLCR67会被诱导表达[5],这表明AtLCR67在特殊情况下可以在种子之外起作用。此外,由于AtLCR67在正常生长情况下只在种子中表达,推测该基因很可能会参与拟南芥的胚胎发育或种子中储存物的代谢物合成过程。总之,有关AtLCR67的确切功能至今尚不清楚。本研究采用RNAi原理[6],通过构建AtLCR67干扰质粒,并且对哥伦比亚野生型拟南芥Col-0进行转化,并通过筛选获得了稳定遗传的转基因植株,从而为深入研究AtLCR67基因的功能提供基础材料。
1 材料与方法
1.1 材料
拟南芥(Arabidopsisthaliana)哥伦比亚生态型Col-0,大肠杆菌(Escherichiacoli) DH5α,根癌农杆菌(Agrobacteriumtumefaciens)GV3101,OMEGA公司质粒提取试剂盒、胶回收试剂盒,干扰载体pNapin-pFGC5941(为Napin2基因的启动子替换了原有的CaMV35S启动子)、T载体pMD-19,由湖南农业大学植物发育与表观遗传调控实验室提供。
1.2 方法
1.2.1 拟南芥的生长
用纯水拌营养土,将拟南芥种子播于装有营养土的小钵中,封保鲜膜保湿,避光4℃处理3 d,转移至光照培养室培养3 d后揭膜[7],生长条件22~25℃[8],长日照(16 h/8 h),定期浇灌1/4MS营养液。
1.2.2 pAtLCR67RNAi质粒设计
从TAIR(http://www.arabidopsis.org/)网站上查到AtLCR67的CDS序列,经过同源性比对,选取了自ATG开始,特异性强的98 bp序列作为干扰片段。选择经改造的带有Napin启动子的pFGC5941为基础载体。目标片段克隆引物序列如下:
pLCR67RNAiF:5′-GCTCTAGACCATGGATGGCTAAGTCTGC TACCATC-3′(下划线标记为XbaI和NcoI酶切位点)
pLCR67RNAiR:5′-CGGGATCCGGCGCGCCC ACAACTTCTGT GCTTCCAC-3′(下划线标记为AscI和BamHI 酶切位点)
扩增产物长度为128 bp。
1.2.3 pAtLCR67RNAi质粒构建
用Trizol[9]法提取拟南芥Col-0开花后10 d果荚的RNA。反转录出cDNA,并以此为模板,用引物pLCR67RNAiF/pLCR67RNAiR扩增出LCR67干扰片段。切胶回收后连接到T-载体pMD-19上,通过热激法[10]转化感受态大肠杆菌DH5α,PCR检测出阳性克隆送测序。用NcoI和AscI双酶切测序正确的pMD-19-LCR67 RNAi和Napin-pFGC5941,回收目的片段和目的载体,T4连接酶16℃连接过夜,获得连接有正向干扰片段的Napin-pFGC5941载体,通过热激法转化感受态大肠杆菌DH5α,PCR检测出阳性克隆,扩大培养后用OMEGA公司质粒提取试剂盒提取质粒。XbaI和BamHI双酶切测序正确的pMD-19-LCR67RNAi反向片段和连有正向片段的Napin-pFGC5941。回收目的片段和目的载体,T4连接酶16℃连接过夜。连接产物转化大肠杆菌DH5α,并通过酶切验证确定载体构建成功。
1.2.4 拟南芥转化
提取质粒通过冻融法[11]将构建好的质粒pAtLCR67RNAi转化到根癌农杆菌GV3101中,进行菌落PCR鉴定和双酶切验证。挑取正确的克隆于10 mL含有庆大霉素(30 mg/L)、卡那霉素(50 mg/L)、利福平(100 mg/L)的YEB培养基中,28℃、200 rpm培养36 h。再将培养的菌液转至新50 mL YEB中扩大培养;用浸花法[12]转化Col-0。浸染后的植株黑暗处理24 h后移到长日照条件下生长。待T0代种子成熟后,密集播种在装有营养土的钵子中,待真叶长出后,用喷壶喷施1 mg/L PPT,每天1次,连续7 d,筛选到抗性苗后,将其单株移栽到新的钵子中培养,为T1代植株。
1.2.5 转基因植株AtLCR67干扰效果鉴定
用Trizol法提取T1代植株开花后10 d的果荚RNA,反转出cDNA,通过RT-PCR比较AtLCR67在T1植株与Col-0的表达情况,从而判定pAtLCR67RNAi载体的干扰效果。若RT-PCR结果证实pAtLCR67RNAi干扰效果明显,可进行定量PCR实验,更加精确的了解其干扰程度。
1.2.6 转化子的鉴定与表型观察
经过筛选得到的T1代植株在长日照条件下培养两周后取其茎生叶,用CTAB法[13]提取其DNA为模板,以pLCR67RNAiF为上游引物,取pFGC5941上Intron的一段序列设计的Intron703R为下游引物,进行PCR检测。Intron703R序列为:5′-CTCCATCTTATTCCCTCCGTTTCAC-3′。根据PRC结果确定抗性苗是否为转基因植株,并对转基因植株的表型进行观察。
2 结果与分析
2.1 干扰质粒的构建
从Col-0开花后10 d的果荚中提取RNA,反转录为cDNA后,用设计好的引物pLCR67RNAiF/ pLCR67RNAiR扩增出用于干扰的目的片段。目的片段连接到中间载体pMD-19上,测序,选择测序正确的菌落提取质粒。利用NcoI/AscI和XbaI/BamHI两组双酶切,先后将干扰片段正反向插入到CHAS intron的两侧,构建AtLCR67基因的RNAi质粒。通过PCR方法,及用NcoI/AscI,XbaI/BamHI两组双酶切pAtLCR67RNAi载体,结果与预期一致(图1A),表明AtLCR67RNAi质粒构建成功(图1B)。
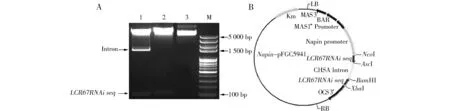
图1 干扰质粒 pAtLCR67RNAi酶切验证及载体示意图注:A图为酶切验证图,M.Mark;1.NcoI和AscI双酶切;2.XbaI和BamHI双酶切;3.未酶切对照。B图为pAtLCR67RNAi载体示意图。
2.2 拟南芥转化及转化子检测
将构建好的pAtLCR67RNAi质粒通过农杆菌介导的浸花法转化Col-0,收集T0代种子于营养土中密集种植,喷施PPT进行筛选,获得8株抗性苗。用CTAB法提取1~8号抗性苗的DNA,以pLCR67RNAiF和Intron703R为引物进行PCR检测(图2),结果显示T1代1~8株抗性苗均为转基因植株。
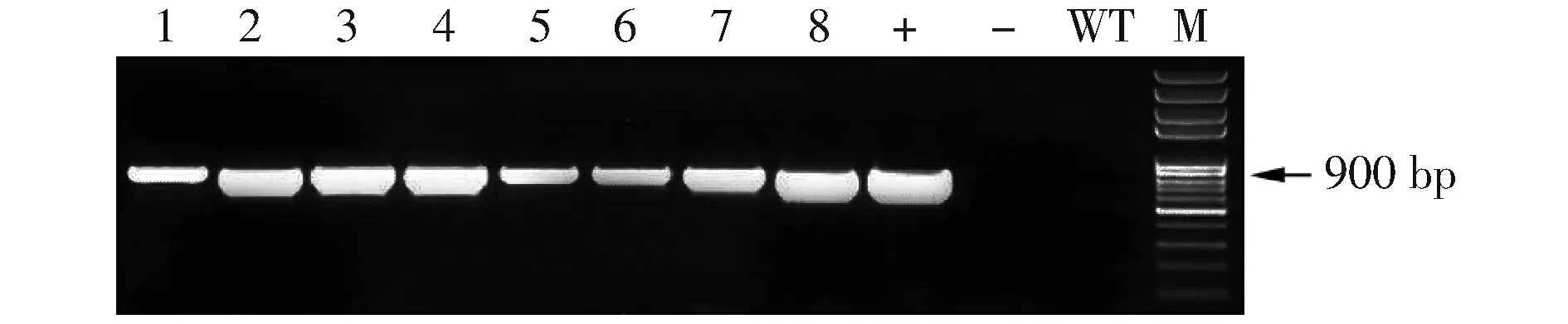
图2 抗性苗PCR检测结果注:M.Mark;1~8.阳性转化子;+.阳性对照;—.阴性对照;WT.空白对照。
2.3 pAtLCR67RNAi干扰效果鉴定
用Trizol法提取T1代1,2,3号突变体和Col-0开花后10 d的果荚RNA,反转出cDNA,通过qPCR比较AtLCR67在pAtLCR67RNAiT1代 1,2,3号植株与Col-0的表达情况,从而判定pAtLCR67RNAi载体的干扰效果。
结果显示,1~3号转化子中AtLCR67基因没有表达,而Col-0中有表达(图3),说明pAtLCR67RNAi结构对AtLCR67的干扰效果十分显著。

图3 pAtLCR67RNAi转基因植株LCR67的表达
为了确定RNAi是否完全抑制了该基因的表达,增加了qPCR实验(图4)。结果表明pAtLCR67RNAi结构在1号,3号植株中使AtLCR67表达完全沉默。qPCR所用引物及序列如下:
q-ACTIN2-F:5′-CTTGCACCAAGCAGCATGAA-3′
q-ACTIN2-R:5′-CCGATCCAGACACTGTACTTCCTT-3′
q-LCR67F:5′-ATGGCTAAGTCTGCTACCATC-3′
q-LCR67R:5′-CACAACTTCTGTGCTTCCAC-3′
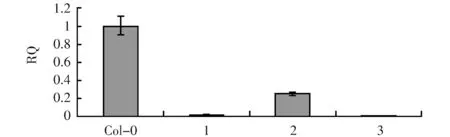
图4 pAtLCR67RNAi 1,2,3号转基因植株LCR67 qPCR结果
2.4 pAtLCR67RNAi转基因植株与Col-0表型对比
观察pAtLCR67RNAiT1转基因植株与同时种植的Col-0表型差异,发现其开花时间比Col-0晚7~10 d(图5A)。为了排除人为筛选环境的影响,故收取T1代1号植株种子,单株种在小钵中,经过PCR检测确定其为转基因植株后(图5B),与同时种植的Col-0对比观察,发现AtLCR67RNAi-1 T2代植株也有晚花表型(图5C)。

图5 pAtLCR67RNAi转基因植株表型观察注:A图为pAtLCR67RNAi T1代植株与Col-0表型对比。B图为pAtLCR67RNAi-1 T2代植株PCR检测电泳图,图中M为Mark;1~3,7~13为阳性转化子;4~6为阴性转化子;+为阳性对照;—为阴性对照;WT为空白对照。C图为pAtLCR67RNAi-1 T2代植株与Col-0表型对比。
3 结论与讨论
AtLCR67是拟南芥LCR家族的一员,由于AtLCR67特异在种子中表达,推测AtLCR67很可能与拟南芥的胚胎发育或种子中储藏物的合成代谢相关。进一步验证AtLCR67的功能,必须有该基因表达沉默的材料,而AtLCR67没有可用的T-DNA插入突变体资源,故本实验利用RNAi技术,构建了特异沉默AtLCR67的干扰载体。实验早期通过比对,发现AtLCR67与AT2G26020、AT5G44420同源性较高,但这两个基因均特异性在幼叶中表达,而AtLCR67特异性在种子中表达,且本干扰载体启动子为种子特异性表达基因Napin2启动子,故可以保证该干扰片段只沉默AtLCR67。干扰载体pAtLCR67RNAi构建成功后浸花转化拟南芥Col-0,经过筛选及PCR检测获得8株转基因植株。通过RT-PCR实验初步证实pAtLCR67RNAi载体的干扰效果显著,随后通过qPCR进一步证实在1号、3号转基因植株中AtLCR67被完全沉默,说明1号与3号材料可以作为AtLCR67基因沉默材料,这为深入研究AtLCR67的功能做好了基础材料的准备。之后将对AtLCR67沉默突变体胚胎发育或种子中储藏物的合成代谢进行研究,以证实AtLCR67是否参与这些生物过程。另外,值得一提的是,在对pAtLCR67RNAi转基因植株进行表型观察时发现相对于Col-0有晚花表型。为了排除筛选环境造成的影响,对T1代种子直接种植,经过PCR筛选出转基因植株,再与同时种植的Col-0对比,晚花表型依然存在。AtLCR67表达降低后导致植株出现晚花的原因尚不清楚,可能是胚胎发育或种子中储藏物的合成代谢变化导致,具体机理需后续研究。
[1] Vanoosthuyse V,Miege C,Dumas C,et al.Two largeArabidopsisthalianagene families are homologous to theBrassicagene superfamily that encodes pollen coat proteins and the male component of the self-incompatibility response[J].Plant Molecular Biology,2001,46(1):17-34.
[2] Silverstein KA,Graham MA,Paape TD,et al.Genome organization of more than 300 defensin-like genes inArabidopsis[J].Plant Physiology,2005,138(2):600-610.
[3] Doughty J,Wong HY,Dickinson HG.Cysteine-rich pollen coat proteins (PCPs) and their interactions with stigmatic S (incompatibility) and S-related proteins inBrassica:putative roles in SI and pollination[J].Annals of Botany,2000,85(S1):161-169.
[4] Sels J,Mathys J,De Coninck B,et al.Plant pathogenesis-related (PR) proteins:a focus on PR peptides[J].Plant Physiology and Biochemistry,2008,46(11):941-950.
[5] De Coninck B,Sels J,Venmans E,et al.Arabidopsisthalianaplant defensin AtPDF1.1 is involved in the plant response to biotic stress[J].New Phytologist,2010,187(4):1075-1088.
[6] Zamore PD,Tuschl T,Sharp PA,et al.RNAi:double-stranded RNA directs the ATP-dependent cleavage of mRNA at 21 to 23 nucleotide intervals[J].Cell,2000,101(1):25-33.
[7] 刘守伟,刘士勇.拟南芥室内培养技术研究[J].东北农业大学学报,2007,38(2):279-281.
[8] 于政权,孙 颖.拟南芥菜室内培养技术的改进[J].河北师范大学学报:自然科学版,1999,23(4):549-550.
[9] 李 敏,杨 双,阮燕晔,等.拟南芥T-DNA插入突变体atsuc3的PCR鉴定[J].植物生理学通讯,2006,42(1):91-94.
[10] 王 萍,殷春燕,盈 磊.不同方法转化大肠杆菌和农杆菌转化效率的研究[J].淮海工学院学报,2007,16(2):55-58.
[11]张边江,陈全战.质粒导入不同种农杆菌冻融法的探讨[J].湖北农业科学,2007,46(3):329-331.
[12]李 君,李 岩,刘德虎.植物遗传转化的替代方法及研究进展[J].生物技术通报,2011(7):31-36.
[13]杨立国,杨 晶.5种常见植物DNA提取效率的比较[J].生物学通报,2012,47(9):44-46.
The RNAi Plasmid Construction ofAtLCR67 and Identification of Transgenic Plants
GUO Lei1,HU Jia1,XIAO Wen-juan2,LIU Chun-lin1*
(1 Hunan Provincial Key Laboratory for Crop Germplasm Innovation and Utilization,Hunan Agircultural University,Changsha,Hunan 410128,China;2 College of Bioscience and Biotechnology,Hunan Agircultural University,Changsha,Hunan 410128,China)
The processing of seed development is the most important stage for the whole life of plant growth,it depends on the synthesis and transformation of different kinds of metabolic controlled by corresponding genes.So study on the genes specifically expressed during seed developing stage is very important to understand the processing of seed development.AtLCR67 gene only expresses during the seed development stage was used as material,the RNAi expression box ofAtLCR67 gene was transferred toArabidopsisthalianagenome via construction of RNAi plasmid and agrobacterium-mediated transformations.Through resistance selection of PPT and PCR identification,eight transgenic plants were gained.The RT-PCR results of 3 plants selected from the transgenic plants showed that theAtLCR67 gene was silenced completely in 2 plants,and the expression level ofAtLCR67 gene was inhibited by about 70% in another one,which suggested the expression box ofAtLCR67 gene RNAi worked.By the way,the late-flowering phynotype of T2generation transgenic plants was found during the experiment.The two transgenic plants in whichAtLCR67 gene was silenced completely were the good materials for further research on function and action mechanism ofAtLCR67.
Arabidopsisthaliana;AtLCR67 gene;RNAi plasmid;genetic transformation;gene silence
2015-01-29
郭 磊(1989-),男,山西灵石人,硕士研究生,Email:guolei0418@126.com。
*通信作者:刘春林,博士,教授,Email:liucl@hunau.edu.cn。
国家自然科学基金项目(31071455)。
Q78
A
1001-5280(2015)03-0221-05
10.3969/j.issn.1001-5280.2015.03.01

