两步法构建灰飞虱RNAi载体及水稻遗传转化
王少岭,杜 强,尹鲜思,金如意,王志龙
(湖南省作物种质创新与资源利用重点实验室/湖南农业大学农学院,长沙 410128)
两步法构建灰飞虱RNAi载体及水稻遗传转化
王少岭,杜 强,尹鲜思,金如意,王志龙*
(湖南省作物种质创新与资源利用重点实验室/湖南农业大学农学院,长沙 410128)
灰飞虱不仅直接危害水稻,还是水稻条纹叶枯病和黑条矮缩病的传播媒介。为了探索防治灰飞虱及由灰飞虱引起的水稻病毒病的方法,本研究利用两步法快速高效构建灰飞虱RNAi载体,并应用于水稻遗传转化。针对灰飞虱的激活性蛋白激酶C受体(RACK)基因设计了一对特异性引物,通过PCR扩增一段200 bp的干扰片段,将干扰片段克隆到入门载体pENTR,再经过LR反应使入门载体上的干扰片段整合入目的载体pANDA,形成RNAi载体pANDA-RACK,通过农杆菌EHA105介导的水稻转化法转入武陵粳1号,获得20株经鉴定为阳性的转基因植株,为防控灰飞虱及其传播的水稻病毒病提供了珍贵材料。
水稻;灰飞虱;RNAi载体构建;转基因
灰飞虱(Laodephaxstriatellus)属同翅目、飞虱科昆虫,是亚洲粮食种植区的重要害虫之一[1]。在我国各地均有分布,主要以长江流域和华北地区发生较多[2,3],不仅通过刺吸植物枝叶导致植株枯黄萎死,同时也是水稻条纹叶枯病[4]、水稻黑条矮缩病及玉米粗缩病[5]的主要传播媒介。据统计,我国已有17个省市水稻种植区遭受水稻条纹叶枯病影响[6],长江流域中东部作物种植区均受到水稻黑条矮缩病侵袭[7],玉米粗缩病也已覆盖13个省[8],严重影响粮食作物产量和品质。另外,由于灰飞虱的寄主广泛,迁徙特性及近年来的环境渐暖,越来越有利于灰飞虱越冬和大量繁殖,灰飞虱数量呈上升趋势,同时以灰飞虱为传播媒介的水稻病毒病呈大范围爆发趋势,对我国粮食安全造成巨大威胁。目前针对灰飞虱及以灰飞虱为传播媒介的水稻病毒病的主要防治措施还是使用化学药剂,这种方法不仅污染环境,而且导致灰飞虱种群抗药性增强[9],防治效果不理想。因此,如何控制并降低灰飞虱危害已是农业工作者面临的重大挑战。利用分子生物学技术并结合传统的遗传育种手段,挖掘培育高抗灰飞虱的水稻新品种,是防治灰飞虱及以灰飞虱为传播媒介的水稻病毒病的经济、有效措施,也是控制灰飞虱种群的重要途径[10]。
RNA干扰(RNAi)是通过碱基配对特异性结合靶标基因mRNA,从而将其降解达到沉默靶标基因,干扰特定生命过程的有效技术[11,12]。随着RNAi技术的成熟,RNAi技术在动植物基因功能研究中得到广泛应用[13]。因其高效特异性,RNAi技术在植物病毒病方面也得到应用[14]。Waterhouse等利用RNAi技术成功提高了马铃薯对马铃薯Y病毒的抗性[15],表明RNAi技术在提高植物抗病毒能力方面切实可行。同时,也有研究者提出通过RNAi沉默害虫体内的重要基因从而影响害虫的生长发育达到防治害虫的新策略。激活性蛋白激酶C受体RACK属于WD蛋白家族成员,可以与蛋白激酶C(protein kinase C,PKC)结合,在调控细胞表面受体和细胞内相关蛋白激酶信号转导途径中发挥重要作用[16]。Li等[17]将该基因从灰飞虱中克隆出来,猜测该蛋白可能参与病毒粒子与灰飞虱宿主的互作。Zha等[18]通过RNA blot分析发现,在转基因水稻的叶片和韧皮汁液中可检测到dsRNA,并且一些dsRNA被切割成siRNA;将转基因植株喂食褐飞虱2 d和4 d,发现褐飞虱体内同源基因表达量明显下降,实验表明通过转基因植株表达的dsRNA可以引起褐飞虱RNA干扰效应。Yu等[19]也发现,喂食褐飞虱转基因水稻可引起褐飞虱基因表达量下调。本研究针对灰飞虱激活性蛋白激酶C受体基因,利用两步法快速高效构建RNAi载体,导入农杆菌中,利用农杆菌介导的水稻转化法获得阳性转基因植株,以为下一步鉴定对灰飞虱及以灰飞虱为传播媒介的水稻病毒病抗性研究提供基础材料。
1 材料与方法
1.1 材料
灰飞虱由湖南农业大学作物基因工程实验室培养繁殖。水稻转化受体材料武陵粳1号,来自扬州大学,由湖南农业大学作物基因工程实验室繁种保存。
1.2 菌株和质粒
大肠杆菌(Escherichiacoli)DH5α购自北京全式金公司;农杆菌EHA105由湖南农业大学作物基因工程实验室保存;pENTR载体和pANDA载体由北京植物保护研究所惠赠。
1.3 方法
(1)灰飞虱激活性蛋白激酶C受体(Receptor for activated protein kinase C,RACK)基因的下载、RNAi引物设计及入门载体的构建。根据灰飞虱RACK基因的Genebank序列号(HQ385972.1),利用NCBI网站(http://www.ncbi.nlm.nih.gov/genbank/)查找基因序列并下载整个CDS。根据普通引物设计原则及RNAi引物设计注意事项设计合适引物,配合使用常用引物设计软件Primer primer5.0与在线引物设计网站NCBI上的primer blast(http://www.ncbi.nlm.nih.gov/tools/primer-blast/index. cgi LINK_LOC=BlastHome),根据载体pENTR的特点及下游重组反应,在引物5′端分别加上BamHI、XhoI酶切位点及保护碱基,设计了一对特异引物RACK-270-F(5′-CG GGATCC GGATCTTGCTGCCGGTCGTA-3′)及RACK-470-R(5′-CCCTCGAGTTGGATTGGCGTGGTTGG-3′),其扩增产物大小为200 bp。以灰飞虱为材料,采用Trizol法提取灰飞虱总RNA,根据Thermo公司的反转录试剂盒,反转录合成cDNA;以灰飞虱cDNA为模板,RACK-F/R引物扩增RNAi片段,使用TAKARA公司rTaq进行扩增,退火温度为56℃,28个循环;将PCR产物进行琼脂糖凝胶电泳,使用北京全式金公司胶回收试剂盒回收目的片段,将回收产物和pENTR入门载体用NEB公司BamHI、XhoI限制性内切酶进行双酶切,利用试剂盒回收载体和目的片段;采用Thermo公司的T4连接酶将片段和载体进行连接反应,构建pENTR-RACK载体,通过热激法将连接产物转入大肠杆菌DH5α中,挑选单克隆进行酶切验证,将经过验证的阳性克隆送上海生工公司测序证实。
(2) LR重组反应。使用Invitrogen公司LR Clonase Mix进行LR反应。将验证好的pENTR-RACK入门载体与目的载体pANDA按照一定的比例混合。每10 μL反应体系中,入门载体的用量在100~150 ng范围内,pANDA用量为150 ng,加入2 μL的LR Clonase Mix,加1×TE buffer至10 μL,25℃过夜反应,冰上加入1 μL Proteinase K,37℃孵育10 min,将LR反应液加入50 μL大肠杆菌感受态热激转化,涂Kan/Hyg双抗平板,37℃培养20 h,挑选单克隆酶切验证。
(3)根癌农杆菌介导的水稻遗传转化。通过电击法将构建好的RNAi载体pANDA-RACK转入根癌农杆菌EHA105中,挑取阳性克隆进行PCR验证和双酶切验证。采用农杆菌介导的水稻转化法转化水稻黑条矮缩病高感品种武陵粳1号,采用潮霉素筛选法,获得转基因植株。
(4)转基因阳性植株的鉴定。将得到的转基因T1代植株从生根培养基上取出,用自来水洗净根部培养基,移植到大田,待苗子健壮后,剪取少许叶片放于含有潮霉素水(H2O∶Hyg=1 000∶1)的管子中浸泡5~7 d,选取叶片仍为绿色的植株,提取叶片基因组DNA,使用目的引物RACK-270-F、RACK-470-R进行转基因PCR阳性鉴定。再从已鉴定为阳性的植株中选取几株进行qRT-PCR表达量分析,确定插入片段的转录水平,进一步鉴定为转基因阳性。
2 结果与分析
2.1 入门载体的构建及分析
以灰飞虱cDNA为模板,rTaq酶扩增出大小约200 bp的目的条带(图1),最佳退火温度56℃,28个循环,将得到的条带切胶回收,再进行酶切,连接到pENTR载体上,热激转入大肠杆菌DH5α中,挑取阳性克隆进行酶切验证(图2),连接正确的质粒上将会切出一条200 bp的条带。将酶切正确的样品送公司测序,测序结果与NCBI网站Blast比对,比对结果同源性100%,表明克隆结果正确,可用于下一步的LR重组。
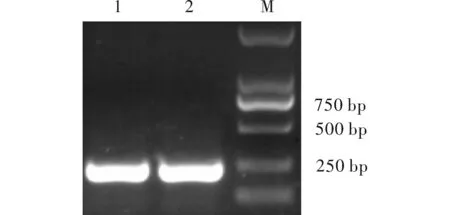
图1 RACK基因RNAi片段克隆Fig.1 Cloning of RNAi fragment from RACK gene注:1,2.PCR产物;M.2 kb Maker。

图2 pENTR-RACK载体酶切验证Fig.2 Identification of pENTR-RACK vector by restriction enzyme digestion注:1,2.pENTR-RACK载体BamHI、XhoI双酶切;M.2 kb Maker。
2.2 LR重组反应
将测序正确的pENTR-RACK入门载体与目的载体pANDA使用Invitrogen公司的LR酶严格按照说明书进行LR反应。反应产物热激法转入大肠杆菌DH5α中,涂于Kan/Hyg双抗平板,37℃培养20 h左右,挑单菌落摇菌提取质粒,KpnI/SacI双酶切验证,pANDA空质粒双酶切后得到4.4 kb的条带,重组阳性质粒是1.7 kb左右。图3显示得到正确的RNAi载体pANDA-RACK。
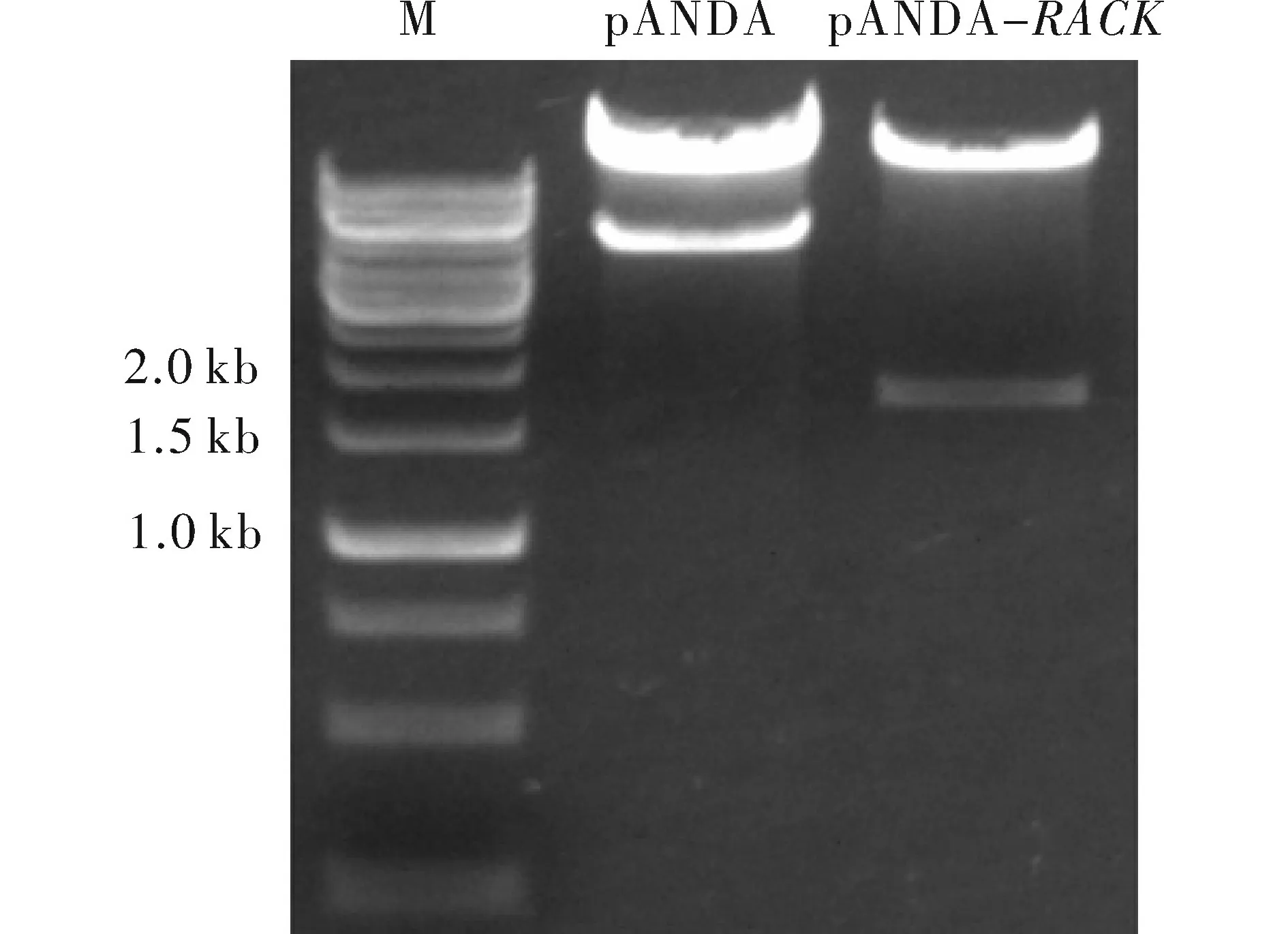
图3 重组质粒的酶切验证Fig.3 Identification of pANDA-RACK vector by restriction enzyme digestion注:M.Generuler 1 kb;pANDA:pANDA空质粒KpnI、SacI双酶切;pANDA-RACK:重组RNAi载体KpnI、SacI双酶切。
2.3 转基因水稻的获得及验证
将重组正确的pANDA-RACKRNAi载体通过电击转化法导入农杆菌EHA105中,验证正确后,通过农杆菌介导的水稻转化法获得转基因植株26株。
采用潮霉素浸泡法进行初步筛选,阳性植株应具有潮霉素抗性,叶片表现为绿色。如图4(封三,下),CK-为转化受体材料武陵粳1号,CK+为已经确定的转基因植株,1~26为转基因材料,除3,7,8,12外,其余22株均与阳性对照一样表现绿色,初步鉴定为阳性植株。用CTAB法提取受体材料武陵粳1号和经潮霉素初筛后表现为阳性的植株叶片基因组DNA,使用目的片段引物对其进行PCR扩增,确定片段的插入情况,电泳结果如图5。从图5可见,CK-为武陵粳1号阴性对照,没有PCR产物出现,CK+为含有目的条带的阳性质粒对照,后面为经潮霉素初筛后成活的转基因植株,其目的片段与阳性对照大小一致,确定这20株植株中插入了目的基因片段。从中选取几株进行qRT-PCR表达量分析,如图6。从图6可见,以武陵粳1号为对照组,灰飞虱RACK基因与水稻基因组无同源性,相对对照组表达量上调,几株转基因材料RACK基因相对表达量均有一定程度的上调,其中RACK-1上调67倍,RACK-10上调25倍,RACK-16上调11倍,进一步表明灰飞虱外源片段导入了水稻中,并且可以在水稻中转录,为转基因阳性植株。

图5 转基因阳性植株PCR检测
Fig.5 PCR identification of transgenic plants
注:CK-.转基因受体材料武陵粳1号,阴性对照;CK+.含有RNAi片段的重组质粒,阳性对照;1~25:转基因阳性植株。
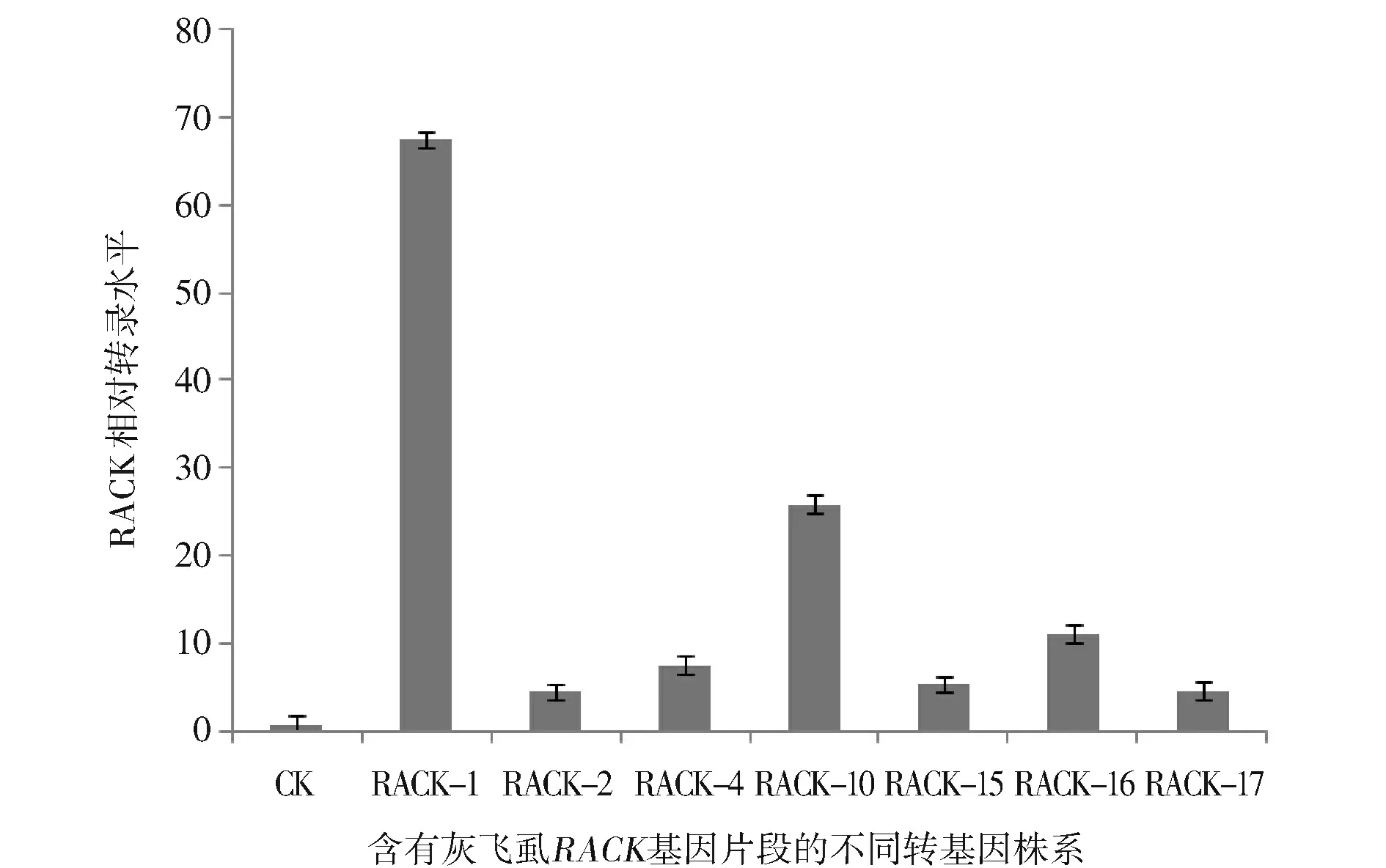
图6 转基因阳性植株qRT-PCR检测结果Fig.6 qRT-PCR identification of transgenic plants
3 结论与讨论
近年来,由于气候、环境、栽培方式等因素的影响,灰飞虱繁殖速度加快,种群变大,对作物造成严重危害,同时以灰飞虱为传播媒介的水稻黑条矮缩病和水稻条纹叶枯病在我国及一些东亚国家大范围肆行,对粮食安全构成很大威胁。目前采用的防治措施主要是使用化学杀虫剂,然而随着灰飞虱抗药性增强,防治效果越来越差,利用分子技术手段选育抗虫新品种势在必行。
RNAi技术的高效特异性在分子抗病毒育种中已得到广泛应用。2004年,马中良等构建了水稻矮缩病毒的RNAi载体,发现对该病毒有很高抗性[20]。2011年,姜明松等利用RNAi沉默RSV病毒成功获得高抗RSV的水稻株系[21]。Shimizu Takumi等通过RNAi技术沉默RBSDV的非结构蛋白基因Segment9也获得很好的抗病效果[22]。
目前,国内外对水稻病毒病的研究主要着眼于病毒本身,很少涉及传播媒介灰飞虱[23,24]。然而病毒种类繁多,研究多是针对单一病毒,范围较窄,若通过培育高抗灰飞虱的水稻品种,不仅可以防治灰飞虱本身对水稻造成的危害,也可积极预防由灰飞虱引起的水稻病毒病。也有人提出通过干扰害虫本身的重要基因,从而得到高抗害虫的作物品种[25]。张倩等通过干扰灰飞虱的海藻糖酶基因发现可显著抑制它的生长,增加死亡率[12],证明RNAi技术特异沉默昆虫关键基因是一个可行的措施。本研究通过两步法高效快速的成功构建了针对灰飞虱RACK基因的RNAi载体,并获得了转基因阳性植株。对水稻转基因阳性的鉴定采用层层递进方法,首先利用潮霉素初步筛选抗性植株,排除假阳性,降低了后续工作量。将经过潮霉素初筛的植株通过PCR方法确定目的片段的插入情况,发现潮霉素浸泡法可以有效排除假阳性,PCR鉴定阳性结果为100%。再根据PCR结果进行qRT-PCR,分析插入片段的转录情况,发现RACK-1,RACK-10,RACK-16的相对表达水平较高,可以用作下一步实验的研究材料,为下一步进行的以灰飞虱为传播媒介的水稻病毒病的抗性研究奠定了一定基础,也为RNAi技术在昆虫方面的应用提供了实践支持。
[1] 林友伟,张晓梅,沈晋良.亚洲稻区灰飞虱抗药性研究进展[J].昆虫知识,2005,42(1):28-30.
[2] 浦茂华.苏南灰稻虱的初步研究[J].昆虫学报,1963,12(2):117-136.
[3] 蔡邦华,黄复生,冯维熊.华北稻区灰稻虱的研究[J].昆虫学报,1964,13(4):552-570.
[4] 周益军,刘海建,王贵珍,等.灰飞虱携带的水稻条纹病毒免疫检测[J].江苏农业科学,2004(1):50-51.
[5] 周 彤,吴丽娟,王 英,等.灰飞虱从冷冻病叶获得水稻黑条矮缩病毒方法的研究初报[J].中国水稻科学,2010,24(4):425-428.
[6] 林奇英,谢联辉,周仲驹,等.水稻条纹叶枯病的研究:病害的分布和损失[J].福建农学院学报,1990,19(4):421-425.
[7] Wang HD,Chen JP,Wang AG,et al.Studies on the epidemiology and yield losses from rice black-streaked dwarf disease in a recent epidemic in Zhejiang province,China[J].Plant Pathology,2009,58:815-825.
[8] Chen SX,Zhang QY.Advance in researches on rice black-streaked dwarf disease and maize rough dwarf disease in China[J].Acta Phytophyl Sin,2005,32:97-103.
[9] Sone S,Hattori Y,Tsuboi S,et al.Difference in susceptibility to imidacloprid of the populations of the small brown planthopper,LaodelphaxstriatellusFallén[J].Journal of Pesticide Science,1995,20(4):541-543.
[10] 段灿星,张世贤,陈 青,等.水稻种质资源抗灰飞虱评价及抗性机制分析[J].中国水稻科学,2007,21(4):425-430.
[11]Fire A,Xu S,Montgomery MK.Potent and specific genetic interference by double-stranded RNA inCaenorhabditiselegans[J].Nature,1998,391:806-811.
[12]张 倩,鲁鼎浩,蒲 建,等.灰飞虱海藻糖酶基因的克隆及RNAi干扰效应[J].昆虫学报,2012,55(8):911-920.
[13]Novina CD,Murray MF,Dykxhoorn DM,et al.siRNA-directed inhibition of HIV-1 infection[J].Nature Medicine,2002,8(7):681-686.
[14]Cogoni C,Macino G.Post-transcriptional gene silencing across kingdoms[J].Current Opinion in Genetic & Development,2000,10(6):638-643.
[15]Waterhouse PM,Graham MW,Wang MB.Virus resistance and gene silencing in plants can be induced by simultaneous expression of sense and antisense RNA[J].Proc Natl Acad Sci USA,1998,95(23):13959-13964.
[16]Choi DS,Young H,McMahon T,et al.The mouseRACK1 gene is regulated by nuclear factor-kappa B and contributes to cell survival[J].Mol Pharmacol,2003,64:1541-1548.
[17]Li S,Xiong RY,Wang XF,et al.Five proteins of Laodelphax striatellus are potentially involved in the interactions between Rice Stripe Virus and vector[J].PloS One,2011,6(10):e26585.
[18]Zha WJ,Peng XX,Chen RZ,et al.Knockdown of midgut genes by dsRNA-transgenic plant-mediated RNA interference in the hemipteran insectNilaparvatalugens[J].PLoS One,2011,6(5):e20504.
[19]Yu R,Xu X,Liang Y.The insect ecdysone receptor is a good potential target for RNAi-based pest control[J].Int J Biol Sci,2014,10(10):1171-1780.
[20]马中良,杨怀义,王 荣,等.利用转hpRNA基因水稻抗水稻矮缩病毒[J].植物学报,2004,46(3):332-336.
[21]姜明松,周起先,朱文银,等.RNAi介导抗水稻条纹病毒转基因水稻的培育[J].山东农业科学,2013,45(5):38-41.
[22]Shimizu T,Nakazono-Nagaoka E,Akita F,et al.Immunity to Rice black streaked dwarf virus,a plant reovirus,can be achieved in rice plants by RNA silencing against the gene for the viroplasm component protein[J].Virus Research,2011,160:400-403.
[23]Ise K,Ishikawa K,Li C,et al.Inheritance of resistance to rice stripe virus in rice line ‘BL 1’[J].Euphytica,2002,127(2):185-191.
[24]Sun DZ,Jiang L,Liu SJ,et al.Detection of QTLs for resistance to rice stripe virus and small brown planthopper in rice (OryzasativaL)[J].Acta Agronomica Sinica,2006,32(6):805-810.
[25]陈爱玲,林克剑,贺 康,等.灰飞虱体内水稻条纹病毒基因的RNA干扰效应[J].中国农业科学,2013,46(6):1158-1165.
Construction of RNA Interference Vector ofLaodephaxstriatelluswith A Two-step Method and Its Transformation in Rice
WANG Shao-ling,DU Qiang,YIN Xian-si,JIN Ru-yi,WANG Zhi-long*
(Hunan Provincial Key Laboratory for Crop Germplasm Innovation and Resource Utilization/College of Agronomy,Hunan Agricultural University,Changsha,Hunan 410128,China)
Laodephaxstriatelluscould not only damage rice directly,but also works as media to spread Rice Stripe Disease and Rice Black Streaked Dwarf Disease.To explore techniques for controllingLaodephaxstriatellusand rice virus diseases caused by it,RNAi vector was efficiently and rapidly constructed by a two-step method.One pair specific primer was designed forRACKgene fromLaodephaxstriatellusto amplify 200 bp interference fragment,and then cloned it into entry vector pENTR.Then the RNAi fragment was recombined into destination vector pANDA through LR reaction to form RNAi vector pANDA-RACK,which was transformed into rice cultivar Wulingjing No.1 mediated byAgrobacteriumtumefaciensEHA105.Twenty transgenic plants were generated and identified by PCR,which plays a foundation againstLaodephaxstriatellusand its transmitted virus diseases in rice.
rice;Laodephaxstriatellus;RNAi;transgene
2015-02-14
王少岭(1988-),女,河北石家庄人,硕士研究生,Email:wanglingerqq@126.com。
*通信作者:王志龙,Email:zhilongwang@126.com。
国家转基因生物新品种培育重大专项 (2012ZX08009001);教育部“创新团队发展计划”项目(IRT1239);湖南省高校科技创新团队项目(2012)。
S511.03;Q78
A
1001-5280(2015)03-0230-05
10.3969/j.issn.1001-5280.2015.03.03

