菜豆根瘤菌CFN42全基因组非经典分泌蛋白的预测与分析
张 武,潘 伟,马金田,郭 涛
(大理学院农学与生物科学学院,云南大理 671003)
豆科植物-根瘤菌的共生固氮体系是地球物化循环中最重要的生物氮素来源,根瘤的形成是两者信号分子交换的结果,这个过程称之为分子对话(molecular dialogue),根瘤菌能够产生结瘤因子(nod factor,NF),表面多糖和分泌蛋白等多种信号分子〔1〕。在根瘤的形成过程中,分泌蛋白在对宿主植物根毛细胞的识别,侵染,结瘤及固氮过程中发挥了重要作用〔2〕。
分泌蛋白是指在细胞内合成,分泌到胞外起作用的蛋白质,可以分为两大类〔3〕,一类是经典分泌蛋白,分泌蛋白的N-端通常含有信号肽序列,有许多软件可以对这类蛋白质进行预测和分析,笔者曾对菜豆根瘤菌CFN42 含信号肽分泌蛋白进行了研究〔4〕。另一类为非经典分泌蛋白,这类分泌蛋白缺少常规的信号肽,不依赖内质网-高尔基体的膜分泌系统,目前对这类分泌蛋白进行预测的软件较少,只有SecretomeP2.0 可以分析非经典分泌蛋白。本文主要通过生物信息学和计算机技术,研究菜豆根瘤菌全基因组非经典分泌蛋白,分析非经典分泌蛋白与根瘤菌结瘤固氮的关系,有助于深入研究共生固氮的分子机制。
1 材料与方法
1.1 材料本实验采用菜豆根瘤菌CFN42 的全蛋白质组5 963个蛋白质,氨基酸序列通过NCBI数据库(ftp://ftp.ncbi.nih.gov/genomes/Bacteria/Rhizobium_etli_CFN_42_uid58377/)获得。
1.2 方法首 先 用 SecretomeP2.0〔5〕(http://www.cbs.dtu.dk/services/SecretomeP/)预测非经典分泌蛋白,其次用 SignalP4.1〔6〕(http://www.cbs.dtu.dk/services/SignalP/)分析上述蛋白质是否有信号肽,将含有信号肽的经典分泌蛋白剔除掉;非经典分泌蛋白常规特征描述由ExPASy(http://web.expasy.org/protparam/)在线分析得出;COG 直系蛋白质同源簇数据库由(http://www.ncbi.nlm.nih.gov/COG/)完成,获得功能分类;非经典分泌蛋白结构域预测由 SMART〔7〕(http://smart.embl-heidelberg.de/)在线完成。
2 结果与分析
2.1 非经典分泌蛋白预测和分析利用SecretomeP2.0 和 SignalP4.1 对菜豆根瘤菌 CFN42 全基因组蛋白进行预测,共得到596个非经典分泌蛋白,约占蛋白质总数的10%。在CFN42中,经典分泌蛋白(含信号肽)共有332 个〔4〕,两者合计占蛋白质组的15.6%,这与分泌蛋白占细菌蛋白质组总数的10%~20%的比例是一致的〔8〕。在596 个非经典分泌蛋白中,位于细菌染色体上的分泌蛋白409个,而位于6个质粒上的则有187 个,其中共生质粒上有58 个,是所有质粒中分泌蛋白比重最大的,这可能与共生质粒更多的参与根瘤的形成有关。
2.2 非经典分泌蛋白的功能预测及分析用直系同源簇数据库对596 个非经典分泌蛋白进行分析,获得COG(cluster of orthologous group,COG)功能分类,见图1。除了未知功能和一般功能之外,参与细胞壁或膜的合成的非经典分泌蛋白最多,有30 个,占总数的5.03%,其次是参与翻译,糖类代谢和转运以及胞内转运和分泌的蛋白质,而参与信号转导、脂质转运和代谢、细胞周期控制和分裂的分泌蛋白最少。
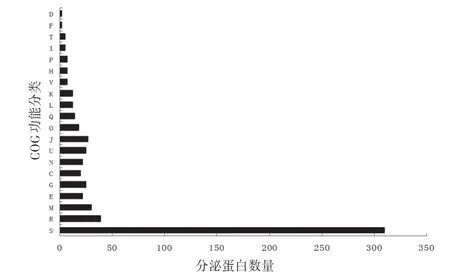
图1 非经典分泌蛋白的COG功能分类
在596个蛋白质中,假定蛋白有381个,有功能描述的蛋白质只有215个,主要集中在物质代谢,底物转运,鞭毛合成和毒力侵染等方面。根瘤菌的分泌系统与根瘤菌的宿主专一性及共生结瘤有紧密的联系。HlyD 家族蛋白是I 型分泌系统蛋白,也是一种细菌溶血素蛋白,是细菌产生毒力和致病性的关键因子〔9〕,CFN42 中含有这些分泌蛋白可能与侵染宿主植物细胞有关;III型分泌系统主要是鞭毛组装蛋白,IV 型分泌系统主要是转运分泌和毒力蛋白,在其他根瘤菌中〔10〕,III 型和 IV 型分泌蛋白能够将靶蛋白运输到宿主细胞内,干扰宿主的防御反应,有利于根瘤菌的侵染。此外,一些涉及细菌温度胁迫,氧化胁迫,药物胁迫的蛋白质也能够影响根瘤菌的结瘤固氮。在研究中识别了3 个冷激蛋白,编码这些蛋白的csp(cold shock protein)基因只在草木樨中华根瘤菌(Sinorhizobium meliloti)中有报道,在其他根瘤菌中则未发现有对应的基因,冷激蛋白可以克服低温造成的毒害效应〔11〕,与此同时,在经典分泌蛋白中,CFN42 还含有耐热凝集素蛋白〔4〕,这两种类型分泌蛋白的存在大大增加了CFN42 对环境的适应性,扩大了宿主专一性的范围;非经典分泌蛋白中的过氧化氢酶和过氧化物还原酶能够清除根瘤类菌体中的过氧化氢,防止固氮酶被氧化失活,可能参与了固氮过程;我们还发现了2个多药外排蛋白(multidrug efflux protein),这类蛋白质能够帮助根瘤菌抵抗多种抗菌药,扩大了对宿主植物的适应性;果胶裂解酶在根瘤菌侵染宿主植物中可以水解细胞壁,形成侵染通道,有助于根瘤菌进入宿主细胞内。表1就是CFN42中这部分分泌蛋白的性质描述。
为了更好的了解假定蛋白的功能,我们用SMART 软件进行结构域分析。结果见图2,假定蛋白中结构域最多的是DUF,这是一类功能未知的结构域,其次是PbH1 和GFA,这类结构域与酶活有关,Tad推测与鞭毛组装有关,含有这类结构域的蛋白质很可能属于III型分泌系统,与细菌的运动和侵染有关。在其他数目较少的结构域中,含有Cupin结构域的蛋白家族与过敏性有关〔12〕,可能与根瘤菌在侵染根毛细胞的免疫反应相关,OmPA 结构域在大肠杆菌中与致病性有关,可以与宿主受体相互作用,CsbD 结构域通常存在于细菌胁迫反应蛋白中,与微生物的逆境生存有关,在根瘤菌中此类蛋白有助于扩大宿主专一性和对环境的适应性。
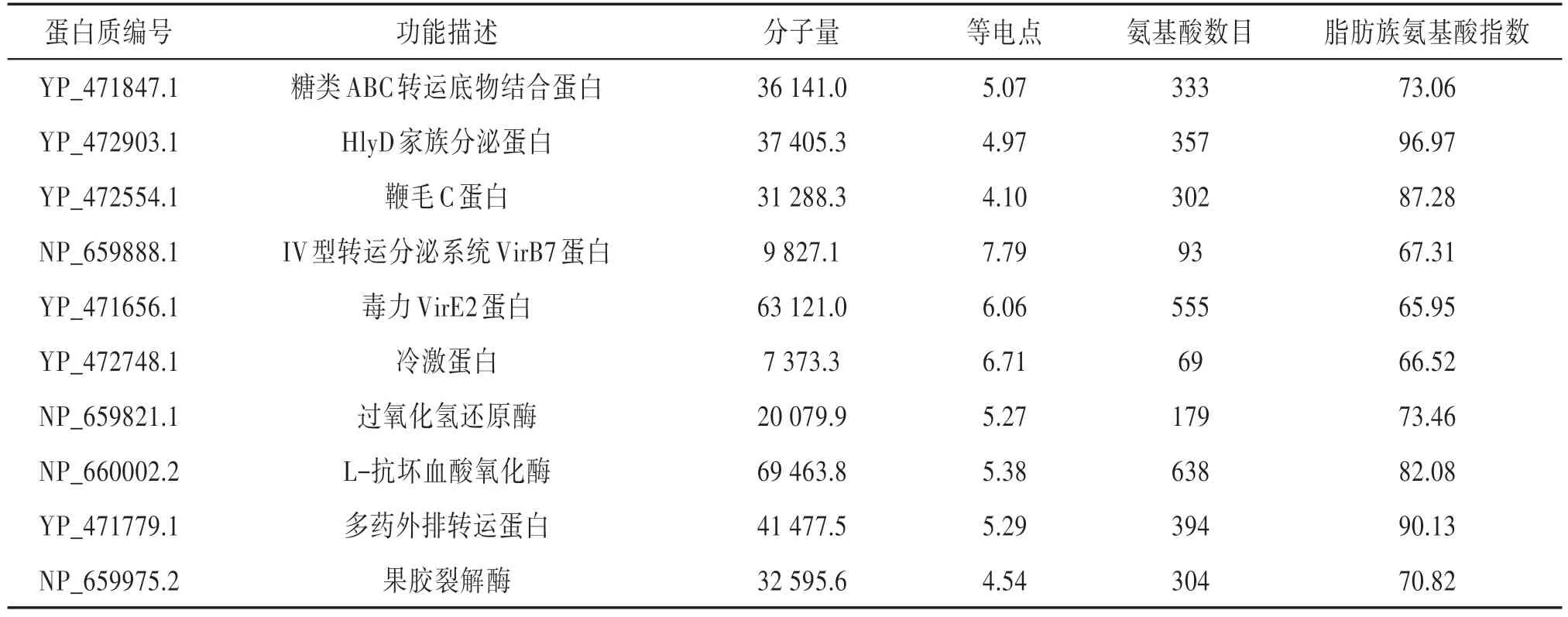
表1 菜豆根瘤菌CFN42部分分泌蛋白特征描述

图2 假定蛋白的结构域分析
3 结论
在真核细胞内,非经典分泌蛋白通常与细胞分裂、免疫应答、致病侵染等过程相关联〔13〕,而在原核细胞内的研究相对较少。本文通过生物信息学分析表明,非经典分泌蛋白和含信号肽分泌蛋白一样,两者都在根瘤菌的侵染、结瘤以及固氮过程中发挥了重要作用,分泌蛋白和结瘤因子,胞外多糖一起构成了根瘤菌宿主专一性的3种关键因子。非经典分泌蛋白种类繁多,主要通过细菌分泌系统和其他一些未知机制分泌,本文识别了I、III、IV 型分泌系统,未见II 型分泌系统。CFN42 中存在最多的非经典分泌蛋白主要是底物转运和物质代谢,这说明根瘤菌和根瘤类菌体之间存在着广泛的物质和信息交流,这种机制有利于根瘤的发育和固氮功能的形成。其次,在非经典分泌蛋白中还存在着一些多糖酶和毒力侵染蛋白,这是根瘤菌侵染宿主植物必不可少的因子,近年来陆续发现根瘤菌利用相似的病原菌侵染植物的分子机制来形成共生体〔2〕,令人意外的是,各种水解酶只在经典分泌蛋白中发现〔4〕,非经典分泌蛋白中没有发现一个水解酶类。第三,在菜豆根瘤菌CFN42 中,还有一些数量较少的蛋白质,冷激蛋白、多药外排蛋白可能是根瘤菌在逆境条件下抗胁迫的分子基础,以上涉及抗生素抗性,温度敏感,药物胁迫的分泌蛋白均与根瘤菌的宿主范围密切相关,而且通过结构域分析,发现有些分泌蛋白还可能与根瘤菌的群体感应有关。
目前,在根瘤菌中利用生物信息学研究非经典分泌蛋白的报道还不多〔14-15〕。豆科植物和根瘤菌相互作用的结果产生了一个高效固氮的共生体-根瘤,在这个过程中,根瘤菌分泌蛋白不仅维持了根瘤菌自身的基础代谢,而且还对宿主植物的侵染、根瘤的发育以及宿主专一性方面发挥了重要作用。
〔1〕Cooper J E. Early interactions between legumes and rhizobia:disclosing complexity in a molecular dialogue〔J〕.Journal of Applied Microbiology,2007,103(5):1355-1365.
〔2〕William J D,William J B.Symbiotic use of pathogenic strat-egies:rhizobial protein secretion systems〔J〕. Nature Reviews Microbiology,2009,7(4):312-320.
〔3〕张海婧,刘辉,吕丽艳,等.分泌蛋白质组研究进展〔J〕.分析化学,2007,35(6):912-918.
〔4〕张武,马金田,潘伟,等. 菜豆根瘤菌 Rhizobium etli CFN42 全基因组含信号肽分泌蛋白的鉴定与分析〔J〕.基因组学与应用生物学,2014,33(4):729-736.
〔5〕Bendtsen J D,Kiemer L,FausbØll A,et al. Non-classical protein secretion in bacteria〔J〕. BMC Microbiology,2005,5:58.
〔6〕Petersen T N,Brunak S,Vonheijne G,et al. SignalP4. 0:discriminating signal peptides from transmembrane regions〔J〕.Nature Methods,2011,8:785-786.
〔7〕Letunic I,Doerks T,Bork P. SMART 7:recent updates to the protein domain annotation resource〔J〕. Nucleic Acids Research,2012,40:302-305.
〔8〕Economou A. Bacterial secretome:the assembly manual and operating instructions〔J〕. Molecular Membrane Biology,2002,19(3):159-169.
〔9〕Vanulsen P,Tommassen J. Protein secretion and secreted proteins in pathogenic Neisseriaceae〔J〕.Federation of European Microbiological Societies,2006,30:292-319.
〔10〕Krehenbrink M,Downie J A. Identification of protein secretion systems and novel secreted proteins in Rhizobium leguminosarum bv. viciae〔J〕. BMC Genomics,2008,9:55.
〔11〕OrmeÑo-Orrillo E,Menna P,Almeida L G P,et al.Genomic basis of broad host range and environmental adaptability of Rhizobium tropici CIAT 899 and Rhizobium sp. PRF 81 which are used in inoculants for common bean(Phaseolus vulgaris L.)〔J〕.BMC Genomics,2012,13:735.
〔12〕李平,王转花. Cupin 家族食物性过敏原表位研究进展〔J〕. 细胞与分子免疫学杂志,2011,27(5):590-592.
〔13〕刘刚,王清明,陈惠鹏. 非经典的蛋白质分泌途径〔J〕.生物技术通讯,2005,16(1):53-55.
〔14〕王新新,吴亮,朱生凤,等.茎瘤固氮根瘤菌Azorhizobium caulinodans ORS571基因组分泌蛋白的生物信息学分析〔J〕. 基因组学与应用生物学,2012,31(4):394-400.
〔15〕Hempel J,Zehner S,GǑttfert M,et al.Analysis of the secretome of the soybean symbiont Bradyrhizobium japonicum〔J〕.Journal of Biotechnology,2009,140:51-58.
——固氮微生物

