不同品种鸡对肠炎沙门氏菌人工感染初期免疫应答反应的差异
刘 璐,李建超,刘冉冉,李庆贺,文 杰,常国斌,郑麦青,陈国宏*,赵桂苹*
(1.扬州大学动物科学与技术学院,扬州 225009;2.中国农业科学院北京畜牧兽医研究所,北京 100193)
不同品种鸡对肠炎沙门氏菌人工感染初期免疫应答反应的差异
刘 璐1,2,李建超1,2,刘冉冉2,李庆贺2,文 杰2,常国斌1,郑麦青2,陈国宏1*,赵桂苹2*
(1.扬州大学动物科学与技术学院,扬州 225009;2.中国农业科学院北京畜牧兽医研究所,北京 100193)
本试验以中国地方鸡种北京油鸡(Beijing-You chicken,BJY)和引入蛋鸡品种白来航鸡(White Leghorn,WL)为试验对象,通过人工感染肠炎沙门氏菌(SalmonellaEnteritidis,SE),研究两个不同遗传背景新生雏鸡在接种沙门氏菌后,部分免疫指标和相关基因的变化规律,揭示两品种鸡在早期对SE感染抗性的的异同点。选择1日龄的北京油鸡和白来航鸡各40只,隔离舱饲养,相同日粮水平条件下,两侧胸肌各注射8.7×108cfu·mL-1沙门氏菌0.5 mL,分别在攻毒后12、24、72 和144 h(12 hpi、24 hpi、72 hpi、144 hpi)测定IgY、IL-6和TNF-α血清介质变化,荧光定量检测血液载菌量、盲肠组织中TLR4受体、DNMT3a、DNMT3b和DNMT1甲基转移酶基因的表达情况。结果表明:(1) 攻毒沙门氏菌后,北京油鸡的IgY、IL-6、TNF-α血清介质水平显著高于白来航鸡(P<0.05);(2) 在12 hpi、24 hpi和72 hpi,血液载菌量品种间差异不显著(P>0.05),但在144 hpi白来航鸡血液中载菌量显著高于北京油鸡(P<0.05);(3) 在24 hpi,TLR4受体在北京油鸡盲肠组织中的表达显著高于白来航鸡;北京油鸡与白来航鸡DNMT3a、DNMT3b和DNMT1甲基转移酶基因在两品种间的表达差异显著(P<0.05)。结果提示,北京油鸡和白来航鸡对沙门氏菌的免疫性状具有明显的遗传差异,北京油鸡对沙门氏菌的抗性优于白来航鸡。
北京油鸡;白来航鸡;肠炎沙门氏菌;免疫性能
沙门氏菌是世界卫生组织公布的一种重要的人畜共患病原菌,不仅能够引起家禽的各种疾病,而且能够通过污染的禽肉造成人类沙门氏菌的感染,直接威胁人类的健康[1]。长期以来,临床上大量不合理的使用抗生素来预防和治疗沙门氏菌,使沙门氏菌耐药谱不断增宽,导致具有多重耐药性的沙门氏菌成为世界性肠炎最流行的致病菌之一[2]。通过提高畜禽抗病性可以减少抗生素的使用,节约饲养成本,同时减少畜禽产品的抗生素残留。
多年来,在控制沙门氏菌的传播、降低沙门氏菌感染等方面已展开了研究。研究发现,抗病力属于中低等遗传力的数量遗传性状,1周龄接种沙门氏菌和产蛋高峰接种沙门氏菌,其抗病力的遗传力分别为0.2和0.38[3]。胡艳等[4]对4个品种种鸡肠炎沙门菌天然感染率进行了比较,结果发现,中国地方肉用型鸡种清远麻鸡对肠炎沙门菌的抗性较强。孙钰[5]用鼠伤寒沙门氏菌感染寿光鸡和济宁百日鸡,发现两鸡种抗沙门氏菌能力存在差异,济宁百日鸡的血清抗体水平和盲肠TLR4表达量均极显著高于寿光鸡。本试验以北京油鸡和白来航鸡为研究对象,分析胸肌注射肠炎沙门氏菌后免疫指标和相关基因差异表达情况,旨在探究不同鸡种对肠炎沙门氏菌的抗性差异,为进一步揭示沙门氏菌的作用机制奠定基础,并为抗病育种提供理论依据和试验基础。
1 材料与方法
1.1 试验动物及菌株
1日龄白来航鸡和北京油鸡均来自昌平北京油鸡保种场,采用棉拭子法对父母代及试验用子代进行肠炎沙门氏菌检测,淘汰阳性个体。肠炎沙门氏菌标准株50041购于中国兽药监察所。
1.2 试验设计
白来航鸡和北京油鸡各40只,隔离仓中饲养。饲养到12日龄,以两侧胸肌各注射0.5 mL 沙门氏菌液(8.7×108cfu·mL-1)。在12 hpi、24 hpi、48 hpi和144 hpi每个品种分别随机选取6只称重,无菌心采血,用于血液指标测定及血液载菌量检测,另取盲肠置于RNA Stor (天根生化科技,北京)中,备用。
1.3 血液指标测定
对采集的血液离心,分离血清,ELISA 法检测血清中IgY、IL-6、TNF-α。
1.4 血液载菌量的检测
采用保洁罗生物公司的血液DNA提取试剂盒提取血液细菌DNA。按照S.X.Deng等[6]的方法对血液中的肠炎沙门氏菌量进行检测。根据肠炎沙门氏菌50041的SdfI基因(GenBank登录号:AF370707.1)设计引物和FAM标记的探针。引物及探针序列:上游引物:5′-TCCCTGAATCTGAGAAAGAAAAACTC-3′,下游引物:5′-TTG-ATGTGGTTGGTTCGTCACT-3′,荧光探针:5′-FAMTGCAGCGAGCATGTTCTGGAAAGCTAM-RA-3′。
以3.0×108cfu为标准品,分6个梯度稀释,制作标准品。以12 hpi、24 hpi、72 hpi和144 hpi的血液DNA为模板进行FQ-PCR,反应体系见表1。反应条件:95 ℃预变性5 min;94 ℃变性30 s,55 ℃退火延伸30 s,45个循环。
1.5 RT-PCR
采用Trizol试剂(Invitrogen)提取盲肠总RNA,经基因组DNA污染去除处理后,总RNA溶液浓度调整为1 μg·μL-1后进行反转录得到cDNA 。
表1 FQ-PCR反应体系
Table 1 FQ-PCR reaction system
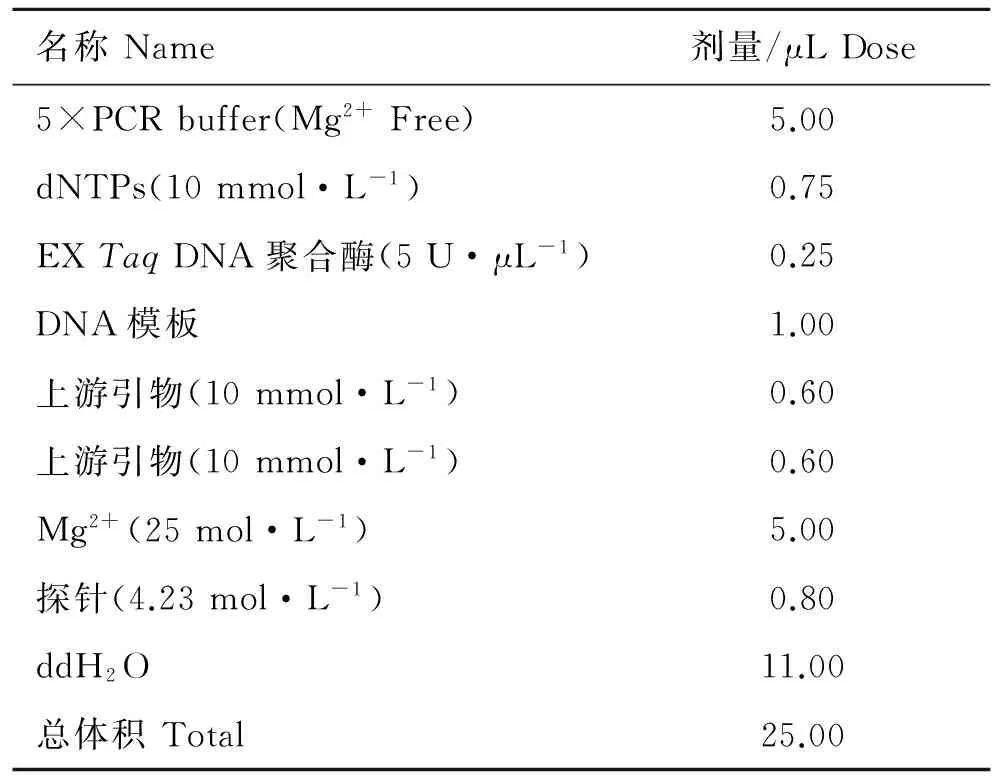
名称Name剂量/μLDose5×PCRbuffer(Mg2+Free)5.00dNTPs(10mmol·L-1)0.75EXTaqDNA聚合酶(5U·μL-1)0.25DNA模板1.00上游引物(10mmol·L-1)0.60上游引物(10mmol·L-1)0.60Mg2+(25mol·L-1)5.00探针(4.23mol·L-1)0.80ddH2O11.00总体积Total25.00
1.6 引物设计
从GenBank上获取红色原鸡TLR4 (Toll-like receptor 4)、DNMT1 (DNA methyltransferase 1)、DNMT3a(DNA methyltransferase 3a)和DNMT3b(DNA methyltransferase 3b)共4个候选基因以及内参基因β-actin的mRNA序列,采用Primer premier 5.0 软件设计5对引物(表2)。经过PCR扩增,扩增产物经1.5%琼脂糖电泳检测,PCR产物测序鉴定。
1.7 实时荧光定量PCR
以目的基因纯化回收产物为标准品,10倍梯度稀释后作为模板进行标准曲线的制备。同时以盲肠组织的cDNA作为模板测定样本的基因表达量,反应总体积20μL:cDNA模板 1.5 μL,2×SRBRGreen master Mix 10 μL,上、下游引物(l0 μmol·L-1) 各0.6 μL,Rox reference DyeII (50×) 0.4 μL,ddH2O 6.9 μL。
表2 Q-PCR所用引物
Table 2 Primers of Q-PCR

基因Gene引物序列(5'-3')Primerssequence退火温度/℃Tm登录号GenBankPCR产物长度/bpProductsizeβ-actinF:GAGAAATTGTGCGTGACATCAR:CCTGAACCTCTCATTGCCA57NM_205518.1152TLR4F:AGTCTGAAATTGCTGAGCTCAAATR:GCGACGTTAAGCCATGGAAG60NM_001030693.1190DNMT1F:AACCGCCACAACCACTGR:GCCTGTCGGTGTTTATCC57NM_206952.1215DNMT3aF:AAAAGGGACATCTCACGCR:GCTGAACTTGGCTATCCTG55NM_001024832.1189DNMT3bF:TCGAGTTCTACCATCTGCTCAAR:TCCACTCCAGGAACCGAGAAAT60NM_001024828.1132
设无模板试剂为阴性对照。反应条件:95 ℃预变性15 min;95 ℃ 10 s,55~60 ℃ 32 s(具体条件见表3),40个循环。最后制作熔解曲线收集信号的程序为95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s和60 ℃ 15 s。分析标准曲线线性范围及标准品实测值与换算值间的差异,每个时间点6个样本,每个样品设3个重复,取平均值。
1.8 数据处理与分析
相对定量结果采用2-ΔΔCt方法进行处理。试验数据采用SPSS 18.0软件的t检验进行分析,以P<0.05作为差异显著性判断标准。
2 结 果
2.1 接种沙门氏菌后两品种间血清介质差异
攻毒后两品种间血清介质差异如图1所示。在12 hpi,血清IL-6含量白来航鸡攻毒组显著高于北京油鸡(P<0.05),72 hpi北京油鸡显著高于白来航鸡(P<0.05)。在12 hpi、24 hpi,白来航鸡攻毒组血清TNF-α含量显著高于北京油鸡(P<0.05),而72 hpi北京油鸡攻毒组显著高于(P<0.05)白来航鸡,144 hpi两品种间差异不显著(P>0.05)。在12 hpi、24 hpi和72 hpi,北京油鸡血清中IgY含量显著高于白来航鸡(P<0.05),而144 hpi两品种间差异不显著(P>0.05)。除血清IgY在北京油鸡中各时间点的表达量均高于白来航鸡以外,血清IL-6和TNF-α在北京油鸡中的12 hpi起始表达量均低于白来航鸡,但在北京油鸡中的表达趋势是先上升后下降,在白来航鸡中的表达趋势是先下降后上升,在72 hpi时北京油鸡IL-6和TNF-α表达量均超过白来航鸡。
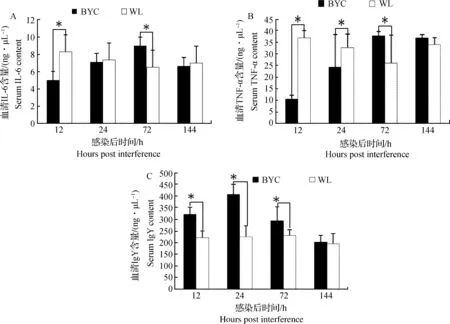
*.P<0.05;NS.No significance.The same as below图1 血清介质变化趋势Fig.1 The change tendency of serum medium
2.2 血液载菌量
应用探针法检测北京油鸡和白来航鸡12 hpi、24 hpi、72 hpi和144 hpi 4个时间点血液载菌量的变化情况。结果如图2所示,白来航鸡的载菌量表现为先下降后上升的趋势,在72 hpi到达最低值,之后又开始上升,而北京油鸡则在144 hpi达到最低值。
在12 hpi、24 hpi和72 hpi两品种间血液载菌量差异不显著(P>0.05),144 hpi白来航鸡血液载菌量显著高于北京油鸡(P<0.05)。
2.3 盲肠TLR4受体及甲基转移酶基因表达差异
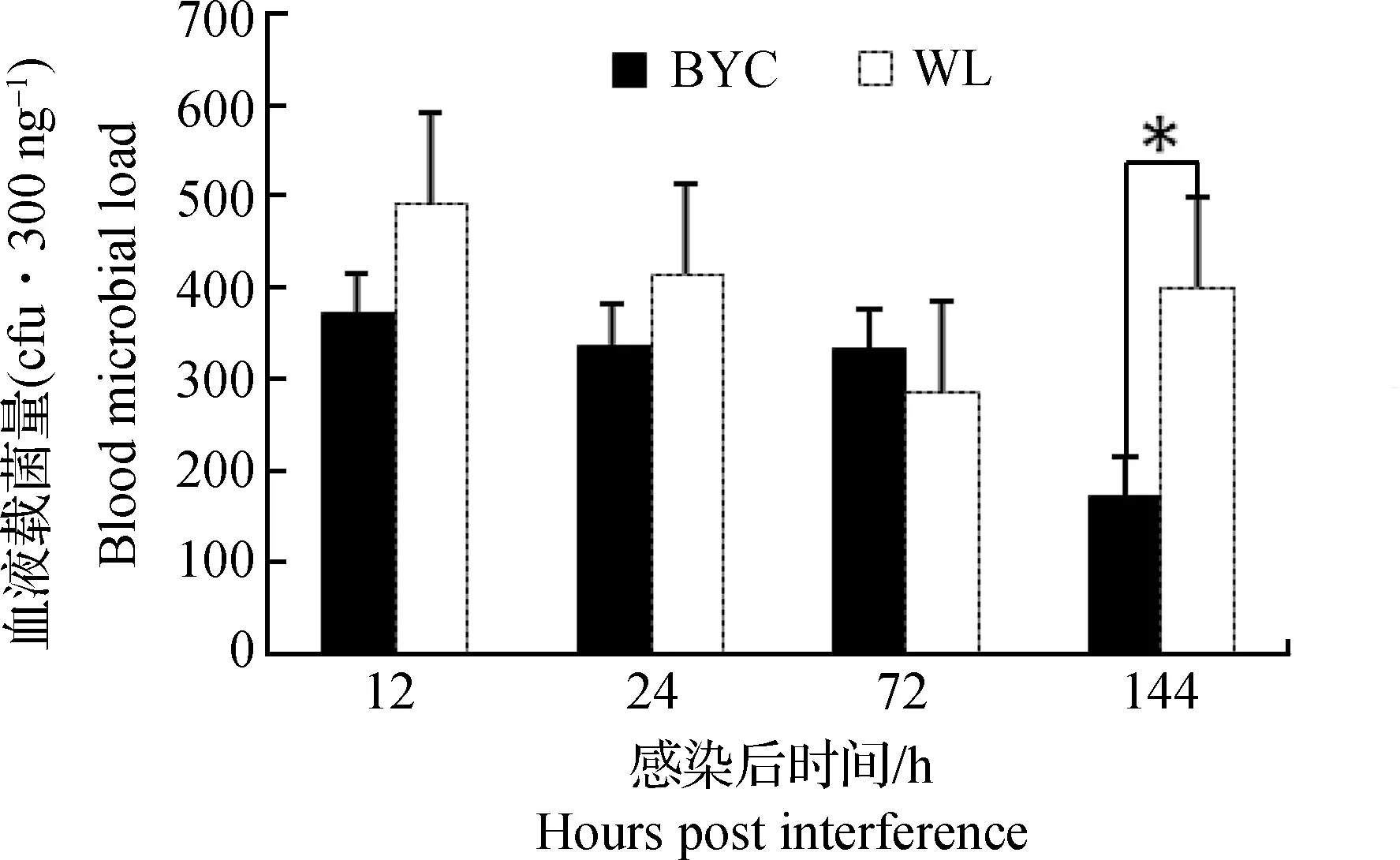
图2 血液载菌量变化趋势Fig.2 The change trend of blood microbial load
攻毒后两品种间盲肠中TLR4受体及甲基转移酶基因差异表达分析结果如图3所示,由图3可知,盲肠TLR4的表达量,24 hpi北京油鸡攻毒组显著高于白来航鸡攻毒组(P<0.05),而12 hpi、72 hpi和144 hpi两者差异不显著(P>0.05)。在72 hpi,DNMT1在北京油鸡攻毒组的表达显著高于白来航鸡(P<0.05),而其他3个时间点两品种间差异不显著(P>0.05)。在12 hpi、24 hpi和144 hpi,DNMT3a在北京油鸡攻毒组中的表达显著高于白来航鸡(P<0.05),而72 hpi白来航鸡显著高于北京油鸡(P<0.05)。12 hpi,DNMT3b在北京油鸡攻毒组的表达显著高于白来航鸡,而24 hpi白来航鸡攻毒显著高于北京油鸡攻毒组(P<0.05),但72 hpi和144 pih两品种间差异不显著(P>0.05)。
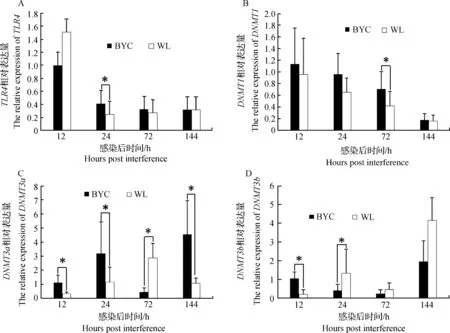
图3 盲肠中TLR4和甲基转移酶mRNA的相对表达水平Fig.3 The relative expression level of TLR4 and methyltransferase mRNA in caecum
3 讨 论
近年来,从免疫遗传机理的角度控制肠炎沙门氏菌的传播和流行引起越来越多的关注。众多研究证实,巨噬细胞合成和释放的IL-1、IL-6、TNF-α等细胞因子不仅能作为信号激活机体的免疫防御反应,同时能刺激巨噬细胞产生转化生长因子,引起免疫损伤后免疫抑制。当机体受到肠炎沙门氏菌刺激时,IL-6一定程度上反映了肠炎沙门氏菌和机体间相互作用[7]。革兰氏阴性菌的LPS刺激机体单核巨噬细胞会产生TNF-α参与炎症反应,并在病原微生物清除中起作用[8]。IgY在体内含量大、分布广、维持时间长,是机体抗感染免疫的主要力量[9],而且杨俊兴等研究显示,鸡抗肠炎沙门氏菌和抗鼠伤寒沙门氏菌卵黄抗体(IgY)可以抑制相应细菌的生长[10]。
在本研究中,两品种鸡攻毒后,北京油鸡IL-6、TNF-α血清介质表达量初始值低于白来航鸡,但在攻毒后期显著高于白来航鸡。推测该结果可能受母源抗体影响,白来航鸡较北京油鸡有更高的IL-6、TNF-α母源抗体[5],但是随着时间的增长,母源抗体含量逐渐降低,受到沙门氏菌感染后,自身产生抗体的能力较北京油鸡弱。L.Eckmann等的小鼠感染试验表明,TNF-α、IFN-γ、IL-12和IL-18等细胞因子对抵御沙门氏菌的早期感染非常重要,能提高感染小鼠的存活率[11]。本研究结果显示,北京油鸡自身产生IL-6、TNF-α能力较白来航鸡强,对沙门氏菌应激免疫应答迅速,同时也证明了不同品种的特异性免疫功能存在遗传差异。北京油鸡各时间点IgY明显高于白来航鸡,表明北京油鸡抗感染和抗应激强,在相同的攻毒条件下,缓解沙门氏菌引起的特异性和非特异性反应的能力比白来航鸡强。这验证了中国地方鸡种抗逆性强的优良特性。
载菌量与鸡对沙门氏菌抗性呈负相关,高的载菌量往往预示着低抗病性、低治疗效果[12-15]。沙门氏菌感染后,在肠道大量繁殖,经淋巴系统进入血液,随后在脾、盲肠、法氏囊等器官繁殖。感染后载菌量的变化可以反映机体对沙门氏菌先天性免疫应答的能力和抗性[16]。载菌量的检测方法很多,除了传统的涂平板记数外,目前应用较多的是实时荧光定量PCR(Real-time Q-PCR)检测细菌中特异性DNA[6,17]。周丽民等[18]将Q-PCR法在检测致病菌方面与细菌培养法作比较,发现Real-time Q-PCR法较细菌培养法具有准确性好、灵敏度高、特异性强和快速检测等优点。雷永良等[19]采用国家标准的细菌培养法和实时荧光定量PCR方法对食品污染物监测中也得到了相同的结论。本研究采用qPCR的方法检测沙门氏菌特异的DNA浓度来推测沙门氏菌的数量,从各时间点趋势图上可以看出白来航鸡的血液载菌量高于北京油鸡(P>0.05)。鸡盲肠中高水平的载菌量附植与吞噬细胞活性降低以及白细胞增殖反应下降相关[20],因此推测两品种的细胞免疫存在差异,北京油鸡产生细胞免疫反应的速度比白来航鸡快。
TLR4作为一种跨膜信号传递受体,除了能识别LPS,还能识别多种配体,如内源性配体HSP60、HSP70、HSP90等[21]。而TLR4识别LPS的信号通路主要是TLR4/MyD88/NF-kB信号通路,苟忠勇[22]研究结果表明,鸡白细胞中TLR4的表达被抑制是导致沙门氏菌易感性增加,鸡死亡的重要原因。J.R.Sadeyen等[20]利用沙门氏菌易感和抗性品系进了TLR4基因表达量的研究,在感染后第1、2、4周,抗性品系的TLR4基因表达量均高于易感性品系,同时发现,TLR4基因的表达量与Gal1和Gal2基因的表达呈强相关(R=0.74;R=0.64),与IL-8、IL-18和IFN-γ等免疫相关基因存在不同程度的相关性。李鹏等[23]研究发现,鸡沙门氏菌感染后,TLR4基因mRNA表达上调,TLR4基因在沙门氏菌感染中发挥重要作用。本研究初步比较了不同品种鸡盲肠TLR4基因mRNA表达量,发现北京油鸡盲肠TLR4基因mRNA表达量显著高于白来航鸡,提示北京油鸡TLR4基因表达及其信号通路激活可能要比在白来航鸡活跃,从而导致两品种间抗沙门氏菌免疫性能的差异。
DNA甲基化是真核生物基因表达调控的一种方式。通过在DNA的CpG二核苷酸胞嘧啶的第5位碳原子上加上甲基,即可抑制或关闭基因表达,催化这一过程的是DNA甲基转移酶(Dnmt)[24]。DNA甲基转移酶(DNMTs)在家禽中分两种,一种是从头合成酶,包括DNMT3a和DNMT3b;另一种则是DNA甲基化维持酶DNMT1。苟忠勇[22]对肠炎沙门氏菌抗病组和易感组进行比较,发现,TLR4和TLR21基因的启动子区甲基化不同,感染组鸡甲基化水平显著高于抗病组。F.Tian等[25]研究发现,感染马立克氏病病毒后,马立克氏病抗病品系6 3感染组DNAMT3a表达量低于对照组,并推断马立克氏病抗性可能和甲基化有关。孟纪伦[26]发现,H5N1禽流感病毒感染与非感染鸡和鸭,攻毒组脾DNA甲基化均高于对照组。H.Xu等[27]对鸡人工感染大肠杆菌MeDIP-seq测序发现,病理变化程度不同的鸡全基因甲基化的基因不同,找到大量差异基因,其中包括IL-8、IL-2和IL-1。本研究中,两种雏鸡感染肠炎沙门氏菌后,甲基化维持酶基因DNMT1、DNMT3a表达在白来航鸡低于北京油鸡,DNMT3b表达白来航鸡高于北京油鸡,抗病和易感品种甲基转移酶表达未得到总结性结论。L.Juan等[28]发现,鸡在感染马立克氏病后有很多基因启动子区域CpG位点甲基化产生动态变化,且不同基因甲基化的动态变化不同。
4 结 论
通过对中国地方品种北京油鸡和引进品种白来航蛋鸡不同免疫性状比较,发现两品种在炎性细胞因子变化规律、血液载菌量、TLR4和DNA甲基转移酶在盲肠的表达等性状均呈现显著差异。结果表明,北京油鸡面对沙门氏菌应激血清抗体和细胞免疫应答较为迅速,TLR4基因表达及其信号通路激活活跃,初步说明了北京油鸡这一地方品种抗肠炎沙门氏菌能力优于引进白来航鸡。
[1] 陆 彦,吕 安,赵红玉,等.鸡源肠炎沙门氏菌对抗菌药物的耐药性分析[J].中国人兽共患病学报,2014,(1):17-22. LU Y,LÜ A,ZHAO H Y.et al.Analysis of antimicrobial resistance amongSalmonellaenteritidisfrom chicken [J].ChineseJournalofZoonoses,2014,(1):17-22.(in Chinese)
[2] 廖成水,程相朝,张春杰,等.鸡源致病性沙门氏菌新近分离株的耐药性与耐药基因[J].中国兽医科学,2011,(7):18-23. LIAO C S,CHENG X C,ZHANG C J,et al.Antimicrobial resistance and resistance genes of pathogenicSalmonellarecently isolated from chicken [J].ChineseVeterinaryScience,2011,(7):18-23.(in Chinese)
[3] BERTHELOT F,BEAUMONT C,MOMPART F,et al.Estimated heritability of the resistance to cecal carrier state of Salmonella enteritidis in chickens [J].PoultSci,1998,77(6):797-801.
[4] 胡 艳,单艳菊,刘学贤,等.不同鸡种沙门菌感染率比较分析[J].中国家禽,2010,32(5):31-33. HU Y,SHAN Y J,LIU X X,et al.Comparison ofSalmonellanatural infection rates in different kinds of chicken breeds [J].ChinaPoultry, 2010,32(5):31-33.(in Chinese)
[5] 孙 钰.TLR4基因的变异分析及TLRs基因与鸡沙门氏菌感染的相关性研究[D].泰安:山东农业大学,2013. SUN Y.Studies on variation analysis of TLR4 gene and the association of TLRs gene with chicken response [D].Taian:Shandong Agricultural University,2013.(in Chinese)
[6] DENG S X,CHENG A C,WANG M S,et al.Serovar-specific real-time quantitative detection of Salmonella enteritidis in the gastrointestinal tract of ducks after oral challenge [J].AvianDis,2008,52(1):88-93.
[7] 陈士华,周海鸥,花扣珍,等.自发性细菌性腹膜炎患者腹水LPS、IL6、PCT测定的临床意义[J].浙江医学教育,2009,8(1):46-48. CHEN S H,ZHOU H O,HUA K Z,et al.The clinical significance of measurement of LPS,IL-6,PCT in ascites of spontaneous bacterial peritonitis [J].ZhejiangMedicalEducation,2009,8(1):46-48.(in Chinese)
[8] SAIF Y M.禽病学[M].第11版.苏敬良,高福主译.北京:中国农业大学出版社,2002:642-643. SAIF Y M.Disease of poultry [M].Eleventh edition.SU Jing-liang,GAO Fu Master translation.Beijing:China Agricultural Press,2002:642-643.(in Chinese)
[9] 马玉英,蒙旭辉.鸡卵黄抗体[J].畜牧兽医杂志,2013,32(4):24-27. MA Y Y,MENG X H.Chicken egg yolk antibody [J].JournalofAnimalScience,2013,32(4):24-27.(in Chinese)
[10] 杨俊兴,牛明福,王川庆.抗肠炎沙门氏菌和鼠伤寒沙门氏菌鸡卵黄抗体(IgY)的研究[J].上海畜牧兽医通讯,2003,(3):10-12. YANG J X,NIU M F,WANG C Q.Invitrostudy of chicken egg yolk antibody (IgY) against Salmonella enteritidis [J].ShanghaiAnimalHusbandryandVeterinaryCommunication,2003,(3):10-12.(in Chinese)
[11] ECKMANN L,KAGNOFF M F.Cytokines in host defense against Salmonella [J].MicrobesInfect,2001,(3):1191-1200.
[12] BERTHELOT H F,MOMPART F,ZYGMUNT M S,et al.Antibody responses in the serum and gut of chicken lines differing in cecal carriage of Salmonellaenteritidis [J].VetImmunolImmunopathol,2003,96(1):43-52.
[13] BOLDER N M,JANSS L L G,PUTIRULAN F F,et al.Resistance of broiler outbred lines to infection with Salmonella enteritidis[J].AvianPathol,2002,31(6):581-587.
[14] SADEYEN J R,TROTEREAU J,VELGE P,et al.Salmonellacarrier state in chicken:comparison of expression of immune response genes between susceptible and resistant animals [J].MicrobesInfection,2004,6(14):1278-1286.
[15] ABASHT B,KAISER M G,LAMONT S J.Toll-like receptor gene expression in cecum and spleen of advanced intercross line chicks infected with Salmonella entericserovar Enteritidis [J].VetImmunolImmunopathol,2008,123(3):314-323.
[16] 潘志明,黄金林,唐丽华,等.沙门氏菌感染的免疫应答[J].动物医学进展,2005,26(4):41-44. PAN Z M,HUANG J L,TANG L H,et al.The innate immune response toSalmonella[J].ProgressinVeterinaryMedicine,2005,26(4):41-44.(in Chinese)
[17] NADKARNI M A,MARTIN F E,JACQUES N A,et al.Determination of bacterial load by real-time PCR using a broad-range (universal) probe and primers set [J].Microbiology, 2002,148(Pt 1):257-266.
[18] 周丽民,雷永良,王小光,等.实时荧光定量PCR技术在致病菌检测中的应用[J].标记免疫分析与临床,2012,(5):156-159. ZHOU L M,LEI Y L,WANG X G,et al.Application of real-time fluorescence quantitative PCR technology in the detection of pathogens [J].LabeledImmunoassays&ClinicalMedicine,2012,(5):156-159.(in Chinese)
[19] 雷永良,王晓光,叶碧峰,等.实时荧光定量PCR技术在食品污染物监测中的应用[J].中国卫生检验杂志,2009,(4):828-830. LEI Y L,WANG X G,YE B F,et al.Application of real-time quantitative PCR for monitoring of food contamination [J].ChineseJournalofHealthLaboratoryTechnology,2009,(4):828-830.(in Chinese)
[20] SADEYEN J R,TROTEREAU J,PROTAIS J,et al.Salmonellacarrier-state in hens:Study of host resistance by a gene expression approach [J].Mi-crobesandInfection,2006,8:1308-1314.
[21] 甘建伉,张泽樘,罗庆斌,等.鸡沙门氏菌抗性基因研究进展[J].中国家禽,2012(34):48-50. GAN J K,ZHANG Z T,LUO Q B,et al.The research progress of chicken Salmonella resistant gene [J].ChinaPoultry,2012,(34):48-50.(in Chinese)
[22] 苟忠勇.鸡TLRs基因的表达调控与抗沙门氏菌的机制研究[D].北京:中国农业科学院,2012. GOU Z Y.Study of regulation of TLRs expression and molecular mechanism of resistance toSalmonellain chickens [D].Beijing:Chinese Academy of Agricultural Sciences,2012.(in Chinese)
[23] 李 鹏,夏平安,宋咏梅,等.鸡TLR4基因表达水平与沙门氏菌感染关系的研究[J].中国畜牧兽医,2009,(5):147-150. LI P,XIA P A,SONG Y M,et al.Study on the relationship between chicken Toll Like Receptor 4 expression level andSalmonellainfection [J].ChineseAnimalHusbandryandVeterinaryMedicine,2009,(5):147-150.(in Chinese)
[24] 史玉杰,李庆贺,刘晓辉.DNA甲基化与基因表达调控研究进展[J].中国生物工程杂志 ISTIC PKU,2013,33(7)321-327. SHI Y J,LI Q H,LIU X H.Progress in studies of DNA methylation and gene expression regulation [J].ChinaBiotechnology,2013,33(7):321-327.(in Chinese)
[25] TIAN F,ZHAN F,VANDERKRAATS N D,et al.DNMT gene expression and methylome in Marek’s disease resistant and susceptible chickens prior to and following infection by MDV [J].Epigenetics,2013,8(4):431-444.
[26] 孟纪伦.H5N1 禽流感病毒感染与非感染鸡和鸭不同免疫器官 DNA 甲基化差异分析[D].长春:吉林大学,2012. MENG J L.Differential analysis of DNA methylation level between SPF chicken/duck and the chicken /duck infected by H5N1 among different immune organs [D].Changchun:Jilin University,2012.(in Chinese)
[27] XU H,ZHU X,HU Y,et al.DNA methylome in spleen of avian pathogenic escherichia coli-challenged broilers and integration with mRNA expression [J].SciRep,2014,12:4.
[28] JUAN L,YING Y,SHUANG C,et al.DNA methylation fluctuation induced by virus infection differs between MD-resistant and -susceptible chickens [J].FrontGenet,2012,2:2.
(编辑 郭云雁)
Differences of Early Innate Immunity between Chicken Breeds againstSalmonellaEnteritidisInfection
LIU Lu1,2,LI Jian-chao1,2,LIU Ran-ran2,LI Qing-he2,WEN Jie2,CHANG Guo-bin1,ZHENG Mai-qing2,CHEN Guo-hong1*,ZHAO Gui-ping2*
(1.CollegeofAnimalScienceandTechnology,YangzhouUniversity,Yangzhou225009,China;2.InstituteofAnimalScience,ChineseAcademyofAgriculturalSciences,Beijing100193,China)
This study was conducted to study the effect ofS.Enteritidisinfection on early immune performance between two chicken breeds(the Beijing-You chicken(BJY),a Chinese indigenous breed,and the White Leghorn(WL),an imported laying type breed).40 BJY chickens and 40 WL chickens on 1-day-old were reared in isolators during the same period and were challenged by intramuscular injection with 8.7×108cfu·mL-1per chick(0.5 mL) ofS.Enteritidissuspension,the concentrations of cytokines,antibodies and theS.Enteritidiscolonization level in the blood and the expression ofTLR4 and methyltransferase genes were determined in each group at 12,24,72 and 144 h after post-infection (12 hpi,24 hpi,72 hpi,144 hpi).The results showed that:(1)After challenged byS.Enteritidis,the two breeds showed significant differences in the serum antibody levels of IgY,IL-6,TNF-α,the antibody levels in BJY were higher(P<0.05);(2) TheSEcolonization level in the blood of BJY was significantly lower than that of WL at 144 hpi (P<0.05),while there were no differences at 12 hpi,24 hpi,72 hpi between two breeds(P>0.05);(3) At 12 hpi the relative quantity ofTLR4 in caecum in WL chickens was higher than that in BJY chickens,while at 24 hpi BJY chickens was significantly higher than that in WL chickens(P<0.05).There were significant differences for methyltransferase genes (DNMT1,DNMT3AandDNMT3B) expression in caecum between the two breeds(P<0.05).The results demonstrated that the two breeds differed markedly in immune traits afterS.Enteritidisinfection.BJY chicken was superior than WL chickens in considering of immune index.
Beijing-You chicken;White Leghorn chicken;S.Enteritidis;immune traits
10.11843/j.issn.0366-6964.2015.06.005
2014-11-07
国家现代农业肉鸡产业技术体系(CARS-42);江苏省农业科技支撑计划(BE2013392)
刘 璐(1990-),女,江苏徐州人,硕士,主要从事家禽遗传育种研究,E-mail:m13051343248@163.com。刘 璐和李建超同为第一作者
*通信作者:赵桂苹,研究员,主要从事家禽遗传育种研究,Tel:010-62816019,E-mail:zhgp0402@iascaas.net.cn;陈国宏,教授,主要从事家禽遗传育种研究,Tel:0514-87979206,E-mail:ghchen@yzu.edu.cn
S831;S813.3
A
0366-6964(2015)06-0903-08

