354份小麦种质中抗白粉病基因Pm21和Pm13的分布研究
董 娜,李 淦,张亚娟,任翠翠,茹振钢
(河南科技学院小麦中心,河南省高等学校作物分子育种重点开放实验室,现代生物育种河南省协同创新中心,新乡 453003)
小麦白粉病是由专性寄生真菌Erysiphegraminisf.sp.tritici引起的世界性病害,各主要产麦国均有分布。20世纪70年代以来,随着麦田肥水条件的改善及高产田群体密度加大,我国由小麦白粉病危害造成的损失日益严重。一般年份小麦白粉病可使小麦减产5%~19%,严重危害时可减产30%[1-2]。
选育和推广抗病小麦品种是防治小麦白粉病最为经济、有效和环保的措施。目前,已在小麦基因组的41个位点鉴定出了57个主效抗白粉病基因,其中包括22个复等位基因,并将一部分有效抗病基因转育到栽培品种中[3]。然而,由于白粉菌生理小种变异快、群体组成复杂,抗病基因会因为白粉病菌毒力频率变化或新的毒力型的出现而丧失抗性,例如,Pm1、Pm3a、Pm3b、Pm3c、Pm3f、Pm5、Pm7、Pm8等抗病基因已在中国丧失抗性,最近几年,Pm4a在中国大部分地区也基本丧失抗性[4]。而来源于簇毛麦的Pm21对现有的白粉菌生理小种均表现免疫,在不同小麦遗传背景下抗病性表现稳定,是目前已知抗白粉病基因中最好的抗病基因[5-7]。来源于高大山羊草的抗白粉病基因Pm13,在普通小麦的遗传背景条件下也能完全表达其抗性,表现中至高抗[4,8-9]。作为优异的抗病基因资源,Pm21和Pm13正在成为育种工作者关注的重点。
因此,本研究利用与抗白粉病基因Pm21 和Pm13共分离的分子标记SCAR1400[6]和SCAR564[10],对河南科技学院小麦中心收集的354份小麦种质进行检测,了解现有育种材料中抗性基因Pm21 和Pm13的分布状况,以期为小麦抗白粉病材料的合理利用以及抗白粉病基因聚合育种提供参考依据。
1 材料与方法
1.1 材料种植及白粉病抗性调查
354份小麦种质由河南科技学院小麦中心收集和保存,其中河南省各育种单位育成的品种或品系118份,其余236份为从全国多个麦区收集到的育成品种或品系。所有小麦种质于2013年秋播种于河南科技学院小麦中心位于新乡市辉县的种质圃中,每份种质均播种两行,畦埂上种诱发行(‘石家庄8号’),常规田间管理,第二年春季小麦返青后取样检测。白粉病为田间自然发病,于小麦灌浆中期调查不同品种上白粉病的发病严重度,病级划分按照盛宝钦等[11]的0~9级法。其中0和0;为免疫,1~2级为高抗,3~4级为中抗,5~6级为中感,7~8级为高感,9级为极感。
1.2 引物的合成
文中所用的分子标记引物由北京鼎国昌盛生物技术有限责任公司合成,序列见表1。
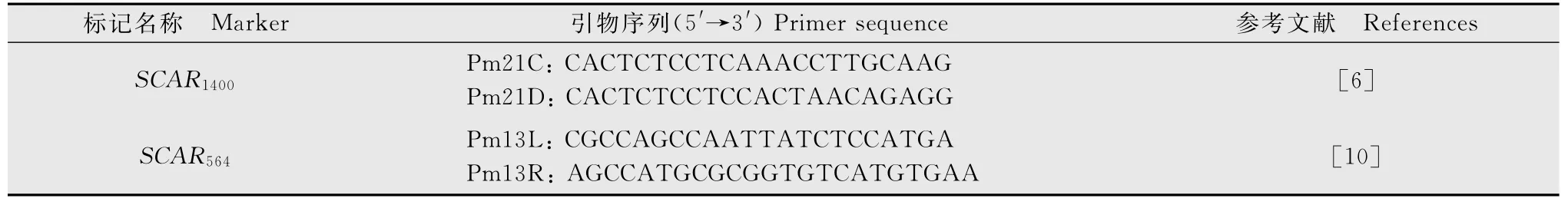
表1 试验用分子标记及序列Table 1 Markers and their sequences used in this study
1.3 基因组DNA 提取
取小麦幼苗叶片0.2g左右放入1.5mL离心管中,液氮研磨后,采用CTAB 法[12]提取基因组DNA,用1.0%琼脂糖凝胶电泳检测DNA提取效果。
1.4 标记检测
PCR扩增于ABI Gene Amp PCR System 9700型PCR仪上进行。反应体系20μL,包括2×TaqMaster Mix(购自北京康为世纪生物科技有限公司)10μL,10μmol/L特异引物各0.5μL,模板DNA50~100ng,余下用ddH2O 补足。SCAR1400的扩增程序为94℃预变性5min;94℃变性50s、55℃退火50s、72℃延伸2min,36个循环;72 ℃终延伸10min,4 ℃保存;SCAR564的扩增程序为94 ℃预变性5min;94 ℃变性50s、55℃退火50s、72℃延伸50s,36个循环;72℃终延伸10min,4℃保存。扩增产物经1%琼脂糖凝胶(含goldview染料),110V下电泳40min左右,然后利用凝胶成像仪观察电泳结果并拍照保存。
2 结果与分析
2.1 Pm21基因的分子标记检测结果
利用与Pm21基因共分离的标记SCAR1400检测该基因在354份种质中的分布情况,含有Pm21基因的材料可扩增出大小为1400bp的目标条带(图1)。在检测的354份材料中有21份材料能够扩增出预期大小的DNA 条带,说明这21份材料中含有Pm21基因,检出率为5.9%。其余333份材料中均未扩增出目标条带,说明这些材料中不含Pm21基因。携带Pm21 基因的21 份材料分别为:‘石H083-366’、‘BH50890-1-1’、‘06Y06’、‘南农02Y393’、‘09P80’、‘09P131’、‘09P283’、‘黔麦18 号’(‘黔0205’)、‘黔早麦15-3’、‘黔979-1’、‘黔9963-3’、‘黔9961-2’、‘YN06’、‘绵 杂 麦168’(‘ML2651’)、‘MR168’、‘09品A6’、‘09品E6’、‘内麦836’、‘内麦9号’、‘绵阳39’和‘绵麦367’(‘绵阳06-367’)。其中‘内麦836’、‘内麦9号’、‘绵麦367’和‘绵杂麦168’为国审品种,‘黔麦18号’为贵州省审定品种,其余16份为育种中间材料或育成品系。这21份种质搜集于9个育种单位,部分种质原育种单位提供有杂交组合来源,成株期白粉病抗性调查结果表明,携带Pm21的种质对白粉病菌表现免疫(表2)。
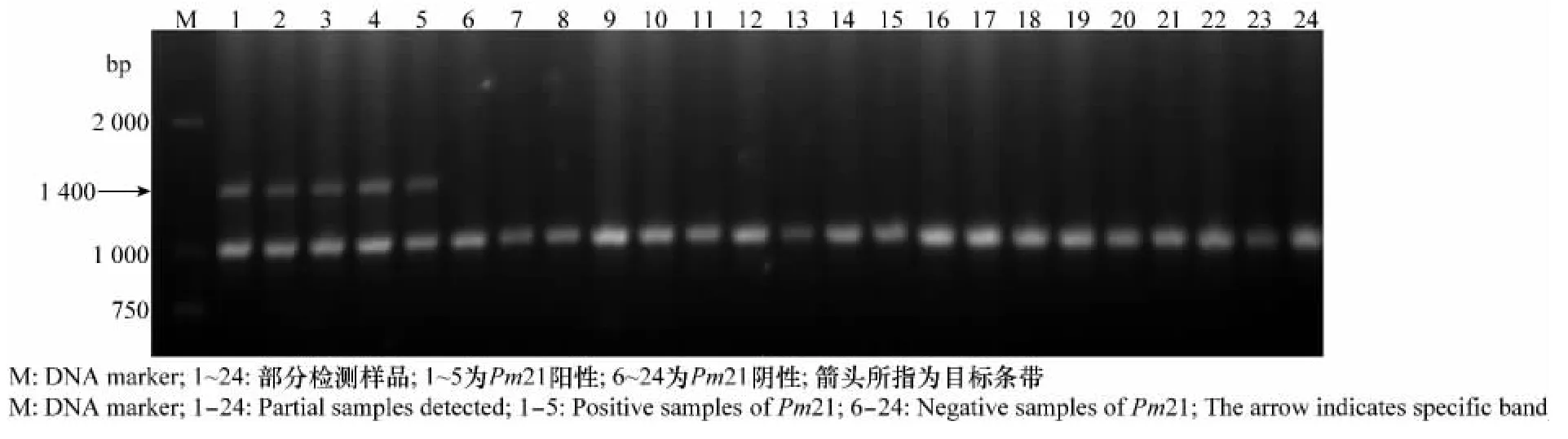
图1 Pm21基因的分子标记检测结果Fig.1 PCR pattern amplified by SCAR marker of Pm21

表2 携带Pm21或Pm13种质的来源及对白粉病抗性Table 2 Sources and powdery mildew resistance of wheat germplasms carrying Pm21or Pm13
2.2 Pm13基因的分子标记检测结果
用于检测Pm13 基因的是与之共分离的标记SCAR564,含有Pm13的材料可扩增出大小为564bp的特异性条带(图2)。结果表明,在检测的354份材料中只有1份材料‘中大01’能够扩增出预期大小的DNA条带,说明‘中大01’含有Pm13,检出率为0.28%。而其余353份材料中均未扩增出目标条带,说明这些材料中均未携带该基因。在检测的354份材料中仅有一份携带有Pm13基因,检出率极低,可能是因为该基因目前在育种中利用较少,而且本研究检测的种质材料数量也相对有限。另外,从电泳图上可看到明显的引物二聚体条带,可能跟引物设计质量、反应体系中引物浓度及退火温度有关。田间鉴定结果表明,携带Pm13的种质‘中大01’对白粉病菌表现高抗(表2)。
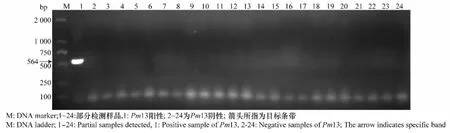
图2 Pm13基因的分子标记检测结果Fig.2 PCR pattern amplified by SCAR marker of Pm13
2.3 Pm21和Pm13的分布情况
本研究检测的354份种质资源收集于全国16个省、自治区或直辖市,其中河南省最多,有118份,其次为陕西、江苏、山东和北京等地。不同来源的种质中,Pm21和Pm13的分布极不平衡。携带Pm21的种质有21份,分布于四川、江苏等6省,其中四川来源的携带Pm21的种质数量最多,有8份,占该地检测种质总数的32%,其次为江苏和贵州,各有5份,分别占各自检测总数的13.5%和71.4%,陕西、河北和云南的材料中各有1份,分别占2.4%、3.2%和25%。携带Pm21的5个审定品种‘内麦836’、‘内麦9号’、‘绵麦367’、‘绵杂麦168’和‘黔麦18号’分别来自四川和贵州,均属西南冬麦区品种,在小麦主产区的河南、山东等省育成的品种(系)中,均未检测到Pm21的分布。在这354份种质中,只有来自河南的小麦品系‘中大01’携带Pm13,其余353份材料中均未检测到该基因的分布,而且未检测到同时携带这两个基因的种质材料(表3)。

表3 354份种质中Pm21和Pm13的分布情况Table 3 Distribution of Pm21and Pm13among 354wheat germplasms
3 讨论
抗病基因种质资源的有效评价是抗病育种的基础。传统抗病性鉴定主要是通过田间或室内接种,根据小麦对病原的反应型进行判断,由于小麦抗病性涉及两种生物的互作,其反应型易受接种方法、环境条件和发育时期等因素的影响,因此效率低、可靠性差。以PCR 为基础的分子标记技术可从DNA 水平对种质材料的基因型进行直接鉴定,具有操作简便、快速且不受环境条件影响等优点,为抗病基因检测提供了有效手段[13]。
SCAR1400和SCAR564是分别与Pm21 和Pm13共分离的以PCR 为基础的分子标记,在辅助育种中已有较多的应用[14-17]。张增艳等[15]利用小麦抗白粉病基因Pm4、Pm13和Pm21的特异性PCR 标记对含有Pm4b、Pm13、Pm21的小麦品系复交F2代进行检测,从中选择出含有聚合Pm4b+Pm21+Pm13、Pm4b+Pm13、Pm4b+Pm21 和Pm13+Pm21的抗病植株。陈涛等[16]利用与抗白粉病基因Pm21和Pm13 连锁的特异标记,在含有抗白粉病基因Pm21和Pm13的杂交F4代群体中进行辅助检测,从114个单株中检测出4 株同时具有Pm21和Pm13的特异标记。本研究中,利用SCAR1400和SCAR564分别扩增出了1400bp 和564bp 的特异DNA 条带,带型清晰,与前人研究结果一致,进一步验证了这些标记的高度特异性以及在不同遗传背景中的稳定性,并从354 份种质材料中鉴定出携带Pm21的材料21份,携带Pm13的材料1份,这些材料可作为抗白粉病育种的重要亲本资源。
在检测的354份种质中,Pm21和Pm13的分布极不平衡,仅有‘中大01’携带Pm13,其余353份种质中均未检测到该基因;携带Pm21的有21份,但大部分为育种中间材料或育成品系,只有‘内麦836’、‘内麦9号’、‘绵麦367’、‘绵杂麦168’和‘黔麦18号’为审定品种,且均属于长江上游冬麦区,在小麦主产区的河南、山东和安徽等省育成的品种(系)中,则未检测到该基因的存在,而且也未检测到同时携带这两个基因的材料。因此,为了培育持久抗病品种,本课题组正致力于将Pm21 和Pm13 聚合,并转到适于黄淮麦区的遗传背景中。
[1]刘万才,邵振润.我国小麦白粉病大区流行的气候因素分析[J].植保技术与推广,1998,18(1):3-5.
[2]段霞瑜,盛宝钦,周益林,等.小麦白粉病菌生理小种的鉴定与病菌毒性的监测[J].植物病理学报,1998,25(1):31-36.
[3]张海泉.小麦抗白粉病分子育种研究进展[J].中国生态农业学报,2008,16(4):1060-1066.
[4]詹海仙,畅志坚,杨足君,等.小麦抗白粉病基因来源及抗性评价的研究进展[J].中国农学通报,2010,26(10):42-46.
[5]齐莉莉,陈佩度,刘大钧,等.小麦白粉病新抗源—基因Pm21[J].作物学报,1995,21(3):257-262.
[6]Liu Z,Sun Q,Ni Z,et al.Development of SCAR markers linked to thePm21gene conferring resistance to the powdery mildew in common wheat[J].Plant Breeding,1999,118:215-219.
[7]Cao A Z,Wang X E,Chen Y P,et al.A sequence-specific PCR marker linked with Pm21 distinguishes chromosomes 6AS,6BS,6DS ofTriticumaestivumand 6VS ofHaynaldia villosa[J].Plant Breeding,2006,125(3):201-205.
[8]Cenci A,D’Ovidio R,Tanzarella O A,et al.Genetic analysis of theAegilopslongissima3Schromosome carrying thePm13 resistance gene[J].Euphytica,2003,130(2):177-183.
[9]Donini P,Koebner R M D,Ceoloni C.Cytogenetic and molecular mapping of the wheat-Aegilopslongissimachromatin breakpoints in powdery mildew-resistant introgression lines[J].Theoretical and Applied Genetics,1995,91(5):738-743.
[10]Cenci A,D’Ovidio R,Tanzarella O A,et al.Identification of molecular markers linked toPm13,anAegilopslongissimagene conferring resistance to powdery mildew in wheat[J].Theoretical and Applied Genetics,1999,98(3/4):448-454.
[11]盛宝钦,段霞谕.对记载小麦成株白粉病“0~9级法”的改进[J].北京农业科学,1991(1):38-39.
[12]Wang Min,Na Dongchen,Ji Hutai,et al.A simple and quick method of extracting genomic DNA from wheat leaves[J].Agricultural Science &Technology,2009,10(5):34-35.
[13]武玉华.分子标记辅助选择在小麦抗病和品质遗传育种中的应用[J].麦类作物学报,2007,27(5):928-933.
[14]刘兵,李绍慧,王永强,等.我国主要小麦推广品种抗白粉病基因的分子检测[J].植物保护学报,2010,37(2):113-117.
[15]张增艳,张超.分子标记选择小麦抗白粉病基因Pm4b,Pm13和Pm21聚合体[J].中国农业科学,2002,35(7):789-793.
[16]陈涛,隋建枢,彭昕,等.小麦抗白粉病基因Pm13和Pm21的多重PCR 检测[J].贵州农业科学,2012,40(1):31-35.
[17]李吉,万江华,任明见,等.小麦抗白粉病基因Pm13和Pm21特异标记的鉴定和应用[J].贵州农业科学,2009,37(10):1-4.

