两种甜瓜病毒寿光分离物的分子检测与鉴定
乔 宁,魏家鹏,李美芹*,刘永光,姜会霞,竺晓平,田素波
(1.潍坊科技学院,寿光 262700;2.山东农业大学植保学院,泰安 271018;3.山东寿光蔬菜种业集团有限公司,寿光 262700)
甜瓜(Cucumismelo)是起源于非洲和亚洲热带地区的喜温植物,属葫芦科,是我国重要的经济作物和深受消费者喜爱的水果之一。甜瓜也是山东省寿光市种植面积较大的瓜果品种之一,常年种植达2×103hm2,其中最有名的是‘玉锦’甜瓜,如今已销往全国各地。但是近年来,各种病虫害,尤其是病毒病对甜瓜危害较重,严重影响了甜瓜的产量和品质,其中,甜瓜坏死斑点病毒及瓜类褪绿黄化病毒在瓜类作物中大面积发生,严重危害了甜瓜等瓜类作物的生长[1-5]。
甜瓜坏死斑点病毒属于香石竹斑驳病毒属(Carmovirus),除侵染甜瓜外还能够侵染其他多种葫芦科植物,如黄瓜、西瓜、丝瓜、葫芦、南瓜等;其主要通过种子、黄瓜黑头叶甲、土壤真菌—瓜油壶菌及机械磨擦等进行传播[6];瓜类褪绿黄化病毒属于毛形病毒属(Crinivirus),主要侵染黄瓜、西瓜、甜瓜等瓜类作物,通过烟粉虱以半持久性方式传播[7]。
以RT-PCR 为基础的分子检测技术已被广泛应用于检测侵染甜瓜以及其他葫芦科作物的病毒[8-10]。本研究采用RT-PCR 检测了两种典型症状的甜瓜病样,对于研究寿光以及山东地区甜瓜上病毒的基因结构、流行规律、综合防治对策和抗病育种均具有重要的意义。
1 材料和方法
1.1 材料
2013-2014年在山东省寿光市的甜瓜种植区,采集了具有典型MNSV 和CCYV 症状的甜瓜病叶各10份,保存于-80 ℃;两种病毒的阳性对照由山东农业大学植保学院的竺晓平教授提供。
植物RNA提取试剂盒、第一链cDNA 合成试剂盒、2×Taqmaster mix、PCR产物回收试剂盒等购自北京科百奥生物科技有限公司;pEASY-T1Simple克隆试剂盒购自北京全式金生物技术有限公司。
1.2 病叶总RNA 的提取
分别称取采集的甜瓜病叶及健康叶片0.3~0.5g,利用植物RNA 提取试剂盒提取其总RNA。
1.3 引物的合成
MNSV 及CCYV 外壳蛋白基因保守序列的特异性引物 MNSV-F /MNSV-R[8]和 CCYV-F/CCYV-R[9]由北京华大基因科技有限公司合成。其序列分别为:
MNSV-F:5′-TCTACCTCTGCTAGCGAATC-3′
MNSV-R:5′-GGTGCTACCAGCACCAGA-3′
CCYV-F:5′-CGTAAGTGATCGCAATCAAT-3′
CCYV-R:5′-AGTGATCACTTGACCATCTCC-3′
1.4 cDNA的合成
于1.5mL离心管中,加入2× RT-mix 10μL,模板RNA 3μL,10pmol/L 的反向引物(MNSV-R或CCYV-R)1μL,逆转录酶/RNA 酶抑制剂1μL,ddH2O 5μL,混匀,42 ℃孵育50min后,65 ℃加热10min灭活逆转录酶。
1.5 PCR扩增
于0.2mL离心管中分别加入2×Taqmaster mix 12.5μL,cDNA 1.5μL,正向引物(MNSV-F或CCYV-F)1μL,反向引物(MNSV-R 或CCYV-R)1 μL,ddH2O 补至25μL。
用于检测MNSV 的PCR 反应条件为:94 ℃预变性5min;94 ℃变性1min,55 ℃退火45s,72 ℃延伸1min,30个循环;72 ℃下继续延伸10min。
用于检测CCYV 的PCR 反应条件为94 ℃预变性5min;94 ℃变性30s,58 ℃退火30s,72 ℃延伸1min,30个循环;72 ℃下继续延伸10min。
PCR 产物经1%琼脂糖凝胶电泳检测。
1.6 PCR 产物的回收及克隆
使用PCR 产物回收试剂盒快速回收相应的目的片段,并将其分别与pEASY-T1Simple克隆载体连接,连接产物转入大肠杆菌Trans1-T1 感受态细胞中,经菌液PCR 鉴定的阳性菌落,送到北京华大基因科技有限公司测序。
1.7 序列分析
将测序结果分别在http:∥blast.ncbi.nlm.nih.gov/Blast.cgi与GenBank 中的其他相关基因序列进行相似性比较,并利用DNAstar及MEGA软件分析各分离株的序列同源性及构建亲缘关系的系统发育树。同源性分析所用到的各病毒分离株基因登录号、名称、寄主及其来源地见表1和表2。
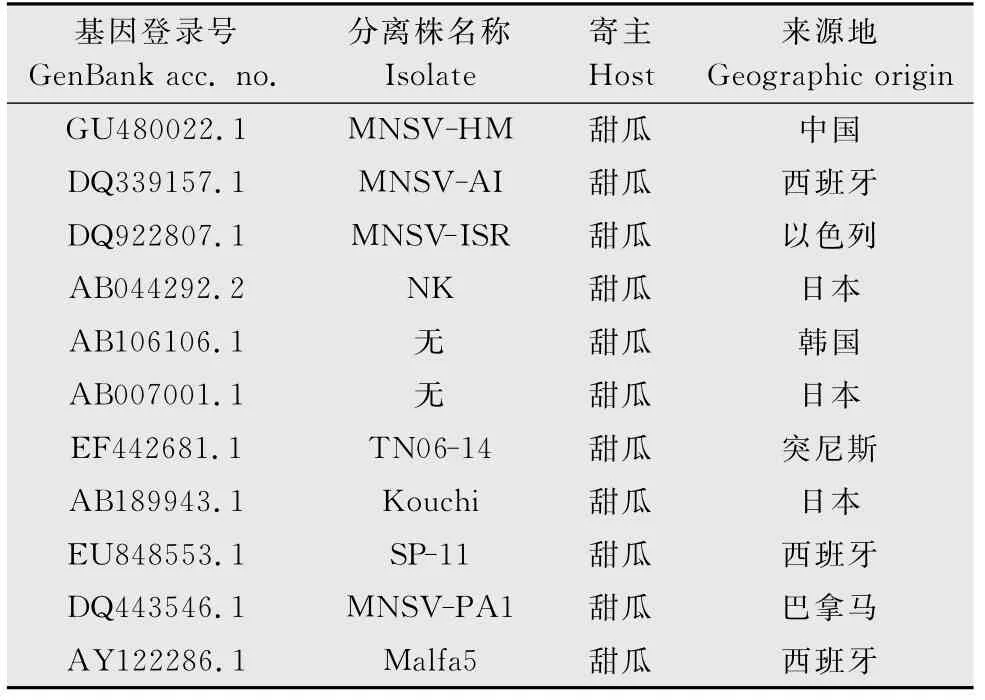
表1 用于MNSV寿光分离物同源性分析的分离株Table 1 The MNSV isolates used for homology analysis with MNSV-Shouguang
2 结果与分析
2.1 病样调查结果
在山东省寿光市的甜瓜产区分别采集到代表性的甜瓜病样,MNSV 的田间症状主要为叶片上产生许多黄色坏死斑点(俗称“米黄点”)(图1a);CCYV的田间症状主要为叶片出现褪绿,但叶脉仍为绿色(图1b)。
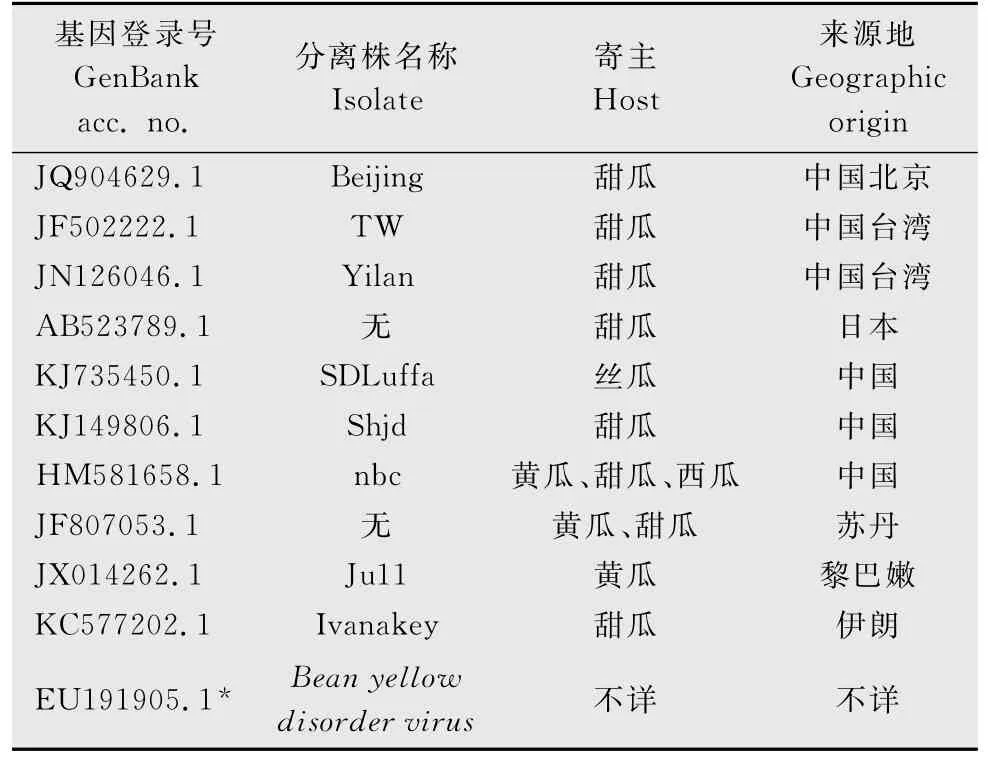
表2 用于CCYV寿光分离物同源性分析的分离株1)Table 2 The CCYV isolates used for homology analysis with CCYV-Shouguang

图1 感染甜瓜坏死斑点病毒和瓜类褪绿黄化病毒后的甜瓜叶片症状Fig.1 The symptoms caused by Melon necrotic spot virus(MNSV)and Cucurbit chlorotic yellows virus(CCYV)
2.2 RT-PCR检测
以采集的甜瓜叶片总RNA 为模板进行RTPCR 扩增,经1%琼脂糖凝胶电泳检测,感病样品的扩增产物大小分别在673bp(MNSV,图2)和877 bp(CCYV,图3),与阳性对照的检测结果一致,而健康植株没有得到任何条带。另外,该法对甜瓜样品的阳性检出率分别为60%(MNSV)和80%(CCYV)。
2.3 MNSV和CCYV寿光分离物部分序列分析
选择2个供试甜瓜的PCR 产物,分别纯化后克隆到pEASY-T1Simple载体,对含有目的片段的重组子进行序列测定,结果表明,MNSV 及CCYV 寿光分离物的扩增产物分别由673 和877 个核苷酸组成。
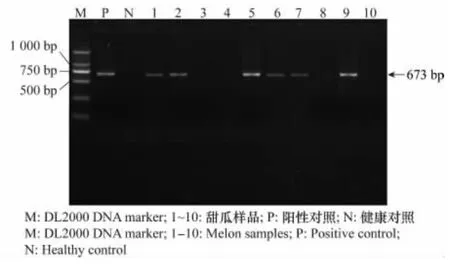
图2 MNSV的RT-PCR检测结果Fig.2 RT-PCR results of MNSV

图3 CCYV的RT-PCR检测结果Fig.3 RT-PCR results of CCYV
将所得的MNSV寿光分离物(MNSV-Shouguang)与其他国家或地区分离物核苷酸序列进行比对分析并构建系统发育树(图4),发现其与中国的MNSVHM 分离物(GU480022.1)同源性最高,达到100%,而与巴拿马(DQ443546.1)、西班牙(EU848553.1和DQ339157.1)、突尼斯(EF442681.1)和以色列(DQ922807.1)的一些MNSV 分离物相似性较高,达到92.2%~93.9%,与日本(AB044292.2、AB189943.1和AB007001.1)、韩国(AB106106.1)及西班牙的Malfa5(AY122286.1)分离物存在着较大的差异,同源性仅为86%~90%,属于不同的分支。
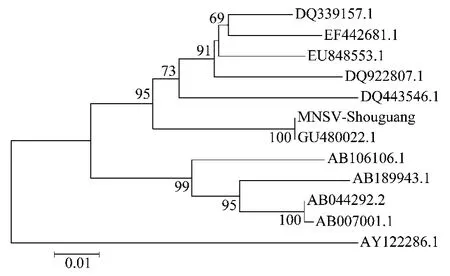
图4 MNSV寿光分离物的核苷酸序列同源性比较Fig.4 Nucleotide sequence alignment between Shouguang isolate and other 11 MNSV isolates previously reported
CCYV 寿光分离物的同源性分析结果(图5)表明,CCYV 寿光分离物(CCYV-Shouguang)的核苷酸序列与寄主同为甜瓜的中国(JQ904629.1 和KJ149806.1)、中国台湾(JF502222.1和JN126046.1)、日本(AB523789.1)的分离物同源性均较高,达到99%,差异较小;而与中国(丝瓜KJ735450.1和西瓜HM581658.1)、苏丹(黄瓜,JF807053.1)和黎巴嫩(黄瓜,JX014262.1)的分离物虽然感染寄主不同,相似性也较高,达到99%左右,可归属为一个大的分支;与伊朗分离物(KC577202.1)核苷酸序列相似性为94.5%,存在一定的差异。
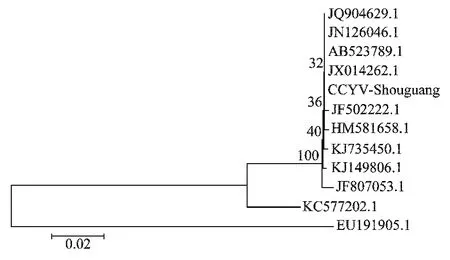
图5 CCYV寿光分离物的核苷酸序列同源性比较Fig.5 Nucleotide sequence alignment between Shouguang isolate and other 11CCYV isolates previously reported
3 讨论
甜瓜坏死斑点病毒病和瓜类褪绿黄化病毒病是近几年在甜瓜上发现的两种比较新的病害。随着甜瓜栽培规模和范围的不断扩大,以及设施园艺的推广利用,这两种病毒病的发生范围越来越广泛,危害程度日趋严重,寻找有效快捷的检测方法十分必要。虽然这两种病毒的生物学特性、病毒结构及传播媒介等各不相同,但在大田,尤其保护地种植条件下,两种病毒往往会交替发生,或者对植株造成复合侵染,故将其放在一起进行调查和研究。为了明确供试甜瓜样品感染的病毒种类,本研究分别对各样品进行了MNSV 和CCYV 的RT-PCR 检测,基本上排除了两种病毒复合侵染的情况;但在实际生产中复合侵染的现象不容忽视,这也是下一步研究需要关注的问题。
MNSV 和CCYV 寿光分离物的同源性分析结果表明,其与Gu等[3-4]报道的中国其他地区的病毒分离物相似性达99%以上,可以推测分别为同一种病毒;MNSV寿光分离物与日本、韩国及西班牙Mal-fa5分离物的同源性较小,存在着较大的差异,该结论与温少华[8]的研究结果一致;CCYV 虽然能够侵染不同的葫芦科作物,但包括寿光分离物在内的各分离物并没有出现基因变异,表现出良好的同源性,整个系统发育树显示CCYV 寿光分离物与各地分离物的亲缘关系较近,并未受地缘关系的太大影响。
由MNSV 引起的叶片黄色坏死斑点类似于细菌性角斑病的浅黄色斑点,而CCYV 引起的叶片褪绿黄化症状与植株缺素症状非常相似,在生产上很容易造成误诊误治,如不及时重点防治,必定造成严重的经济损失。刘珊珊等[9]、Gu等[3]通过RT-PCR对河南省和湖南省瓜类褪绿黄化病毒进行了分子鉴定,温少华[8]也对MNSV 中国分离物进行了鉴定和序列分析。本研究中甜瓜样品的PCR 检测结果,基本与外观表现的感病症状一致,但也发现了疑似感病并未显示阳性的情况,或许是采样时的诊断失误或样品中病毒含量较低造成的,这在田间病样的大量检测中很难避免。因此,建立高效快速的RT-PCR检测体系,能有效地监测与控制病毒病的发生及蔓延,为建立早期病毒防控预警技术提供技术支持。
[1]Tomassoli L,Barba M.Occurrence ofMelonnecroticspotcarmovirusin Italy[J].EPPO Bulletin,2000,30(2):279-280.
[2]Yakoubi S,Desbiez C,Fakhfakh H,et al.First report ofMelon necroticspotviruson melon in Tunisia [J].Plant Pathology,2008,57(2):386.
[3]Gu Q S,Liu Y H,Wang Y H,et al.First report ofCucurbit chloroticyellowsvirusin cucumber,melon,and watermelon in China[J].Plant Disease,2011,95(1):73.
[4]Gu Q S,Bao W H,Tian Y P,et al.Melonnecroticspotvirusnewly reported in China[J].Plant Pathology,2008,57(4):765.
[5]Huang L H,Tseng H H,Li J T,et al.First report ofCucurbitchloroticyellowsvirusinfecting cucurbits in Taiwan[J].Plant Disease,2010,94(9):1168.
[6]古勤生,吴会杰,彭斌,等.瓜类新病毒病害(二):甜瓜坏死斑点病[J].中国瓜菜,2011,24(5):35-36.
[7]古勤生,彭斌,刘珊珊,等.瓜类新病毒病害(一):瓜类褪绿黄化病[J].中国瓜菜,2011,24(3):32-33.
[8]温少华.甜瓜坏死斑点病毒MNSV 中国分离物全基因组序列的克隆和分析[D].武汉:华中农业大学,2009.
[9]刘珊珊,彭斌,吴会杰,等,海南省和河南省发生甜瓜褪绿黄化病的分子鉴定[J].果树学报,2013,30(2):291-293.
[10]李淑菊,王惠哲,霍振荣,等.利用RT-PCR 对黄瓜病毒病毒原种类进行检测[J].华北农学报,2004,19(3):100-102.

