基于环介导等温扩增技术检测瓜类细菌性果斑病菌
赵玉强,田艳丽,罗金燕,姚红梅,余 慧,陈 磊,胡白石*
(1.上海市农业技术推广服务中心,上海 201103;2.南京农业大学植物保护学院,农作物生物灾害综合治理教育部重点实验室,南京 210095)
瓜类细菌性果斑病(bacterial fruit blotch,BFB)是西甜瓜等葫芦科作物上重要的细菌病害,由西瓜嗜酸菌(Acidovoraxcitrulli)引起[1-2]。该病为典型的种传病害,其病原菌可侵染叶片、果实和种子,严重影响果实的品质和产量,对瓜类生产及相关产业构成了极大的威胁[3]。瓜类细菌性果斑病自20世纪90 年代在我国首次报道以来,在新疆、海南、内蒙古、宁夏、北京、河北、山东、吉林、福建、湖南等地相继发生,并呈上升趋势,造成大田西瓜和甜瓜减产甚至绝收,给西甜瓜生产带来巨大损失[4-9]。在病害发病初期快速、准确鉴定出BFB,及时实施有效的药剂防控措施,对防治该病害的扩散和蔓延尤为重要。因此,建立西瓜嗜酸菌的快速、准确、便捷的检测技术是防止该病害发生的重要举措。
目前检测西瓜嗜酸菌的主要方法有:传统的细菌学分离方法[10]、Biolog鉴定方法[11]、血清学检测方法[12]和分子生物学方法[13-16],但这些诊断方法存在诊断过程繁琐、周期长、成本高、灵敏度不高或特异性不强等特点,同时还需要昂贵的仪器和试剂等。2000年Notomi等人[17]报道了一种新型核酸扩增技术—环介导等温扩增法(loop-mediated isothermal amplification,LAMP),该方法根据目的基因及其特点,针对靶序列的6个特异性区域设计两对引物,利用一种具有链置换活性的DNA 聚合酶(BstDNA polymerase),在等温条件下(60~65 ℃)保温30~60min,即可实现核酸的大量扩增,并且伴有肉眼可见的副产物白色焦磷酸酶沉淀产生[17]。该检测方法具有特异性好、灵敏度高、反应时间短、操作方便和不需要昂贵的仪器等优点,目前已被广泛应用于病毒、细菌、原生动物和真菌等领域的检测中[18-21]。
本试验根据A.citrulli基因组中Aave_4063和Aave_4064序列的特点,基于LAMP技术建立了瓜类细菌性果斑病菌的快速恒温扩增检测体系,并将其应用于市售的瓜种子实际样品检测中。
1 材料与方法
1.1 材料
BstDNA 聚合酶购自New England Biolabs(NEB)公司;甜菜碱、MgSO4、钙黄绿素(calcein)购自Sigma公司;dNTPs、DL100marker等购自宝生物工程(大连)有限公司;Loopamp 反应管购自日本荣研化学株式会社;移液管购自AXYGEN 公司;电热恒温水浴锅(DK-8D)购自上海森信实验仪器有限公司;细菌基因组DNA 提取试剂盒(天根细菌基因组DNA 小量制备试剂盒)购自天根(北京)公司。供试菌株寄主、来源及数量见2.2小节。
1.2 引物设计
根据Aave_4063和Aave_4064序列,应用Bioedit软件进行序列分析,并使用PrimerExplore v 4软件,依据LAMP引物的设计原则,设计LAMP引物。探针由宝生物工程(大连)有限公司合成,用ddH2O 溶解后分装,-20 ℃冰箱保存备用。
1.3 LAMP反应体系的建立
LAMP检测反应体系为25μL,包括2.5μL 10×ThermoPol[200mmol/L Tris-HCl,100 mmol/L KCl,100mmol/L(NH4)2SO4,2 mmol/L MgSO4,0.1% Trition X-100,pH 8.8]、8mmol/L MgSO4、0.8 mol/L 甜菜碱、500μmol/L each dNTP、0.4 μmol/L外引物Ac-F3 和Ac-B3、1.6μmol/L 的内引物Ac-FIP 和Ac-BIP、1μLBstDNA 聚合酶(8 U/μL)、1μL 0.02 mmol/L 钙黄绿素染料,1μL DNA 模板或菌悬液,加ddH2O 补至25μL。将反应管置于水浴锅65 ℃恒温反应60min,然后80 ℃加热5min使酶失活终止反应。
1.4 LAMP扩增产物判断方法
LAMP扩增产物可通过肉眼观察浑浊度的变化来判断,也可通过加入荧光染料观察颜色变化来判断。本试验在反应前加入1μL 0.02mmol/L 的钙黄绿素染料,产生扩增的反应管颜色由橙色变为亮绿色,未产生扩增的则仍保持橙色不变,阴性对照也为橙色。
1.5 LAMP特异性检测
按照天根细菌基因组DNA 小量制备试剂盒说明书,分别提取供试菌株的基因组DNA,进行LAMP扩增,鉴定LAMP反应的特异性。
1.6 LAMP灵敏度检测
果斑病菌菌株xjl12的基因组DNA模板经测定浓度后,按10倍梯度稀释为2.0×106~2.0×100cfu/mL。分别取1μL作为LAMP反应模板,每个梯度3个重复。反应结束后,鉴别是否发生了LAMP扩增,确定LAMP的灵敏度,并与常规PCR[22]的灵敏度进行比较。
1.7 实际样品检测
选取6种市售种子进行检测。每份种子取300粒,剖开后,加50mL 无菌水室温浸泡4h,将浸出液6 000r/min离心3min,弃上清。加入2mL 无菌水重新悬浮沉淀,取0.5 mL 悬浮液用于分离培养,剩余的1.5mL悬浮液利用天根细菌DNA 提取试剂盒提取DNA,取1μL DNA 作为LAMP 检测的模板。
在进行实际样品检测时,所有的样品均利用果斑病菌半选择性培养基TWZ(0.5% 蛋白胨,0.025%CaCl2,1%吐温-80,50 mg/L 小檗碱,50 mg/L放线菌酮,50mg/L TTC)进行分离培养,培养条件为28 ℃,24~48h,用以验证LAMP检测结果的可靠性。
2 结果与分析
2.1 LAMP检测的特异性引物
本试验所选取的靶标基因为Aave_4063和Aave_4064,基因序列信息均来自于GenBank(登录号为NC_008752:4516230~4516461)。笔者将缺失的Aave_4063和Aave_4064 基因中的一段(区域:4516230-4516461)核酸序列在NCBI 中进行BLASTn 和tBLASTx 搜索,结果发现没有任何已知序列与其相同。本研究根据Aave_4063和Aave_4064基因序列设计了1 套果斑病菌LAMP检测的特异性引物(表1)。其中Ac-F3/Ac-B3为外引物,Ac-FIP/Ac-BIP为内引物。
2.2 LAMP检测方法的特异性
以本研究设计的特异性引物对果斑病菌进行LAMP扩增,以水作为阴性对照,并用其他嗜酸菌属菌悬液作为病原菌对照检测LAMP 反应的特异性。结果如图1所示,果斑病菌反应管呈亮绿色,为阳性,其他嗜酸菌和阴性对照均为黄绿色,为阴性。同样的,利用本试验所建立的LAMP 体系,其他参试菌株也均为阴性(表2)。
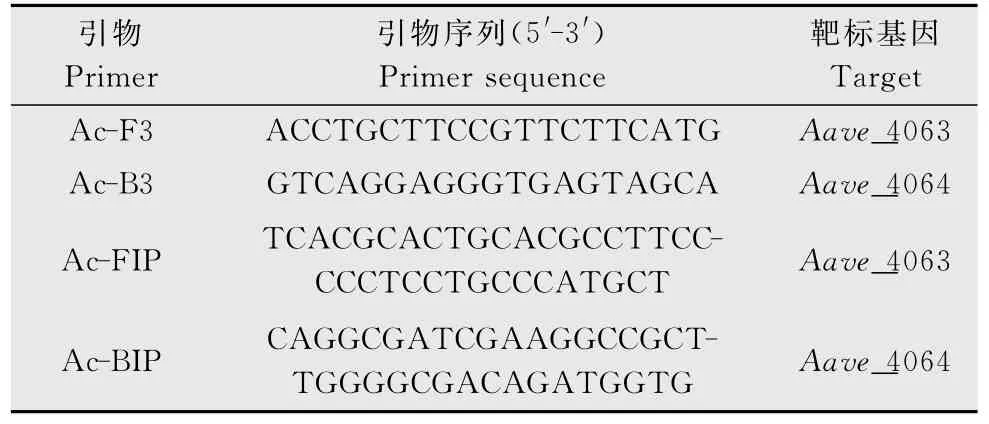
表1 LAMP引物序列Table 1 The primers used for loop-mediated isothermal amplification

图1 LAMP反应的特异性Fig.1 Specificity of LAMP detection
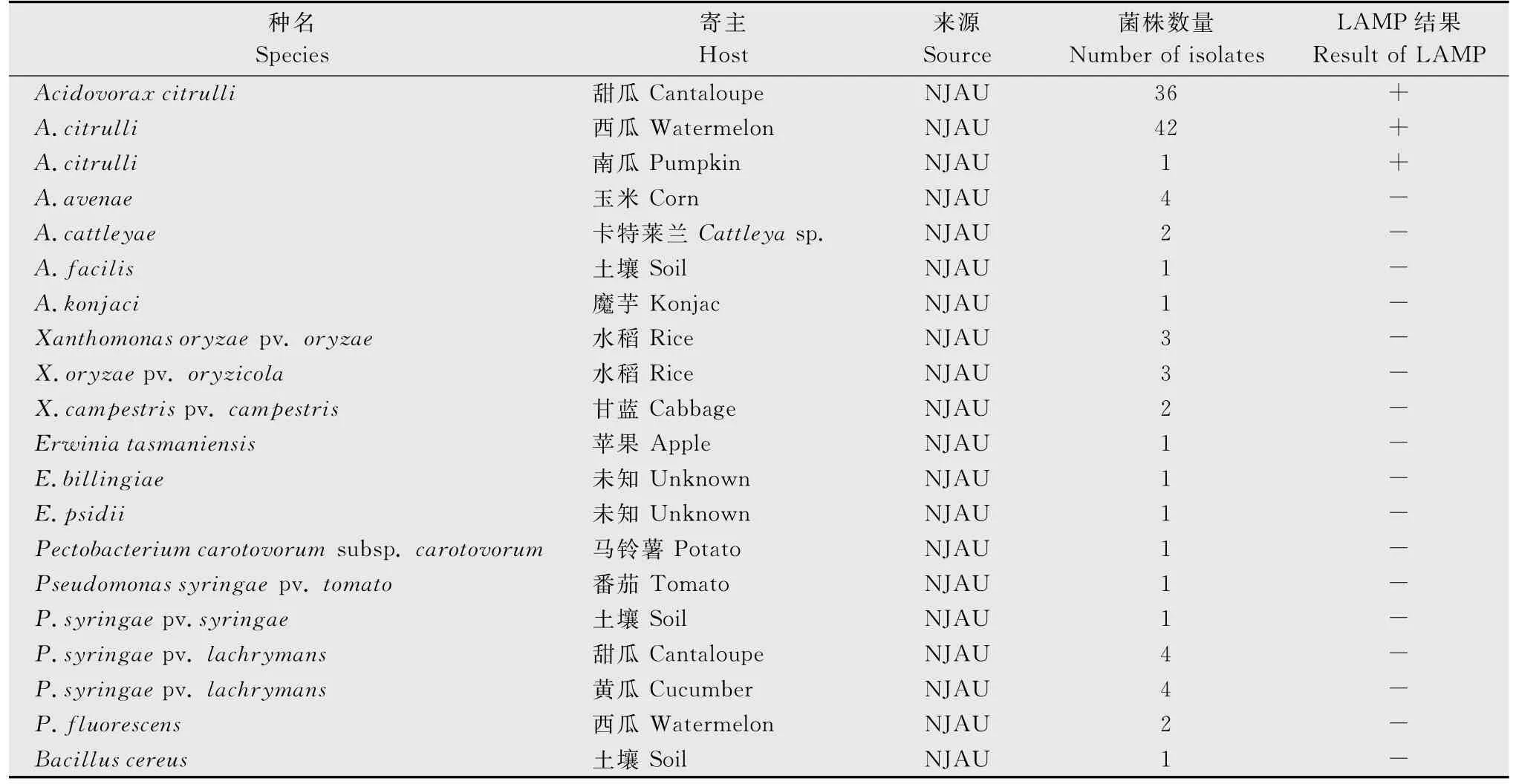
表2 供试细菌菌株LAMP结果1)Table 2 LAMP results of tested strains
2.3 LAMP检测方法的灵敏度
将10倍梯度稀释的果斑病菌悬液进行LAMP扩增。结果如图2~3所示,检测结果的最低检测灵敏度为2.0×101cfu/mL,比常规PCR检测方法高100倍。
2.4 实际样品检测结果
利用本试验建立的瓜类细菌性果斑病菌LAMP检测体系,对市售的西、甜瓜种子进行了检测。结果如图4 所示:1~5 反应管呈亮绿色,为阳性,6~7反应管呈现黄绿色,为阴性,且所有LAMP检测结果与半选择性培养基结果一致(结果未列出)。结果表明本研究所建立的检测方法可用于实际样品的检测。

图2 LAMP反应的灵敏度Fig.2 Sensitivity of LAMP method using serially diluted Acidovorax citrulli as template

图3 常规PCR 检测的灵敏度Fig.3 Sensitivity of conventional PCR using serially diluted Acidovorax citrulli as template

图4 利用LAMP体系从西、甜瓜种子中检测西瓜嗜酸菌Fig.4 Detection of Acidovorax citrulli in cantaloupe and watermelon seed samples using LAMP
3 讨论
西瓜嗜酸菌引起的瓜类细菌性果斑病为种传病害,种子带菌是其发生的主要原因[23]。近期研究表明,在温室育苗的条件下,单粒种子仅携带10cfu的西瓜嗜酸菌就可以导致瓜类细菌性果斑病的大面积发生和流行[24]。至今对该病害还没有有效的防治措施,加强检疫,控制其传播扩散是预防此病害最有效的措施。目前,WFB1/WFB2是西瓜嗜酸菌PCR检测常用的引物之一,由于西瓜嗜酸菌与燕麦嗜酸菌(A.avenae,GenBank:NC_015138)亲缘关系非常接近,所以常常导致检测引物无法区分这两个种[22]。而本试验通过生物信息学分析选取的靶标基因为Aave_4063和Aave_4064,将Aave_4064序列在NCBI中进行BLASTn和tBLASTx比对,结果没有任何已知序列与其相同,在燕麦嗜酸菌基因组中也未发现其同源序列,从而保证了检测的特异性。利用本文建立基于LAMP 的西瓜嗜酸菌检测体系,对不同寄主上分离到的西瓜嗜酸菌菌株和其他17个参试菌株进行检测,结果表明,该体系能特异地扩增出西瓜嗜酸菌,能有效区分开与其亲缘关系较近的菌株,例如燕麦嗜酸菌(A.avenae)、卡特莱兰嗜酸菌(A.cattleyae)、敏捷嗜酸菌(A.facilis)、魔芋嗜酸菌(A.konjaci)及假单胞菌属(Pseudomonas)细菌。证明本研究所设计的LAMP 检测引物种内保守、种间特异。在灵敏度试验中,常规PCR 的检测灵敏度为2.0×103cfu/mL,而该体系的最低检测灵敏度为2.0×101cfu/mL,比常规PCR的灵敏度高出100倍。
本研究建立的LAMP 检测体系在等温条件下(65 ℃)就能进行扩增反应,同时反应时间短,仅需1h,不需要热循环仪,一个普通水浴锅就可进行,这是常规的PCR 检测不能达到的。在结果判定时,本研究采用加入荧光染料钙黄绿素,产生扩增的反应管颜色由橙色变为亮绿色,未产生扩增的则保持橙色不变,该方法既提高了对检测结果的肉眼识别率,又可直接用于瓜类细菌性果斑病的现场诊断,大大提高了检测效率。在利用本研究建立的LAMP检测体系从瓜种子中检测西瓜嗜酸菌时,包括种子处理的时间在内,共需8h。一般来说,利用半选择性培养基进行病原菌分离和幼苗生长测定法是西、甜瓜种子带菌检测的常用方法,一般需要3~8d。所以本研究建立的检测体系与常规方法相比省时、省力、省钱。
LAMP技术在实际应用中表现出特异性强、灵敏度高、速度快、操作方便等特点,为检疫性有害生物检测提供了有力的技术支持,对早期检疫性有害生物准确诊断具有重要意义。本研究首次建立了对西瓜嗜酸菌检测的可视化LAMP方法,该方法简单易行,对仪器设备和检测人员的技能要求不是十分苛刻,其特异性、灵敏度及快速检测方面均能够满足口岸检疫和农业生产单位对检疫性有害生物的快速诊断需要,可推广应用于西、甜瓜种苗的健康检测中。
[1]Schaad N W,Postnikova E,Sechler A,et al.Reclassification of subspecies ofAcidovoraxavenaeasA.avenae(Manns 1905)emend.,A.cattleyae(Pavarino,1911)comb.nov.,A.citrulli(Schaad et al.,1978)comb.nov.,and proposal ofA.oryzaesp.nov.[J].Systematic and Applied Microbiology,2008,31(6-8):434-446.
[2]Willems A,Goor M,Thielemans S,et al.Transfer of several phytopathogenicPseudomonasspecies toAcidovoraxasAcidovoraxavenaesubsp.avenaesubsp.nov.,comb.nov.,Acidovoraxavenaesubsp.citrulli,Acidovoraxavenaesubsp.cattleyae,andAcidovoraxkonjaci[J].International Journal of Systematic Bacteriology,1992,42(1):107-119.
[3]Walcott R R,Gitaitis R D,Castro A C.Role of blossoms in watermelon seed infestation byAcidovoraxavenaesubsp.citrulli[J].Phytopathology,2003,93(5):528-534.
[4]蔡学清,黄月英,杨建珍,等.福建省西瓜细菌性果斑病的病原鉴定[J].福建农林大学学报,2005,34(4):434-437.
[5]薛莉,杨成德,陈秀蓉,等.甘肃省西瓜细菌性果斑病的诊断[J].植物保护,2009,35(2):53-57.
[6]任小平,李小妮,王琳,等.广东西瓜果斑病的病原鉴定[J].华南农业大学学报,2010,31(4):40-43.
[7]胡俊,黄俊霞,刘双平,等.内蒙古哈密瓜细菌性果斑病的发生特点与防治技术[J].中国植保导刊,2006,26(12):19-20.
[8]赵廷昌,赵洪海,王怀松.山东省西瓜、甜瓜发生瓜类细菌性果斑病[J].植物保护,2009,35(5):170-171.
[9]金岩,张俊杰,吴燕华,等.西瓜细菌性果斑病的发生与病原菌鉴定[J].吉林农业大学学报,2004,26(3):263-266.
[10]赵廷昌,孙福在,王冰万,等.哈密瓜细菌性果斑病病原菌鉴定[J].植物病理学报,2001,31(4):357-364.
[11]许志刚,李斌,胡白石.我国甜瓜和西瓜上一种新细菌病害的病原及寄主范围测定[C]∥2003华东植物病理学术研讨会暨江苏省植物病理学会第十次会员代表大会论文集,2003:86-90.
[12]回文广,赵廷昌,孙福在,等.哈密瓜果斑病菌血清学快速检测[C]∥中国植物病理学会2004年学术年会论文集,2004:172.
[13]Ha Y,Fessehaie A,Ling K S,et al.Simultaneous detection ofAcidovoraxavenaesubsp.citrulliandDidymellabryoniaein cucurbit seedlots using magnetic capture hybridization and realtime polymerase chain reaction[J].Phytopathology,2009,99(6):666-678.
[14]Schaad N W,Song W Y,Hatziloukas E.PCR primers for detection of plant pathogenic species and subspecies ofAcidovorax:US,6146834[P/OL].2000-11-14.http://patft.uspto.gov/netacgi/nph-Parser?Sect2=PTO1&Sect2=HITOFF&p=1&u=/netahtml/PTO/search-bool.html&r =1&f=G&l=50&d =PALL&RefSrch=yes&Query=PN/6146834.
[15]Bahar O,Efrat M,Hadar E,et al.New subspecies-specific polymerase chain reaction-based assay for the detection ofAcidovoraxavenaesubsp.citrulli[J].Plant Pathology,2008,57(4):754-763.
[16]Tian Yanli,Zhao Yuqiang,Bai Sa,et al.Reliable and sensitive detection ofAcidovoraxcitrulliin cucurbit seed using apadlock probe-based assay[J].Plant Disease,2013,97(7):961-966.
[17]Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Research,2000,28(12):e63.
[18]Endo S,Komori T,Ricci G,et al.Detection ofgp43ofParacoccidioidesbrasiliensisby the loop-mediated isothermal amplification(LAMP)method[J].FEMS Microbiology Letters,2004,234(1):93-97.
[19]Okafuji T,Yoshida N,Fujino M,et al.Rapid diagnostic method for detection of mumps virus genome by loop-mediated isothermal amplification[J].Journal of Clinical Microbiology,2005,43(4):1625-1631.
[20]Dai Tingting,Lu Chenchen,Lu Jing,et al.Development of a loop-mediated isothermal amplification assay for detection ofPhytophthorasojae[J].FEMS Microbiology Letters,2012,334(1):27-34.
[21]戴婷婷,陆辰晨,沈浩,等.基于环介导等温扩增技术检测橡树疫霉菌[J].南京农业大学学报,2013,36(3):23-28.
[22]Walcott R R,Langston D B,Sanders F H J,et al.Investigating intraspecific variation ofAcidovoraxavenaesubsp.citrulliusing DNA fingerprinting and whole cell fatty acid analysis[J].Phytopathology,2000,90(2):191-196.
[23]Hopkins D L,Thompson C M.Seed transmission ofAcidovoraxavenaesubsp.citrulliin cucurbits[J].Hortscience,2002,37(6):924-926.
[24]Dutta B,Scherm H,Gitaitis R D,et al.Acidovoraxcitrulliseed inoculum load affects seedling transmission and spread of bacterial fruit blotch of watermelon under greenhouse conditions[J].Plant Disease,2012,96(5):705-711.

