芝麻茎点枯病菌两种细胞壁降解酶活性分析
高树广,赵 辉,李伟峰,王瑞霞,倪云霞,杨修身,刘红彦*,杨光宇
(1.河南省农业科学院植物保护研究所,郑州 450002;2.河南省周口市农业科学院,周口 466001)
芝麻茎点枯病是危害芝麻最严重的真菌病害之一,该病害破坏性强,每年造成的损失高达30%以上。引起芝麻茎点枯病的病原菌菜豆壳球孢[Macrophominaphaseolina(Tassi)Goid][1],在世界范围内能侵染500多种植物,具有土传和种传的特性,其菌核能在土壤或病残体上存活4年以上[2]。
植物细胞壁是防止病原真菌侵入的屏障,也是寄主与病菌互作的重要场所[3],植物细胞壁主要由多糖(如纤维素、半纤维素和果胶)、蛋白质和木质素等构成[4]。在长期的进化过程中,植物病原真菌能产生可降解植物细胞壁成分的胞外酶,这些酶通过消化植物细胞壁聚合物为病菌生长提供营养物质,辅助其在寄主组织中定殖和扩散[5]。漆酶是一种含铜的多酚氧化酶,不但可降解木质素[6],而且可促进纤维素和果胶等细胞壁成分的降解。研究表明,漆酶是许多病原真菌致病的毒力因子,例如,漆酶与板栗疫病菌的致病力[7]、根瘤菌的抗逆性和致病性密切相关[8],在新生隐球菌的致病过程中起重要作用[9]。Islam 等对M.phaseolina基因组测序分析表明,其木质素降解酶系统包括漆酶、木质素过氧化物酶、半乳糖氧化酶、氯过氧化物酶、卤过氧化物酶、血红素过氧化物酶[10]。另一种细胞壁降解酶,聚甲基半乳糖醛酸酶(PMG)能作用于α-1,4键,使果胶中的聚半乳糖醛酸水解,释放出单体的半乳糖醛酸,进而促使细胞的裂解。冯晶等[11]的研究结果表明,玉米弯孢霉叶斑病菌能按照一定的顺序产生一系列细胞壁降解酶。陈夕军等[12]认为水稻纹枯病菌(Rhizoctoniaso-laniKühn)的细胞壁降解酶在水稻纹枯病的暴发过程中起着重要作用,陈兵等[13]认为果胶酶与水稻纹枯病菌的致病性关系密切。目前,关于芝麻茎点枯病菌产生的细胞壁降解酶种类及活性分析鲜有报道[14-18]。本研究测定了芝麻茎点枯病菌漆酶(Lac)和聚甲基半乳糖醛酸酶(PMG)活性,分析比较了其变化规律,旨在为芝麻茎点枯病菌致病机理研究奠定基础。
1 材料与方法
1.1 供试菌株
芝麻茎点枯病菌共9株,分别于2009-2010年采集于河南、江西和安徽省,由河南省农业科学院植物保护研究所生防室分离保存(表1)。
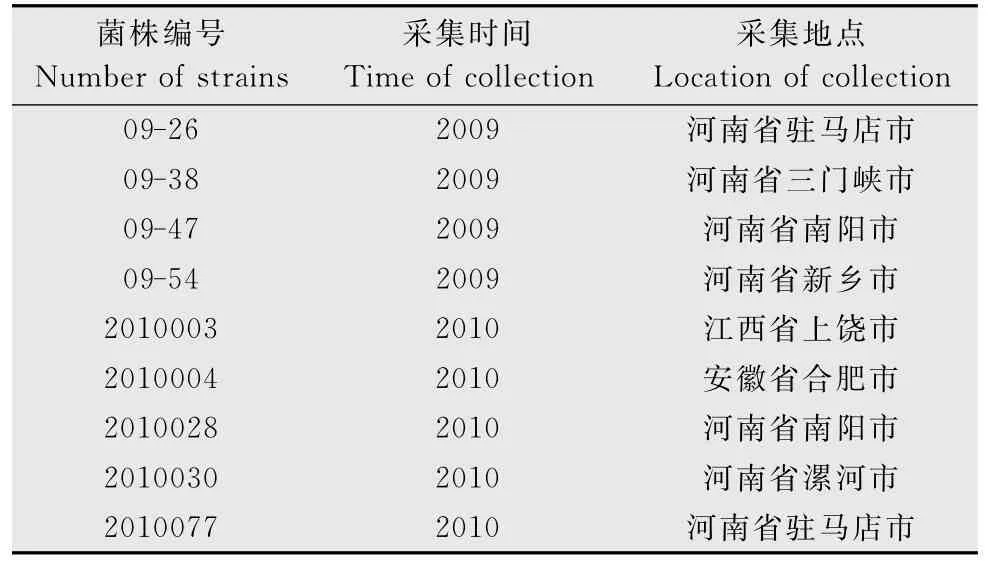
表1 供试菌株Table 1 The tested strains
1.2 方法
1.2.1 菌株培养
将-20 ℃保存的9 株芝麻茎点枯病菌接种在PDA 培养基上,30 ℃黑暗培养2d,再转接至新鲜PDA 培养基上30 ℃黑暗培养4d,备用。
1.2.2 芝麻茎点枯病菌漆酶活性
1.2.2.1 漆酶活性检测
在培养4d的菌落平板上打取菌饼(d=6mm),将菌饼分别接种到含0.03% ABTS[2,2-联氮-双(3-乙基苯并噻唑-6-磺酸)二铵盐]和3g/L KNO3的PDA培养基平板中间、含0.01% 苯胺蓝(azure-B)的BM 培养基(酵母膏10g,葡萄糖20g,琼脂粉18g,水1 000mL)平板中间[19],以菌饼接种在PDA培养基平板中间为空白对照,30℃黑暗培养3d。每天观察培养基颜色变化情况,每个处理3次重复。
1.2.2.2 芝麻茎点枯病菌漆酶活性测定
将培养4d的产漆酶菌株菌饼接种到含有20mL Fries培养基(蔗糖30g,酒石酸钾钠7.7g,酵母提取物0.5g,NH4NO31g,KH2PO41g,MgSO40.5g,NH4Cl 2.9g,CaCl20.1g,CuSO4·5H2O 0.625g,蒸馏水定容至1 000 mL,pH 4.0)的50 mL 三角瓶中,30 ℃黑暗静置培养10d。培养物10 000r/min离心10 min,上清液用于胞外酶活力测定。菌丝用0.1mol/L Tris-HCl(pH 4.0)缓冲液冲洗2次后,加1mLTris-HCl重悬菌丝,-20 ℃冰冻过夜。在冰上迅速将冰冻的菌丝研磨成匀浆后转移至10mL离心管中,再用1mL Tris-HCl缓冲液冲洗研钵,洗液转入同一离心管,4℃10 000r/min离心10min,吸出上清液,即为粗酶液,用于胞内酶活力测定。漆酶活力测定参照曹志艳等[18]的方法。在420nm 波长下,连续测定前5min内吸光值的变化,按下式计算漆酶活力。漆酶活力单位定义为1min内,1mL酶液的吸光值变化0.01个单位所需酶量为1个酶活力单位(U)。胞内酶和胞外酶粗酶液制备与测定均3次重复,取平均值。

式中At1表示反应起始时的吸光度,At2表示反应终止时的吸光度,t1表示反应起始时的时间,t2表示反应终止时的时间。
1.2.3 芝麻茎点枯病菌聚甲基半乳糖醛酸酶活性
1.2.3.1 葡萄糖标准曲线的制作
称取50mg葡萄糖,溶解在50mmol/L HAc-NaAc(pH 5.0)缓冲液中,定容至25mL,配制成2mg/mL葡萄糖母液。分别量取葡萄糖母液0.1、0.2、0.4、0.6、0.8、1.0mL于10mL离心管中,加50mmol/L HAc-NaAc补至1.0mL,配制成浓度梯度为0.2、0.4、0.8、1.2、1.6、2.0mg/mL的标准溶液,然后每管分别加入DNS(3,5-二硝基水杨酸)2.0 mL,于沸水浴中加热2min进行显色,取出后于冰浴中迅速冷却,各加入HAc-NaAc缓冲液2mL,振荡混匀,在540nm 处测定光吸收值。以1mL HAc-NaAc缓冲液替代替葡萄糖按同样方法显色作为空白对照,以葡萄糖含量为横坐标(x),吸光度为纵坐标(y),绘制标准曲线[20]。
1.2.3.2 聚甲基半乳糖醛酸酶提取与活性测定
聚甲基半乳糖醛酸酶提取与活性测定参照薛莲等[21]的方法,采用DNS比色法测定PMG 活性。参照病程曲线下面积(AUDPC)方法计算酶活发展曲线下面积(the area under enzyme activity progress curve,AUEAPC,简称A值),以每个菌株的A值表示其综合活性大小,按如下公式计算A值[22-24]:
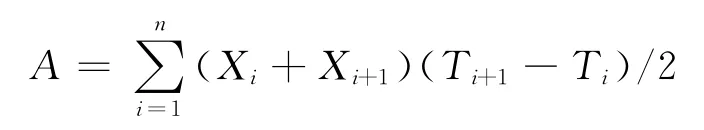
式中i为酶活测定次数,n为总测定次数,X为酶活,T为测定时间。
2 结果与分析
2.1 芝麻茎点枯病菌漆酶活性
2.1.1 病原菌产漆酶活性检测
对芝麻茎点枯病菌在含ABTS的PDA平板、含苯胺蓝(azure-B)的BM 平板和对照PDA平板上的生长状况(图1)的观察表明,在对照PDA培养基上的9个菌株菌落形态没有明显差异,菌落呈圆形向外扩展,气生菌丝发达,菌落生长迅速,呈放射状,最初白色、后变为灰色,培养36h左右,在平盘中央形成直径2cm左右的黑色菌核区域,菌核呈密集的点状分布,并快速蔓延,由菌核产生的色素把整个平板染成亮黑色,培养50h左右菌丝长满整个平板;在含有ABTS的PDA培养基上生长时,菌落变成了紫红色。说明9株茎点枯病菌分泌的漆酶氧化了培养基中的ABTS,并且随着培养时间的延长,9株菌的显色直径不断增大,颜色也不断加深;9个菌株对培养基上的苯胺蓝也具有不同程度的脱色作用,说明芝麻茎点枯病菌不仅能够产生漆酶,而且都具有不同程度的降解木质素的能力。09-47由于气生菌丝比较发达,浓密的灰白色气生菌丝掩盖了其下的颜色变化。

图1 平板显色反应法检测芝麻茎点枯病菌漆酶活力Fig.1 Laccase activity in Macrophomina phaseolina determined by plate color reaction
2.1.2 漆酶活性测定
细胞内和细胞外漆酶活性测定结果表明,9株芝麻茎点枯病菌胞内、胞外均有漆酶活性。菌株09-54和2010030胞内漆酶活性低于胞外漆酶活性,其余7株菌胞内漆酶活性均明显高于胞外漆酶活性(表2)。9个菌株中,2010003的胞外酶活力最高,为14.12U/mL;2010028胞内漆酶活性最高,为71.89U/mL,约是其胞外酶活力的13倍。漆酶只有分泌到细胞外才能与作物木质素接触,因此,胞外酶活性的大小与病原菌致病力的大小密切相关,推测菌株2010003侵染芝麻时降解木质素能力最强。
2.2 聚甲基半乳糖醛酸酶活性测定
试验得出葡萄糖标准曲线为x=(y+0.100 2)/0.724 2(r2=0.999 2),根据标准曲线计算PMG 酶活。芝麻茎点枯病菌在活体外均能产生可降解果胶的细胞壁降解酶PMG(图2),在10d内对9株病原菌进行5 次酶活性测定均能检测到PMG 活性,表明在培养过程中病原菌可持续产生果胶酶。菌株2010028、2010077第2天酶活最高;09-54第6天酶活最高;09-26、09-38、2010003、2010004、2010030第8天酶活最高;09-47第10天酶活最高。以AUEAPC为评价指标进行比较(表3),菌株2010003A值最高,极显著地高于其他菌株,菌株09-26的A值最低。A值在一定程度上反映了不同菌株PMG综合活性的大小,也反映了不同菌株降解果胶能力的强弱,进一步推测菌株2010003降解果胶能力最强。

表2 芝麻茎点枯病菌胞内酶、胞外酶差异显著性分析1)Table 2 Analysis of the significant differences of endoenzymes and extracellular enzymes in Macrophomina phaseolina

图2 不同芝麻茎点枯病菌菌株聚甲基半乳糖醛酸酶活性Fig.2 PMG activity comparison between Macrophomina phaseolina strains

表3 不同芝麻茎点枯病菌菌株聚甲基半乳糖醛酸酶的AUEAPCTable 3 The PMG AUEAPC value of Macrophomina phaseolina strains
3 讨论
研究表明9株M.phaseolina菌株均能检测到漆酶活性和PMG 活性,推测这两种酶可能在茎点枯病菌致病过程中起重要作用。M.phaseolina不同菌株之间漆酶活性存在明显差异,并且同一菌株其胞内和胞外的酶活力差异也比较明显。真菌中的漆酶常以同工酶的形式存在[25]。研究中所用培养基组成和培养条件一致,所以9株病原菌产漆酶的水平取决于菌株本身的生长特征和代谢状况,可能其胞内酶与胞外酶的结构不同,因此在致病过程中所起作用也不同。芝麻茎点枯病菌产生果胶降解酶PMG 机制复杂,不但受果胶的诱导,而且还与其上游一系列基因的表达量、调控序列及环境因子等因素有关。只有细胞壁降解酶在寄主体内积累到一定量才会有致病作用,PMG 活性高峰在不同菌株中出现的时间不同,可能会影响病菌侵入寄主的时间。M.phaseolina对芝麻的致病过程是一个复杂的过程,除能产生PMG 和漆酶之外,还会产生其他胞壁降解酶,例如纤维素降解酶,另外还有毒素和激素等致病因子的存在。本研究证实了M.phaseolina能产生漆酶和PMG,菌株2010003胞外漆酶活性以及PMG 的A值均最高。为进一步研究其在寄主活体内的酶活和致病机制奠定了基础。
[1]Singleton L L,Mihail J D,Rush C M.Methods for research on soilborne phytopathogenic fungi[M].St.Paul:American Phytopathological Society Press,1992:134-136.
[2]Short G E,Wyllie T D,Bristow P R.Survival ofMacrophomina phaseolinain soil and residue of soybeans[J].Phytopathology,1980,70:13-17.
[3]Beckman C H.The nature of wilt diseases of plants[M].St.Paul:American Phytopathological Society Press,1987:175.
[4]Aro N,Pakula T,Penttil M.Transcriptional regulation of plant cell wall degradation by filamentous fungi[J].FEMS Microbiology Reviews,2005,29(4):719-739.
[5]An H J,Lurie S,Greve L C,et al.Determination of pathogenrelated enzyme action by mass spectrometry analysis of pectin breakdown products of plant cell walls[J].Analytical Biochemistry,2005,338(1):71-82.
[6]Bonugli-Santos R C,Durrant L R,de Silva M,et al.Production of laccase,manganese peroxidase and lignin peroxidase by Brazilian marine-derived fungi[J].Enzyme and Microbial Technology,2010,46(1):32-37.
[7]Choi G H,Larson T G,Nuss D L.Molecular analysis of the laccase gene from the chestnut blight fungus and selective suppression of its expression on isogenic hypovirulent strain[J].Molecular Plant-Microbe Interactions,1992,5(2):119-128.
[8]Castro-Sowinski S,Martinez-Drets G,Okon Y.Laccase activity in melanin-producing strains ofSinorhizobiummeliloti[J].FEMS Microbiology Letters,2002,209(1):119-125.
[9]Zhu Xudong,Gibbons J,Zhang Shirong,et al.Copper-mediated reversal of defective laccase in aDeltavph1avirulent mutant ofCryptococcusneoformans[J].Molecular Microbiology,2003,47(4):1007-1014.
[10]Islam Md S,Haque Md S,Islam M M,et al.Tools to kills:Genome of one of the most destructive plant pathogenic fungiMacrophominaphaseolina[J].BMC Genomics,2012,13:493.
[11]冯晶,高增贵,薛春生,等.玉米弯孢霉叶斑病菌产生的细胞壁降解酶的致病作用研究[J].杂粮作物,2002,22(3):164-166.
[12]陈夕军,张红,徐敬友,等.水稻纹枯病菌胞壁降解酶的产生及致病作用[J].江苏农业科学,2006,22(1):24-28.
[13]陈兵,王坤元,董国强,等.水稻纹枯病菌的致病性与酶活力的关系[J].浙江农业学报,1992,23(1):19-22.
[14]Pratt R G.A direct observation technique for evaluating sclerotium germination byMacrophominaphaseolinaand effects of biocontrol materials on survival of sclerotia in soil[J].Mycopathologia,2006,162(2):121-131.
[15]Pecina V,Alvarado M D,Alanis H W,et al.Detection of double-stranded RNA inMacrophominaphaseolina[J].Mycologia,2000,92(5):900-907.
[16]Jana T,Sharma T R,Singh N K et al.SSR-based detection of genetic variability in the charcoal root rot pathogenMacrophomina phaseolina[J].Mycological Research,2005,109:81-86.
[17]Suriachandraselvan M,Seetharaman K.Survival ofMacrophominaphaseolina,the causal agent of charcoal rot of sunflower in soil、seed and plant debris[J].Journal of Mycology and Plant Pathology,2000,30(3):402-405.
[18]曹志艳,藏金萍,贾慧,等.玉米大斑病菌漆酶活性测定及基因片段的克隆[J].华北农学报,2011,26(2):76-80.
[19]Shin K S,Lee Y J.Purification and characterization of a new member of the laccase family from the white-rot basidiomyceteCoriolushirsutus[J].Archives of Biochemistry and Biophysics,2000,384(1):109-115.
[20]方中达.植病研究方法[M].北京:中国农业出版社,1998.
[21]薛莲,檀根甲,徐先松,等.苹果炭疽病菌对苹果果实致病机制初探[J].安徽农业大学学报,2006,33(4):522-525.
[22]倪小文,阎俊,陈新民,等.鲁麦21慢白粉病抗性基因数目和遗传力分析[J].作物学报,2008,34(8):1317-1322.
[23]刘喜存,刘红彦,倪云霞,等.不同化学诱抗剂对金银花叶片防御酶系的影响[J].植物保护,2009,35(2):75-77.
[24]王锡锋,张忠山,刘红彦,等.河南农家小麦品种资源抗、慢白粉病性鉴定[J].河南农业大学学报,1996,30(2):160-163,174.
[25]Kumar S V S,Phale P S,Durani S,et al.Combined sequence and structure analysis of the fungal laccase family[J].Biotechnology and Bioengineering,2003,83(4):386-394.

