粉尘螨铁蛋白的克隆、表达及蛋白特征分析
林建立,詹政科,刘玉琳,范小琴,耿晓瑞,刘晓宇
粉尘螨铁蛋白的克隆、表达及蛋白特征分析
林建立1,詹政科1,刘玉琳2,范小琴3,耿晓瑞3,刘晓宇1
目的 为了获得粉尘螨铁蛋白(ferritin)蛋白,并对该蛋白特征进行分析。方法 根据铁蛋白基因已知序列,设计出相应的引物,提取粉尘螨总RNA,采用RT-PCR方法扩增出铁蛋白基因,PCR产物克隆入pET32a载体,构建的重组质粒pET32a-ferritin,经酶切和测序鉴定后,再转化至大肠杆菌BL21(DE3),异丙基-β-D-硫代半乳糖苷(IPTG)诱导表达。用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)鉴定其表达效果,用Ni+离子亲和层析柱纯化其重组蛋白。用生物信息学方法对粉尘螨铁蛋白的特征进行分析。结果 成功克隆粉尘螨铁蛋白基因并构建了pET32a-ferritin重组质粒;粉尘螨铁蛋白基因开放阅读框为543 bp,编码179个氨基酸,PI 5.35;SDS-PAGE结果表明铁蛋白基因在大肠杆菌 Bl21(DE3)中获得良好的表达,经亲和层析纯化后, 表达产物分子质量约为20 kD。经生物信息学分析, 粉尘螨铁蛋白含有8个丝氨酸激酶、7个苏氨酸激酶、7个酪氨酸激酶、0组氨酸激酶磷酸化位点,亲水区域大于疏水区域,属不稳定蛋白。结论 克隆、表达了尘螨铁蛋白,经纯化后获得较高纯度的重组蛋白,并对其三级结构进行分析,为进一步研究尘螨过敏原的结构成分及其理化性质奠定理论基础。
粉尘螨;铁蛋白;蛋白表达、纯化;生物信息学分析
尘螨是室内最常见的过敏原,对人体过敏阳性率高达70%~80%[1]。其分泌物、排泄物和皮壳碎片等以尘埃颗粒飞扬于空气中,过敏体质者吸入后,可引起变应性心脏荨麻疹、过敏性鼻炎、螨性哮喘等变态反应性疾病。据统计,约25%的人群对尘螨有反应性,且这种反应性具有一定的遗传性[1]。因此,研究尘螨过敏原对保护人类的健康和维持正常的生活有重要意义[2]。
铁蛋白是普遍存在生物体内的一种保守性较高的多功能蛋白,其主要作用是储存铁,对生物体内铁含量进行调控,在生物体内铁含量较多时起到解毒作用[3-4]。而有关粉尘螨铁蛋白的报道较少,仅在W.R.Thomas、Su An等研究中发现,尘螨表达铁蛋白重链[5]、铁蛋白[6]。但国内未见对该基因及其蛋白特征的相关报道。本研究在国内首次利用RT-PCR方法克隆出粉尘螨铁蛋白片段,并用生物信息学方法对其分子特征进行分析,为进一步研究尘螨抗原的结构成分及其理化性质奠定基础,对进一步研究粉尘螨过敏机理及其诊断试剂和疫苗的研制提供理论依据。
1 材料与方法
1.1 主要试剂与材料 提取总RNA并RT-PCR,试剂盒购自QICGEN公司,RT-PCR试剂盒购自上海生工BBI公司,原核表达载体pET-32a购自Novagen 公司。pET-18a 载体、Ex-Taq 酶、限制性内切酶BamHⅠ与Hind Ⅲ、T4 DNA 连接酶和琼脂糖凝胶DNA回收试剂盒均购自TaKaRa 公司。
1.2 粉尘螨总RNA的提取 实验用粉尘螨由本课题组培养。挑取干净的活粉尘螨,用Qicgen公司的RNeasy Mini Kit 进行总RNA 的提取,操作步骤按说明书进行。
1.3 铁蛋白全长cDNA合成 以提取的总RNA为模板,逆转录cDNA,进行PCR 扩增反应。反应体系如下(50 μL):10 × Ex Taq Buffer 5 μL;TaKaRa ExTaq 0. 25 μL;dNTP Mixture,4 μL;上下游引物各2 μL,cDNA 为模板1 μL;加去离子水至50 μL。 PCR反应条件:94 ℃变性1 min;50 ℃ 退火1 min;72 ℃延伸1 min;35 个循环,PCR 产物经1% 琼脂糖电泳验证并拍照。
1.4 重组质粒构建及酶切鉴定 将上述PCR 产物与pMD-18T 连接后,热转化至E.coliTop10 中,涂布于含氨卞霉素( 100 mg·L-1)的LB 平板上,37 ℃培养过夜,从LB 平板上挑选白色菌落放入含氨卞霉素的LB 培养液中扩大培养,提取质粒。 用BamH I 酶切鉴定,重组质粒,委托华大基因工程(深圳)有限公司进行序列,测序正确后进一步将酶切产物与pET-28a 表达载体37 ℃反应4 h 进行连接转化至E.coliBL21,37 ℃ 培养过夜,挑取单个菌落,提取质粒后双酶切鉴定。
1.5 铁蛋白的诱导表达及纯化 将上述鉴定的pET32a-铁蛋白转化至感受态大肠杆菌BL21(DE3),待细菌生长处于对数生长期(A600 nm =0.6~0.9)时,加入20 μL 1 mol/L的IPTG,诱导蛋白表达。诱导4 h后取1 mL菌液,离心弃上清液,加100 μL去离子水后重悬菌体,加20~25 μL 10×SDS-PAGE上样缓冲液混合,沸水浴10 min,按照5 μL,10 μL,20 μL上样,进行SDS-PAGE 电泳分析, 以检测重组蛋白表达情况。诱导表达的重组蛋白,经裂解、溶菌、超声,将上清液以2 mL/min 的速度上样于已平衡好的Ni-NTA 柱。然后用平衡液充分洗柱,再分别用含40 mmol/L、300 mmol/L 咪唑平衡缓冲液进行洗脱,收集各次洗脱液进行SDS-PAGE 分析。
1.6 铁蛋白生物信息学分析 用NCBI 网站在线软件分析其ORF,用ProtParam Tools 预测其理化性质,用Translate Tool 推导其氨基酸序列,用KinasePhos 软件预测磷酸化位点。ProtScale 预测其亲水性,用列Signal P3.0分析其信号肽序,用SWISS-MODEL预测其三级结构,用MEGA5 工具包来构建系统进化树。
2 结 果
2.1 铁蛋白生物信息学分析
2.1.1 尘螨铁蛋白基因编码蛋白的理化性质 用PmtParam对尘螨铁蛋白基因编码蛋白的理化性质预测,推测该蛋白的分子式为C917H1408N258O285S8,分子量是20863.3 Da,理伦等电点pl 5.35;该基因含Glu (E) 最多,占10.6%;总的带正电残基(Arg+Lys)为21,负电残基(Asp+Gh)为31。总的平均疏水性为-0.723。该基因预测不稳定指数是41.97,按ProtParam定义,不稳定系数分值大于40时,预测蛋白较不稳定,故尘螨铁蛋白基因编码蛋白属不稳定蛋白。
用KinasePhos 软件预测磷酸化位点,预测结果表明铁蛋白含有8个丝氨酸激酶、7个苏氨酸激酶、7个络氨酸激酶、0组氨酸激酶磷酸化位点。
用ProtScale软件的Kyte and Doolittle算法对尘螨铁蛋白进行亲水性/疏水性进行分析。结果提示大约在尘螨铁蛋白中N端起115-125为疏水区域;60-70区域的亲水性最强,其次90-95、15-25、44-48、75-80、125-130区域具有较强的亲水性。可见,尘螨铁蛋白的亲水区域大于疏水区域。
2.1.2 SWISS-MODEL预测蛋白三级结构 用同源模建法,提交序列到SWISS-MODEL服务器( http://swissmodel.expasy.org/)进行自动模建,得到其三维结构,见图5。其结果与所选取X-衍射得到的模板序列相似性为62.86%,主要为α+β混合蛋白质,其三维结构是一个可容纳铁的球形结构。
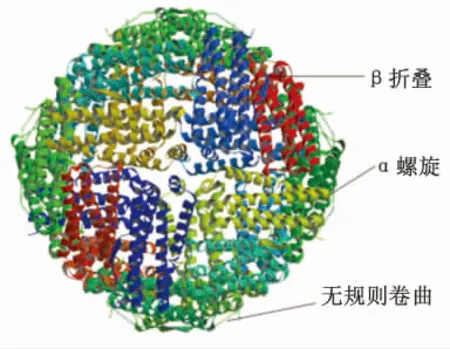
图1 尘螨铁蛋白三级结构预测
2.1.3 同源性分析 分析显示此粉尘螨铁蛋白与NCBI公布的粉尘螨铁蛋白同源性为91%,与屋尘螨铁蛋白重链同源性为86%。进化树显示,尘螨铁蛋白与屋尘螨、棕色蜱、变异革蜱、安氏革蜱、美洲钝眼蜱、派氏钝缘蜱、镰形扇头蜱、大池塘蜗牛、血红扇头蜱的同源蛋白关系较近(见图6)。
2.2 铁蛋白克隆、表达及纯化
2.2.1 目的基因的RT-PCR扩增 用反转录的cDNA 为模板, 用合成的引物进行PCR 扩增, 所得产物经1.0% 琼脂糖凝胶电泳,可见约550 bp的条带,其大小预期理论值一致(图1) 。
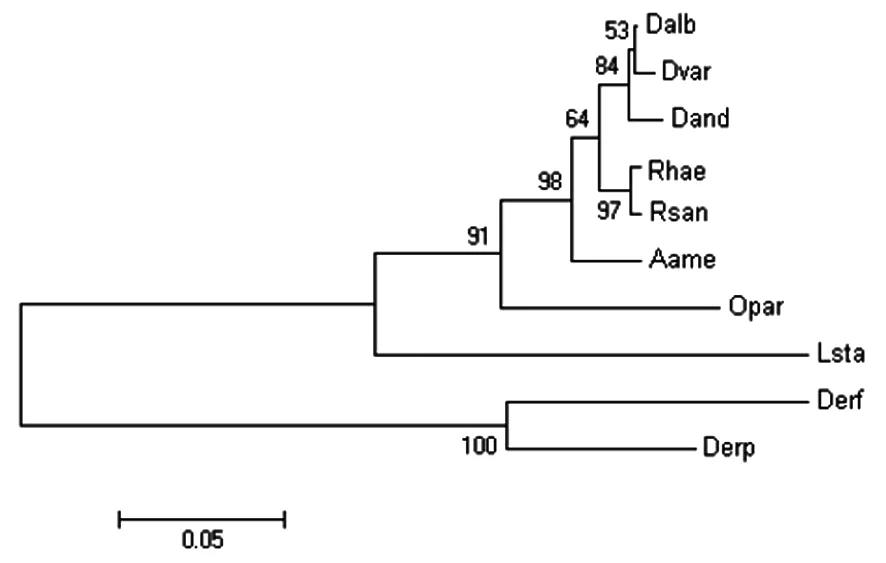
Derf:Dermatophagoidesfarinae;Derp:Dermatophagoidespteronyssinus;Dalb:Dermacentoralbipictus;Dvar:Dermacentorvariabilis;Dand:Dermacentorandersoni;Aame:Amblyommaamericanum;Opar:Ornithodorosparkeri:Rhae:Rhipicephalushaemaphysaloideshaemaphysaloides;Lsta:Lymnaeastagnalis,Rsan:Rhipicephalussanguineus
图2 ferritin的系统进化树分析
Fig.2 Phylogenetic relationship of dust mite ferritin
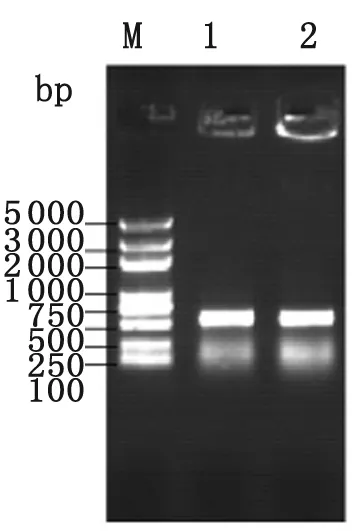
M:DNA marker; 1, 2:PCR product from ferritin.
Fig.3 PCR product of ferritin fromDermatophagoidesfarinae
2.2.2 重组表达载体的构建及测序 经测序结果显示:粉尘螨铁蛋白基因开放阅读框为543 bp,编码179个氨基酸,pI 5.35(图2)。此粉尘螨铁蛋白与NCBI公布的粉尘螨铁蛋白同源性为91%,与屋尘螨铁蛋白重链同源性为86%。将测序正确的铁蛋白基因连接到pET-32a表达载体后,用BamHⅠ和Hind Ⅲ 双酶切鉴定阳性克隆,电泳结果显示与铁蛋白的cDNA长度基本一致(图3),证明表达重组质粒pET32a-铁蛋白构建成功。
2.2.3 铁蛋白重组蛋白的表达和纯化 将含有pET-ferritin 重组表达质粒的阳性克隆菌株BL21进行扩培后, 经20 μL 1 mol/L IPTG,30℃诱导表达4 h, 将表达产物进行SDS-PAGE 电泳分析, 结果显示约20 kDa处有外源蛋白条带出现,该条带蛋白的分子量与重组蛋白的理论分子量相符。采用Ni+离子柱亲和层析的方法纯化重组蛋白(图4)。

图4 粉尘螨ferritin的cDNA序列
Fig.4 Sequence of ferritin cDNA fromDermatophagoidesfarinae

M:DNA marker; 1:PET-32a digested withBamHⅠandHindⅢ.
图5 pET32a-ferritin重组质粒的BamHⅠandHindⅢ双酶切验证
Fig.5 Restriction identification of recombinant plasmid pET32a-ferritin digested byBamHⅠandHindⅢ

M:Protein marker; 1:Derf-ferritin protein
3 讨 论
近几十年来,全球变态反应性疾病的发病率逐年升高[7],成为危害人类健康的主要问题之一。其中,我国过敏性哮喘患者达1 500余万,过敏性鼻炎患者超过5 000万,小儿过敏性哮喘患者达600余万[8]。粉尘螨是常见的吸入性致敏原之一,据估计,全球60亿人中约有10%的人对尘螨过敏[9],即约有1.2亿人。尘螨变应原的组成成分超过30种,其中主要变应原已制备单克隆抗体,且大部分变应原所具有的酶学性质也已被阐明[10]。目前,临床上对尘螨过敏患者进行诊断和特异性免疫治疗仍广泛使用尘螨粗提物抗原。但由于天然粗提物抗原的组分非常复杂,难以标准化,且容易受外源性有毒物质、病原微生物的污染,影响其重复性与安全性[11-12]。而重组变应原疫苗具有纯度高、无杂蛋白,易标准化,无外源性毒性物质和病原微生物污染等优势[13]。故研究发现、深入探讨变应原组分的免疫学、分子生物学特性及其在粗提浸液中以何种形式发挥作用,将有助于临床诊治相关疾病。
MJ Epton等研究发现尘螨表达的铁蛋白重链诱导的T淋巴细胞增殖反应与Derp 2所诱导的增殖反应具有密切联系。铁蛋白重链蛋白可使过敏患者Th1和Th2细胞因子都增高[5]。Shu An等研究发现尘螨表达的铁蛋白能与尘螨过敏阳性患者血清中的特异性IgE结合,皮试阳性率为60%,但没有完整的基因序列[6]。本文通过对本课题组前期完成的粉尘螨基因组和转录组测序结构分析比对,获得粉尘螨铁蛋白的基因序列,与NCBI公布的铁蛋白重链基因序列比对,同源性为86%。连接到pET-32a载体上,IPTG诱导表达后,经SDS-PAGE分析,表明重组蛋白在宿主大肠杆菌BL21(DE3)中得到了较高效的表达。经亲和层析纯化后,获得较高纯度的重组蛋白。
生物信息学是通过基因序列可预测其相应蛋白质结构和功能的重要工具[14]。基于国际互联网的大型基因和蛋白质数据库及相应的软件,极大方便了基因和蛋白质数据的分析[15]。本文通过运用生物信息学方法对重组铁蛋白的氨基酸理化参数、蛋白质亲疏水性、磷酸化位点、三级结构、同源性等进行分析。预测结果表明,粉尘螨铁蛋白含有8个丝氨酸激酶、7个苏氨酸激酶、7个络氨酸激酶、0组氨酸激酶磷酸化位点,亲水区域大于疏水区域,属不稳定蛋白。为进一步研究粉尘螨过敏原的结构成分及其理化性质奠定理论基础。
[1]He J, Wang HY, Jiang JJ, et al. Investigation on sensitivity of mites of acaro-asthma patients in different occupations[J]. Chin J Indust Hyg Occupa Dis, 2005, 23(1):447-448.
[2]Sture GH,Halliwell RE, Thoday KL, et al. Canine atopic disease:the prevalence of positive intradermal skin tests at two sites in the north and south of Great Britain[J]. Vet Immunol Immunopathol, 1995, 44(3/4):293-308.
[3]Arosio P, Levi S. Ferritiniron homesostasis and oxidative damage[J]. Free Radic Biol Med, 2002, 33(4):457-463.
[4]Bai X, Zhou JL, Cheng TY, et al. Molecular cloning and analysis of ferritin of boophilus microplus[J]. Chin J Anim Vet Sci, 2005, 36(1):66-69. (in Chinese) 白霞,周金林,陈天印,等.微小牛蜱铁蛋白编码基因的克隆和分析[J].畜牧兽医学报, 2005, 36(1):66-69)
[5]Epton MJ, Smith W, Hales BJ, et al. Non-allergenic antigen in allergic sensitization:responses to the mite ferritin heavy chain antigen by allergic and non-allergic subjects[J]. Clin Exp Allergy, 2002, 32(9):1341-1347.
[6]An S, Chen LL, Long CB, et al.Dermatophagoidesfarinaeallergens diversity identification by proteomics[J]. Mol Cell Proteomics, 2013, 12(7):1818-1828.
[7]Gruchalla RS, Pongracic J, Plaut M, et al. Inner city asthma study:relationships among sensitivity, allergen exposure, and asthma morbidity[J]. J Allergy Clin Immunol, 2005, 115(3):478-485.
[8]Zhong NS. Progress of research and control on bronchial asthma[J]. Chin J Tuberculosis Resp Dis, 1995, 18(1):136-139.
[9]Derewenda U, Li J, Derewenda Z, et al. The crystal structural of a major dust allergen Der P 2 and its biological implication[J]. J Mol Biol, 2002, 318(2):187-189.
[10]Thomas WR. Mite allergens group Ⅰ-Ⅶ. Acatalogue of enzymes[J]. Clin Exp Allergy, 1993, 23(1):250-250.
[11]Leng W, Wen TH. On the standardization of allergen extract[J]. Chin Pharmaceutical Affairs, 2002, 16:307-310. (in Chinese)
[12]Zhang HY, Ye ST. Standardization of allergen[J]. Foreign Med Sci (Sect Immunol), 1985, 23:113-116. ( in Chinese)
[13]Vrtala S, Huber H, Thomas WR. Recombinant house dust mite allergens[J]. Methods, 2014, 66(1):67-74.
[14]Aouacheria A, Navratil V, Wen W, et al. In silico whole-genome scanning of cancer-associated nonsynonymous SNPs and molecular characterization of a dynein light chain tumour variant[J]. Oncogene, 2005, 24(40):6133-6142.
[15]Zhou A, Chen X, Zhang YY, et al. Bioformatic analysis of CDl69 gene and its protein property and structure[J]. Chin Agr Sci Bull, 2011, 27(26):52-59. (in Chinese) 周傲,陈星,张滢寅.等.CD169基因及其蛋白性质和结构的生物信息学分析[J].中国农学通报,2011,27(26):52-59.
Cloning, expression and purification of dust mite ferritin and its molecular characteristics
LIN Jian-li1,ZHAN Zheng-ke1,LIU Yu-lin2,FAN Xiao-qin3,GENG Xiao-rui3,LIU Xiao-yu1
(1.InstituteofAllergyandImmunology,ShenzhenUniversity,Shenzhen518060,China;2.DepartmentofImmunology,MedicalCollege,NanchangUniversity,Nanchang330006,China;3.InstituteofOtorhinolaryngology,ShenzhenUniversity,Shenzhen518020,China)
We obtained recombinant ferritin fromDermatophagoidesfarinae, and analyzed the characterization of the protein. A pair of primers was designed according to the known sequence of ferritin gene. The live mites identified and cultured locally were picked and the total RNA was extracted. The ferritin gene fragment was amplified by RT-PCR, and cloned into pET32a vector, and then transferred intoE.coliTop10. The target gene obtained from the recombinant plasmid by digestion withBamHⅠandHind Ⅲ was connected to the prokaryotic expression vector pET-32a. The expressed recombinant plasmid containing ferritin gene was constructed by cloning target gene into pET-32a and transferred intoE.coliBl21 (DE3). The expressed recombinant protein was analyzed by SDS-PAGE, and was purified by immobilized metal ion affinity chromatography (IMAC). The ferritin expressed by dust mite was analyzed by the method of bioinformatics. The recombinant plasmid pET32a-ferritin was constructed. SDS-PAGE showed a correct molecular weight of the recombinant ferritin protein. After purification by affinity chromatography, the protein showed only one strip on SDS-PAGE gel. SDS-PAGE showed a band at 20 kD. Dust mite ferritin contains 8 serine kinase, 7 threonine kinase, 7 tyrosine kinase, and 0 histidine kinase phosphorylation sites. Hydrophilic region is larger than the hydrophobic region and it is an unstable protein. In conclusion, the ferritin gene has been cloned and expressed. The purified ferritin has high purity. The study provides a basis for further study of composition and physicochemical properties of house dust mite allergen.
Dermatophagoidesfarinae; ferritin; expression; purification; bioinformatics
Liu Xiao-yu, Email:lxy0901@163.com
国家自然科学基金(No.31328014、31400786)、广东省高等学校国际暨港澳台科技合作创新平台项目(No.2012gjhz0009)、深圳市科技计划国际科技合作项目(GJHZ20130408174112021)、深圳市科技计划基础研究项目(No.JCYJ20130329110735981、JCYJ20120613173233810)、深圳市南山区研发项目(No.KC2012JSYB0003A)。
刘晓宇,Email:lxy0901@163.com
1.深圳大学过敏反应与免疫学研究所,深圳 518060; 2.南昌大学医学院免疫学教研室,南昌 330006; 3.深圳大学耳鼻咽喉科研究所,深圳 518020
10.3969/j.issn.1002-2694.2015.10.007
R384.4
A
1002-2694(2015)10-0927-04
2014-09-24;
2015-08-17

Supported by the National Natural Science Foundation of China (Nos. 31328014 and 31400786), the Guangdong Province Colleges and Universities International and Hong Kong, Macao and Taiwan Science and Technology Cooperation Innovation Platform (No. 2012gjhz0009), the Shenzhen Science and Technology Project--International Scientific and Technological Cooperation Project (No. GJHZ20130408174112021), the Basic Research Project of Shenzhen Science and Technology Project (Nos. JCYJ20130329110735981 and JCYJ20120613173233810), the Nanshan District Shenzhen Research and Development Project (No.KC2012JSYB0003A)

