Survivin和Bcl-2基因靶向siRNA对舌癌Tca-8113细胞生长抑制及诱导凋亡作用的影响*
西安交通大学口腔医院医学研究中心(西安710004)
饶国洲 石建峰 王欣欣 魏 虹 李 昂 孙惠玲 张引成
Survivin和Bcl-2基因靶向siRNA对舌癌Tca-8113细胞生长抑制及诱导凋亡作用的影响*
西安交通大学口腔医院医学研究中心(西安710004)
饶国洲 石建峰 王欣欣 魏 虹 李 昂 孙惠玲 张引成
目的:探讨Survivin联合Bcl-2 siRNA对舌癌细胞的诱导凋亡作用。方法:实验分空白组、脂质体组、阴性干扰组、Survivin干扰组、bcl-2干扰组、Survivin/ bcl-2干扰组,以舌癌细胞系Tca-8113为研究对象,应用小干扰RNA(small interference RNA,siRNA)分别和同时沉默下调Survivin和Bcl-2两种基因的表达,采用MTT检测细胞增殖抑制作用,流式细胞仪检测细胞凋亡,透射电镜检测细胞超微结构变化,比较各组对肿瘤细胞生长的抑制及诱导凋亡作用。结果:转染24h后可见Survivin/ bcl-2干扰组的细胞形态发生明显改变,体积缩小变圆,染色质浓集于核膜内侧,核碎裂,电镜下呈典型的细胞凋亡形态学改变,并有凋亡小体出现,MTT显示细胞生长明显抑制,MCF检测凋亡率分别为空白组0.85%、脂质体组2.46%、阴性干扰组3.06%、Survivin干扰组15.48%、bcl-2干扰组11.02%、Survivin/ bcl-2干扰组29.18%,与空白组相比差异有统计学显著性意义(P<0.01),转染阴性siRNA及脂质体组无抑制和诱导凋亡作用,两组比较差异均无统计学意义(P>0.05)。结论: 靶向特异性Survivin联合Bcl-2 siRNA双基因沉默下调较单基因沉默下调作用显著增强,并且能有效抑制舌癌细胞的增殖及诱导其发生凋亡。
研究表明[1-2],siRNA可介导哺乳动物细胞特异性基因沉默,具有高效性和特异性,已成为基因功能研究和肿瘤基因治疗的新技术。本研究通过RNA干扰使舌癌细胞Survivin、bcl-2基因共沉默,同时与单一RNA干扰Survivin基因和bcl-2基因进行比较研究,观察转染后舌癌Tca-8113细胞的Survivin和bcl-2基因的表达,以及肿瘤细胞的生物学行为变化,探讨RNAi后的协同效果及作用机制和对舌癌细胞增殖凋亡的影响,以期为舌癌的基因治疗和其他相关的肿瘤生物治疗探索更加有效的治疗方案。
材料与方法
1 材 料 细胞株及RNA干扰载体:人舌癌Tca-8113细胞株(由本实验室保存),应用含10g/dl小牛血清和100μg/ml双抗的RPMI1640培养基传代培养;Survivin shRNA,Bcl-2 shRNA(由本室构建);酶标分析仪(Amersham);流式细胞仪(BD);透射电镜(日立);恒温培养箱(Thermo);台式离心机(Sigma);荧光倒置显微镜(Nikon);RPMI1640培养基(Hyclon);小牛血清(Gibco);MTT(Amresco);脂质体(Invitrogen)。
2 方 法 ①siRNA载体转染细胞:细胞数调成1×105接种于6孔培养板中,细胞生长至80%时转染。用无血清培养基稀释质粒DNA至100μl混匀,同时稀释6μl脂质体至100μl,两液混匀,室温放置20 min。转染前用无血清培养基漂洗细胞数次,将800μl 无血清培养基缓慢加入以上混合液混匀,加入培养细胞中,37℃,5%CO2温箱中培养。5h后补加20%小牛血清的完全培养基。②MTT检测:转染细胞分为6组,每组设6个复孔,以1×107细胞数接种于96孔培养板中,分别于转染后12、24、48、72h在酶标仪上570nm波长处检测各孔A值。抑制率(%)=(1-实验组A值/空白对照组A值)×100% 。③流式细胞仪检测:将各组细胞用0.25%胰酶消化离心收集,细胞数1×106个,用PBS洗2次,加入100μl Binding Buffer和10μl FITC荧光标记的AnnexinV(20μg/ml),室温避光30min,加5μl PI(50μg/ml),避光反应5min后,加入400μl Binding Buffer。同时以不加AnnexinV-FITC及PI的一管作阴性对照,立即上流式细胞仪检测。④透射电镜观察:收集各组转染后细胞数大于1×106个,用PBS洗2次后3%戊二醛固定,PBS洗2次,再用1%锇酸固定,丙酮酸梯度脱水。细胞经包埋后超薄切片染色,透射电镜观察。
结 果
1 RNAi载体成功转染Tca-8113细胞 将带红色荧光表达蛋白的Bcl-2 RNAi载体和带绿色荧光表达蛋白的Survivin RNAi载体分别转染到Tca-8113细胞中,24h后在荧光倒置显微镜下观察到在同一个细胞内出现红色和绿色荧光,表明靶向特异性Survivin/ Bcl-2双基因转染成功。见图1。

(A:Bcl-2shRNA;B:Survivin shRNA;C:Survivin/Bcl-2shRNA)
2 倒置显微镜下细胞学形态 转染前Tca-8113细胞呈铺路石样生长,细胞完整、轮廓清晰,增殖旺盛,转染后Tca-8113细胞形态发生改变,体积缩小变圆,染色质浓集于核膜内侧,核碎裂,细胞生长明显抑制。见图2。

(A:转染前Tca-8113细胞;B:转染后Tca-8113细胞)
3 MTT检测结果 经脂质体介导转染后,分别于培养12、24、48、72h收集细胞,采用MTT检测细胞增值抑制作用,结果显示沉默bcl-2后抑制率分别为9.1%、20.6%、29.8%、35.4%,沉默survivin后抑制率分别为13.6%、29.4%、36.2%、43.08%,沉默bcl-2/survivin后抑制率分别为18.2%、35.3%、44.7%、56.9%。各干扰组细胞增值能力与对照组相比受到明细抑制,差异均有统计学显著性意义(P<0.01),各干扰组间细胞增值能力比较差异有统计学意义(P<0.05),转染阴性siRNA及脂质体组无抑制作用,两组比较差异均无统计学意义(P>0.05)。结果显示,随培养和 RNA干扰作用时间的延长,细胞的生长抑制呈时间依赖性。见图3。
4 流式细胞仪分析显示 Tca-8113细胞经转染24h后,空白组、脂质体组、阴性对照组、Survivin 干扰组、Bcl-2干扰组、Survivin/ Bcl-2干扰组,凋亡率分别为0.85%、2.46%、3.06%、15.48%、11.02%及29.18%,RNA干扰组与对照组相比差异有统计学显著性意义(P<0.01),双基因沉默组较单基因沉默组相比差异有统计学意义(P<0.05),转染阴性shRNA、脂质体及空白对照组无诱导凋亡作用,各组比较差异均无统计学意义(P>0.05)。见图4。
5 透射电镜检测结果 转染脂质体和阴性对照及空白对照的Tca-8113细胞包膜完整,胞核圆形或不规则,核仁大而明显,细胞核内染色质分布不均,未见到凋亡细胞及凋亡小体。转染靶向Survivin及 Bcl-2 siRNA的Tca-8113细胞核内染色质团块状凝聚、边集,呈现出凋亡细胞的形态学改变,细胞核染色质高度凝集的凋亡细胞,其核内形成高电子密度的团块,且核膜缺损,核碎裂后分散在细胞突起内,部分突起与细胞分离,形成凋亡小体。见图5。

图3 不同干扰组对Tca-8113细胞增值抑制作用的影响
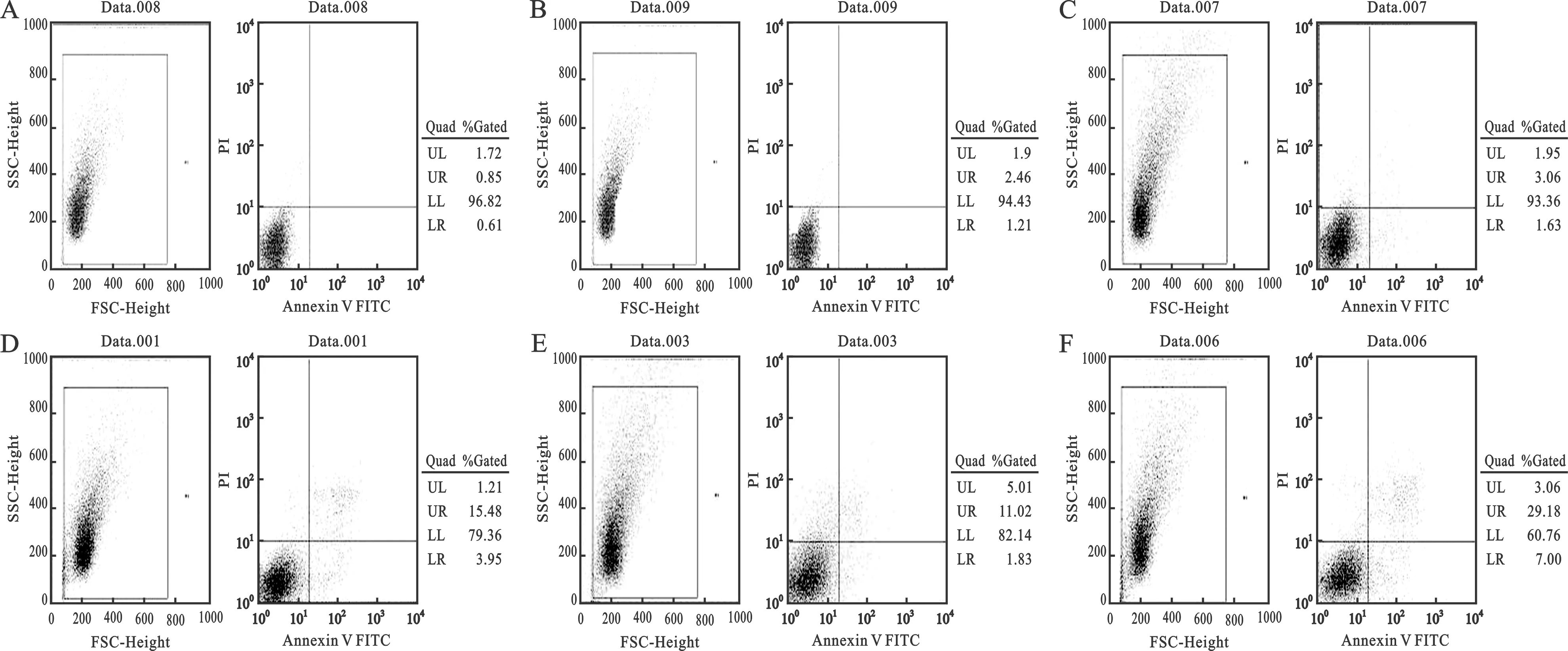
(A:空白对照组;B:脂质体对照组;C:阴性对照组;D:Survivin干扰组;E:Bcl-2干扰组;F:Survivin/Bcl-2干扰组)

(A:转染前Tca-8113细胞;B:转染后细胞核内形成凋亡小体)
讨 论
Survivin基因或 BIRC5又称生物存活素,属于凋亡抑制蛋白家族(IAPs),具有抑制细胞凋亡和调节细胞分裂的双重功能,是迄今发现最强的凋亡抑制基因[3],其在正常组织中几乎不表达,但在所有恶性肿瘤中均有明显表达。bcl-2是研究最深入的凋亡调控基因之一[4],能延长细胞寿命,但对细胞周期和分化不产生影响,bcl-2高表达能阻抑多种凋亡诱导因素如射线、化学药物等所引发的细胞凋亡。bcl-2基因在乳腺癌、卵巢癌、以及胃腺癌等多种人类肿瘤细胞中都显著升高。近些年这来两种基因倍受肿瘤研究领域广泛关注,目前对Survivin和Bcl-2在舌鳞癌中的表达已有较深入的研究及报道。
徐亚娟等[5], Survivin蛋白在舌鳞癌组织中表达阳性率为56.3%,癌旁组织中阳性表达为25.0%,正常舌粘膜中表达阴性。王智明等[6-7]研究发现, Survivin与Bcl-2在舌鳞癌组织中蛋白表达阳性率分别为68.9%和60.0%,正常舌粘膜中阴性表达。并且随着细胞分化程度越低阳性表达率越高,有淋巴结转移和无淋巴结转移的两者之间差异显著。籍丽莉[8]报道,Survivin在口腔鳞癌组织中表达阳性率高达88.89%,正常组织中无表达。
以上研究表明了Survivin和Bcl-2在口腔鳞癌组织中表达两者成正相关性, Survivin和Bcl-2的异常表达与舌鳞癌的发生发展密切相关,表明Survivin单独或协同bcl-2发挥了抗凋亡作用,也证明了肿瘤的发生和发展与多个基因相互作用相关。提示靶向 Survivin和Bcl-2 RNA干扰治疗口腔鳞癌的可行性。
目前,应用RNA干扰技术在肿瘤细胞中沉默单个基因的表达研究已有较多文献报道,同时沉默两种基因的表达报道较少,尤其在舌癌细胞系Tca-8113细胞中干扰沉默下调两个凋亡抑制基因的表达还未见报道。本研究在前期的工作中已成功构建了Survivin和Bcl-2慢病毒RNA干扰载体,并筛选出最佳干扰序列。在本研究中,通过脂质体介导分别转染siRNA到Tca-8113细胞中,沉默下调Survivin、bcl-2基因的表达,观察到舌癌细胞生长增殖明显减慢和抑制,细胞缩小变圆、数量减少及出现不同程度的细胞凋亡,在电镜下细胞核内可见明显的凋亡小体。这种抑制和凋亡程度随干扰时间的延长而增加,且具有时间依赖性。在实验中发现沉默Survivin基因诱导凋亡作用高于沉默bcl-2基因,显示出Survivin基因抑制凋亡作用强于bcl-2基因的作用,双基因沉默下调较单基因沉默下调细胞凋亡率显著增高(P<0.05),RNA干扰组的细胞增殖抑制率和细胞凋亡率与对照组相比,差异有统计学显著性意义(P<0.01)。由于Survivin和Bcl-2分别作用于凋亡通路的不同位点对凋亡抑制产生协同作用。推测当靶向特异性siRNA转染细胞时,沉默下调了Survivin和Bcl-2基因的表达,解除了Survivin直接抑制caspase蛋白酶的作用,和抑制凋亡终末效应器caspase-3和caspase-7的活性或干扰caspase-9的活性,以及各种刺激诱导的下游细胞凋亡的共同通路[9]。同时解除了bcl-2通过干扰细胞色素C自线粒体释放,而阻断caspase蛋白酶的激活[10],从而诱导细胞发生凋亡。蔡明等[11]报道,沉默单基因的凋亡作用较同时沉默两种基因的效果好,认为沉默两种作用于共同凋亡通路的基因,相互存在竞争和抑制作用导致其联合沉默作用的降低。由于本研究沉默的Survivin和Bcl-2基因抑制凋亡途经及作用凋亡通路的位点有所不同,本研究观察到联合沉默双基因具有协同诱导凋亡作用。在本研究中除沉默下调Survivin和Bcl-2基因以外,可能还有多种基因参与诱导凋亡作用有关,如caspase、P53、P21、Bax等,有待于更深入的研究。
舌癌是口腔颌面部发病率最高的鳞状细胞癌,其恶性程度非常高,由于舌的解剖和功能特点,早期即发生颈淋巴结转移。目前舌癌是以手术为主的综合治疗,如能采取其他有效的治疗方法控制早期癌变,临近亚病灶、微小病灶及转移病灶的发展,则可以减少手术切除范围,提高患者生存质量,而晚期舌癌手术治疗困难,临床中多采用放、化疗,由于肿瘤细胞对放、化疗的不敏感性及耐药性,往往治疗效果不佳。本实验结果表明,联合沉默Survivin和Bcl-2两种抗凋亡基因的表达,其对细胞的生长增值抑制和诱导凋亡作用强于沉默单基因的作用,这种协同作用和效果有助于肿瘤细胞对放、化疗敏感性的增加及降低耐药性,有助于更深入了解Survivin和Bcl-2 siRNA的作用机制及其在肿瘤基因治疗中的作用,为临床舌癌的治疗提供实验依据。
[1] Tuschl T, Borkhardt A.Small Interfering RNAs:A Revolutionary Tool for the Analysis of Gene Function and Gene Therapy[J].Mol Interv,2002,2(3):158-167.
[2] Konnikova L, Kotecki M,Kruger MM,etal. Cochranl. Knockdown of STAT3 expression by RNAi induces apoptosis in astrocytoma cells, BMC[J]. Cancer,2003,3(1):23-32.
[3] Kamihira S,Yamada Y,Hirakata Y,etal.Aberrant expression of caspase cascade regulatory genes in adult T-cell leukemia:surviving is an important determinant for prognosis[J].Br J Haematol,2001,14(1):63-69.
[4] Daido S,Tamiya T,Ono Y,etal.Expression of bcl-2,Bcl-X,and Bax protein in astrocytomas in relation to patient survival [J].Brain Tumor Pathol,2001,1(2):123-129.
[5] 徐亚娟,金志威,张艳秋,等.Survivin在舌鳞癌中的表达及意义[J].中国实验诊断学,2012,16(11):2094-2095.
[6] 王智明,刘 芳,管新明,等. Survivin在舌鳞癌中的表达及意义[J].上海口腔医学,2007,16(2):157-160.
[7] 王智明,管新明,孙 明,等.Survivin在舌鳞癌中的表达及其与Bcl-2的相关性[J].中国医科大学学报,2008,37(1):65-67.
[8] 籍丽莉.Survivin在口腔鳞状细胞癌中的表达及其与bcl-2,p53,bax,表达之间的关系[J].现代口腔医学杂志,2007,21(4):410-413.
[9] Kawasaki H,Altieri DC,Lu CD,etal. Inhibition of apoptosis by surviving predicts shorter survival rates in colorectal cancer[J].Cancer Res,1998,58(22):5071-5074.
[10] Gao G,Dou QP.N-terminal cleavage of Bax by calpain generates a potent proapoptotic 18kD fragment that promotes Bcl-2-independent cytochrome C release and apoptotic cell death[J].Cell Biothem,2001,80(1):53-72.
[11] 蔡 明,王国斌,陶凯雄,等.Livin基因和Survivin基因联合靶向siRNA诱导结肠癌细胞凋亡的作用[J].中华胃肠外科杂志,2009,12(4):399-403.
(收稿:2014-08-19)
致 作 者
向本刊投寄稿件时,作者署名一事也请按中华人民共和国国家标准《科学技术报告、学位论文和学术论文的编写格式》(GB7713-87)的有关规定执行,即"封面和题名页上,或学术论文前署名的个人作者,只限于那些对于选定研究课题和制定研究方案、直接参加全部或主要部分研究工作并作出主要贡献,以及参加撰写论文并能对内容负责的人,按其贡献大小排列名次。至于参加部分工作的合作者,按研究计划分工负责具体小项的工作者、某一项测试的承担者,以及接受委托进行分析检验和观察的辅助人员等,均不列入。这些人可以作为参加工作的人员一一列入致谢部分,或排于脚注。
陕西医学、陕西中医杂志社
*陕西省社发攻关项目(2009K12-01)
舌肿瘤 RNA干扰 基因, bcl-2 细胞凋亡 @Survivin基因 @Tca-8113细胞
R379.36
A
10.3969/j.issn.1000-7377.2015.02.004

