大骨节病、骨关节炎软骨细胞分泌IL-1β、 TNF-α及透明质酸对其影响实验研究*
西安交通大学医学院第二附属医院骨三科(西安710004)
高宗强 郭 雄△ 陈君长 段 琛△ 马玮娟△ 顾其胜▲
大骨节病、骨关节炎软骨细胞分泌IL-1β、 TNF-α及透明质酸对其影响实验研究*
西安交通大学医学院第二附属医院骨三科(西安710004)
高宗强 郭 雄△陈君长 段 琛△马玮娟△顾其胜▲
目的:探讨在不同剂量透明质酸作用下,人大骨节病(KBD)软骨细胞和骨关节炎(OA)软骨细胞对IL-1β、 TNF-α合成分泌的影响,为临床上透明质酸钠治疗OA及KBD提供实验依据。方法:将符合临床诊断标准的KBD及OA患者与从遭遇意外事故的病人作为正常对照,分离、体外培养三组患者关节软骨细胞,分别给予100 μg/ml(H100组)、500μg /ml(H500组)不同剂量的透明质酸钠(HA)干预及阴性对照(0.00 μg /ml,H0组),通过放免测定细胞培养上清液中IL-1β、 TNF-α的含量变化。结果:与正常组比较, KBD和OA组软骨细胞IL-1β、 TNF-α明显增高;HA干预随其剂量增高抑制IL-1β、 TNF-α合成增强,对TNF-α的抑制有统计学意义。结论:骨关节炎和大骨节病患者软骨细胞合成分泌IL-1β、 TNF-α明显增加;应用透明质酸后,可降低两种炎性因子的分泌。
大骨节病(Kashin-beck disease,KBD)是一种慢性的地方性、变形性骨关节病,严重危害病区人群的健康,其发病原因及发病机制仍不确切[1]。目前的治疗措施主要有更换生活用水、用粮及搬迁原有环境。对于关节疾患本身的治疗,鉴于与骨关节炎有类似的症状和体征,因此治疗也多参照骨关节炎,可以使用止痛、营养软骨、以及关节腔注射玻璃酸钠的治疗。
对于骨关节炎患者关节腔注射透明质酸,目前在最新的关节炎治疗指南中不予推荐。使得骨关节炎的治疗目前面临除了非甾体类抗炎药外,其他无药可用的局面。但在以往多年的临床应用中,我们一直发现关节腔注射玻璃酸钠对部分患者确实有效,而且,目前在临床中,关节腔注射玻璃酸钠仍在广泛应用[2-4]。
现已证实,在关节退变过程中,IL-1β、 TNF-α等促炎因子有重要的作用,目前已经有针对这两种细胞因子的抗体应用于临床治疗类分湿性关节炎及强直性脊柱炎。但体外培养的大骨节病细胞合成分泌IL-1β、 TNF-α尚无研究。对应用透明质酸后,对这两种患者软骨细胞合成分泌IL-1β、 TNF-α有何影响,仍属空白。本实验分离培养了大骨节病和骨关节炎患者的软骨细胞,施加透明质酸干预,观察软骨细胞合成分泌IL-1β、 TNF-α的影响。
材料和方法
1 标本来源 大骨节病诊断依据我国大骨节病临床诊断标准(GB16003-1995),骨关节炎诊断依据美国风湿病协会骨关节炎诊断标准(1995年版)。将收集的所有软骨标本分为三组:正常对照(NC)组、KBD组及OA组,每组6例。大骨节病(KBD)患者软骨标本主要取自于行游离体摘除术后患者的游离体,患者均来自于陕西省地方病研究所,其中男3例,女3例,年龄35~47岁。骨关节炎(OA)患者关节软骨标本均取自行全膝关节置换术者,病例均取自西安市红会医院,其中男3例,女3例,年龄57~73岁。正常组软骨标本取自于因车祸等意外原因行截肢术或身亡者的新鲜膝关节软骨,其中男4例,女2例,年龄27~39岁;取材部位主要是膝关节,均排除了遗传性、骨性关节炎和类风湿性关节炎[5-6]。
2 主要试剂与仪器 DMEM/F12培养液(Hyclone公司,美国);胰蛋白酶、透明质酸酶、Ⅱ型胶原酶(SIGMA公司,美国);透明质酸钠(上海其胜生物制剂有限公司,中国);小牛血清(兰州明海生物制品有限公司,中国); Shel-Lable CO2培养箱(Shel-Lable公司,美国);倒置显微镜(Olympus公司,日本);Nikon双目光学显微镜及纤维照相系统(日立公司,日本)[5-6]。
3 方 法
3.1 软骨细胞的分离与培养:按文献[5-6]方法进行原代软骨细胞的分离与培养与传代培养 将无菌条件下取材的软骨切碎,分别以0.2%胰酶1h、0.1%透明质酸酶1h、0.2%II型胶原酶4h分别进行消化分离软骨细胞,用含10%胎牛血清的DMEM/F12(其中含青霉素、链霉素各100U/ml)培养液,放入含5%CO2、37°C的CO2培养箱内培养。2~3d换液1次,一般3~4周形成细胞单层。待细胞达培养瓶70%~80%后以0.25% trypsin+ 0.02% EDTA消化分离细胞进行传代培养。
3.2 透明质酸干预:将长满的一代细胞消化下来后按每孔20×104密度种于6孔板,每孔加含培养液2ml。每个病例种一板。在种后48h后,更换培养液,吸弃原培养液,分别加入含不同剂量HA的培养液2ml,每个6孔板分为三组,每组2孔,分别为H0(0.00μg/ml)组、H100(100μg/ml)组、H500(500μg/ml)组,培养24h后,取上清,-20℃保存。
3.3 IL-1β、 TNF-α放免检测:将细胞培养上清液按放免试剂盒的操作说明进行放免检测。

结 果
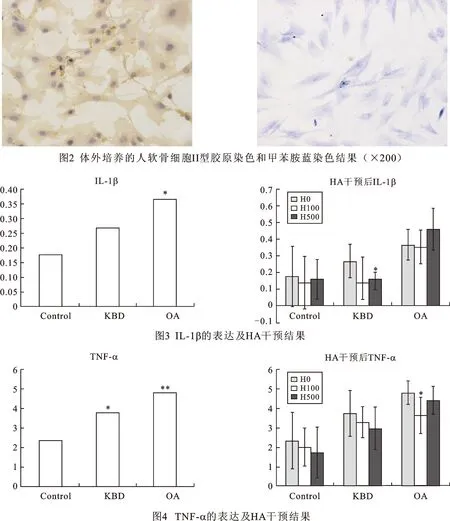
刚分离在培养液中悬浮未贴壁的人软骨细胞呈球状,已经贴壁的软骨细胞见图1。软骨细胞特异性的表达II型胶原和聚集蛋白聚糖,因此我们经常也用是否表达这两种成分来鉴定区分软骨细胞,其中棕色的为II胶原抗体免疫组化染色结果。蓝色为甲苯胺蓝染色显示聚集蛋白聚糖的结果,见图2。IL-1β在KBD和OA组中均有升高,以OA组中升高最明显,与正常相比,有统计学差异(P<0.05)。在补充HA干预后,可下调正常和KBD组IL-1β的分泌,在KBD组,H500能明显下调IL-1β(P<0.05),近乎达到正常组的水平。在OA组中,H500明显高于H0和H100,对IL-1β调节作用差异无统计学意义,见图3。TNF-α的含量依次为正常对照、KBD、OA。在经过HA干预后,三组TNF-α均有降低,在KBD和正常组中,随HA剂量增大,抑制效果越明显。在OA组,H100下调TNF-α分泌有统计学差异(P<0.05),见图4。

讨 论
对于骨性关节炎,我们原来一直认为主要原因是因为机械压力或磨损导致关节软骨出现破坏。最新理论认为,骨性关节炎不单单是软骨的退变破坏,它是包括了软骨、滑膜、肌腱、韧带在内的综合性病变[7],而且,骨关节炎越来越被认为是一种慢性炎症性疾患[8]。
软骨基质的正常结构和功能依赖于合成代谢和分解代谢的平衡,此平衡是通过细胞因子来调控的。根据细胞因子对代谢的调节作用特征,将其分为分解性细胞因子和合成性细胞因子,二者之间的平衡维持着软骨基质合成代谢和分解代谢的平衡,二者之间的平衡失衡是OA软骨基质的降解和破坏的基本原因。
分解性细胞因子中最主要的是白细胞介素-1 (IL-1)和肿瘤坏死因子(TNF)。目前对于这两种炎症因子在关节疾患中研究最多的是类风湿性关节炎和强直性脊柱炎,且均证实了IL-1和TNF-α可与相应细胞受体结合,激活NF-κB及相关信号通路,可以诱导基质金属蛋白酶和其他蛋白水解酶的合成并促进基质的分解代谢,是引起关节炎性病变及软骨降解的重要因素[7, 9-10]。正因为这两种因子在关节破坏中的重要作用,因此目前已经将肿瘤坏死因子抑制剂(TNFis)阿达木单抗、依那西普和英夫利昔单抗以及用于类风湿关节炎(RA)和强直性脊柱炎的治疗[11-12]。通过基因重组技术所产生的人IL-1受体拮抗剂Anakinra也已应用于临床。
目前研究表明,体内体外实验均证实这两种因子在骨关节炎中也高表达,并能促进软骨细胞合成分泌蛋白酶,在关节退变与破坏中有重要作用[13-14]。在KBD患者中,同样有IL-1β和TNF-α的高表达。李小迎等[15]通过对病区和对照组共216例调查后发现,成人KBD血清TNF-α和一氧化氮显著增高,且与临床表现变化有关。崔才磊等[16]对51例KBD患者和24例正常人血清IL-1β和TNF-α检测后,发现患者血清IL-1β和TNF-α水平均高于正常人,而且KBD患者IL-1β和TNF-α含量存在线性相关关系。岳燕、童文森的研究结果也同样证实了KBD患者血清和关节滑液IL-1β和TNF-α比正常人高[17-18]。
而我们的实验结果同样显示了在骨关节炎及大骨节病患者的软骨细胞合成分泌IL-1β和TNF-α是明显增高的,这与以往的研究均一致。
既往临床研究表明,关节腔注射透明质酸对关节退变过程中的炎性因子有很好的抑制作用。张银刚[19]通过测量OA患者注射HA前后血清及滑液中TNF-α和IL-1β含量变化后,发现治疗后TNF-α和IL-1β水平降低。HA 可能通过直接或间接调节 IL-1β和TNF-α水平,减轻继发性炎症反应,抑制免疫细胞增殖从而达到治疗OA的目的。丁元洪等[20]分别检测健康人及OA患者HA补充治疗前后的血清及关节滑液中各细胞因子(IL - 1、IL - 6、IL - 8、TNF -α)的含量,发现OA的发病机制与关节滑膜细胞分泌过多的细胞因子以及这些细胞因子释放入血有关。血清及关节滑液中细胞因子的检测可作为诊断OA的重要指标之一。其次,补充HA治疗可降低OA患者血清及关节滑液中细胞因子的含量,抑制OA免疫损害进程,疗效肯定。补充HA治疗后患者血清及关节滑液中细胞因子含量的变化可作为评价其疗效的重要指标之一。
在动物实验中也有同样的结果。Takahash等[21]对80只实施前叉韧带横断术后的新西兰大白兔的研究中发现,使用HA治疗后滑液中的金属蛋白酶-3 (MMP-3)及白细胞介素-1β的基因表达均受到抑制。对狗萎缩的软骨细胞进行的免疫荧光检查中表明,使用HA治疗后未发现肿瘤坏死因子-α(TNF-α)及其受体,而未经HA治疗组则有大量的肿瘤坏死因子-α的表达[22]。印海峰[23]以木瓜蛋白酶诱导兔OA模型,以两种剂量玻璃酸钠注射液给兔膝关节腔内注射,给药5周后,玻璃酸钠注射液关节内注射可以降低IL-1β和TNF-α的含量,同时使病变关节软骨中蛋白聚糖和HA的含量增加,可以保护关节软骨,对OA治疗有一定作用。
许鹏等[24]应用透明质酸关节腔注射治疗KBD,发现疗效显著。何长谋[25]发现KBD血清中NO、IL-1β和TNF-α含量明显高于健康人群,在经过关节腔内注射HA后,血清IL-1β、TNF-α和NO含量明显下降,其中IL-1β、TNF-α降至健康人群水平。
本实验同样证实了KBD患者和OA患者软骨细胞IL-1β和TNF-α的含量均较正常人组高,而且体外培养的正常软骨细胞IL-1β和TNF-α分泌量均很低,既往也有研究显示体外培养的正常关节软骨细胞和滑膜组织细胞只能产生微量的IL-1β,而在OA的关节液和滑膜组织细胞体外培养的上清液中都能检测出较高水平的IL-1β,来源于OA的软骨细胞能自发产生IL-1β[26]。这都与既往研究结果相符合。
本实验还显示HA可有效的抑制TNF-α的分泌,这在以往研究中得到了证实。对于HA对减低软骨细胞合成分泌TNF-α的具体机理,以为有研究表明是通过下调NF-κB 来实现的[27]。然而具体机理,还需进一步的研究验证。对于IL-1β,添加HA后有降低的趋势,我们既往实验证明了对体外培养的骨关节炎和大骨节病软骨细胞添加透明质酸干预后,可促进II型胶原和聚集蛋白聚糖的合成和表达,并可促进细胞的增值并抑制凋亡,并有促进内源性透明质酸合成的作用[2-3]。本研究为临床使用透明质酸治疗大骨节病、骨关节病提供了一定的实验基础。
[1] 郭 雄. 大骨节病病因与发病机制的研究进展及其展望[J]. 西安交通大学学报:医学版, 2008,29(5):481-488.
[2] 姚亚洲, 朱海林, 田昱平, 等. 透明质酸钠关节腔内注射治疗膝骨关节炎疗效观察[J]. 陕西医学杂志, 2005,34(11):1410-1411.
[3] 尤培华. 膝关节镜联合透明质酸钠治疗老年膝关节骨性关节炎疗效观察[J]. 中国现代药物应用, 2015,(3):138-139.
[4] 王安硈, 周瀛梁, 陈志坚, 等. 益肾蠲痹丸联合透明质酸钠治疗膝关节骨性关节炎疗效观察[J]. 现代中西医结合杂志, 2015,(1):42-44.
[5] 高宗强, 郭 雄, 陈君长, 等. 透明质酸对体外培养的大骨节病和骨关节炎软骨细胞透明质酸合成酶2 mRNA表达的影响[J]. 中国全科医学, 2014,(30):3575-3578,3584.
[6] 高宗强, 郭 雄, 陈君长, 等. 透明质酸对体外培养大骨节病软骨细胞Ⅱ型胶原和聚集蛋白聚糖mRNA表达的影响[J]. 中国组织工程研究与临床康复, 2009,(46):9061-9065.
[7] Mobasheri A. The future of osteoarthritis therapeutics: Emerging biological therapy[J]. Curr Rheumatol Rep, 2013,15(12):385.
[8] Berenbaum F. Osteoarthritis as an inflammatory disease (Osteoarthritis is not osteoarthrosis!)[J]. Osteoarthritis Cartilage, 2013,21(1):16-21.
[9] 代 康, 焦 凯. 细胞因子在骨关节炎软骨病变中的作用[J]. 国际口腔医学杂志, 2012,39(4):491-493.
[10] McInnes IB, Liew FY. Cytokine networks-towards new therapies for rheumatoid arthritis[J]. Nat Clin Pract Rheumatol, 2005,1(1):31-9.
[11] 池里群, 周 彬, 高文远, 等. 治疗类风湿性关节炎常用药物的研究进展[J]. 中国中药杂志, 2014,(15):2851-2858.
[12] van der Heijde D, Sieper J, Maksymowych WP,etal. 2010 Update of the international ASAS recommendations for the use of anti-TNF agents in patients with axial spondyloarthritis[J]. Ann Rheum Dis, 2011,70(6):905-8.
[13] Malemud CJ. Anticytokine therapy for osteoarthritis: evidence to date[J]. Drugs Aging, 2010,27(2):95-115.
[14] Goldring MB. Anticytokine therapy for osteoarthritis[J]. Expert Opin Biol Ther, 2001,1(5):817-29.
[15] 李小迎, 郭 雄, 王立新, 等. 成人大骨节病血清透明质酸、肿瘤坏死因子α、血管内皮生长因子、NO和硒含量检测[J]. 南方医科大学学报, 2007,(7):941-944.
[16] 崔才磊, 于红阳, 岳义田, 等. 大骨节病患者血清白细胞介素-1β、肿瘤坏死因子-α检测[J]. 郑州大学学报(医学版), 2008,(4):656-658.
[17] 岳 燕, 凌 鸣, 李思远, 等. 大骨节病患者血清白介素-1β、肿瘤死亡因子-α的水平测定[J]. 国外医学.医学地理分册, 2003,(1):46-48.
[18] 童文森, 杨天府. 大骨节病患者滑液中IL-1、TNF的生物活性测定[J]. 中国地方病防治杂志, 2000,(2):71-72.
[19] 张银刚, 薛金山,刘 钅监, 等. 外源性玻璃酸钠对骨关节炎患者的血清及滑液中白介素1β和肿瘤坏死因子α的影响[J]. 中国临床康复, 2002,6(8):1204-1205.
[20] 丁元洪, 张功礼, 禹志宏, 等. 透明质酸对骨关节炎患者血清及关节滑液中细胞因子含量的影响[J]. 中国全科医学, 2002,(2):108-110.
[21] Takahashi K, Goomer RS, Harwood F,etal. The effects of hyaluronan on matrix metalloproteinase-3 (MMP-3), interleukin-1beta(IL-1beta), and tissue inhibitor of metalloproteinase-1 (TIMP-1) gene expression during the development of osteoarthritis[J]. Osteoarthritis Cartilage, 1999,7(2):182-90.
[22] Comer JS, Kincaid SA, Baird AN,etal. Immunolocalization of stromelysin, tumor necrosis factor (TNF) alpha, and TNF receptors in atrophied canine articular cartilage treated with hyaluronic acid and transforming growth factor beta[J]. Am J Vet Res, 1996,57(10):1488-96.
[23] 印海峰, 凌沛学, 王凤山, 等. 含磷脂酰胆碱的玻璃酸钠制剂对兔骨关节炎的影响[J]. 中国药学杂志, 2006,(6):424-427.
[24] 许 鹏, 郭 雄, 靳卫章, 等. 关节腔内注射透明质酸钠治疗大骨节病的疗效观察[J]. 中国地方病学杂志, 2004,(6):80-82.
[25] 何昌谋. 关节腔注射透明质酸钠对成人大骨节病患者血清NO、TNF-α和IL-1β含量的影响[J]. 陕西医学杂志, 2011,40(10):1401-1402.
[26] 孙永生, 娄思权. 骨性关节炎发病分子机制研究进展[J]. 中国骨与关节损伤杂志, 2005,(8):571-573.
[27] Yasuda T. Hyaluronan inhibits cytokine production by lipopolysaccharide-stimulated U937 macrophages through down-regulation of NF-κappaB via ICAM-1[J]. Inflamm Res, 2007,56(6):246-53.
(收稿:2015-03-16)
The effect of hyluronic acid on the expression of IL-1β,TNF-α in chondrocytes of Kashin-beck disease and osteoarthritis cultured in vitro
Department of Orthopedics Surgery, Second Affiliated Hospital,Medical School of Xi’an Jiaotong University(Xi’an 710004)
Gao Zongqiang Guo Xiong Cheng Junchang et al
Objective: To investigate the effect of HA on the expression of IL-1β,TNF-α in KBD and OA chondrocytes cultured in vitro to understand the effect and mechanism of HA on the treatment for KBD and OA. Method: We selected the articule cartilage sample of KBD and OA patients according to clinical diagnosis for KBD and OA. Chondrocytes of KBD, OA and normal control were separated and cultured in vitro . Then varying dosages of HA were administered to chondrocytes,100 μg/ml(H100 group)、500μg /ml(H500 group)and negative control(0.00 μg /ml,H0 group),and the expression of IL-1β, TNF-α were detected by means of radio-immunologic analysis.Result: Compared with normal control group, the IL-1β,TNF-α were higher in KBD and OA.after administed with HA, the expression of IL-1β,TNF-α were decreasing accordingly. there is no stastic signifcance in TNF-α expression.Conclusion: IL-1β,TNF-α were higher in KBD and OA, and the HA have the tendcency to decrease the expression of IL-1β,TNF-α.
Hyaluronic acid Kashin-beck disease Osteoarthritis Chondrocytes Interleukin-lbeta Tumor necrosis factor-alpha
国家自然科学基金重点资助项目(30630058)
陕西省社会发展公关资助项目(2013SF2-10)
郭 雄
透明质酸 大骨节病 骨关节炎 软骨细胞 白细胞介素-1β 肿瘤坏死因子-α
R363
A
10.3969/j.issn.1000-7377.2015.07.002
*科技部国际合作重点专项(2006DFA33610)
△西安交通大学医学院公共卫生系地方病研究所、环境与疾病相 关基因教育部重点实验室
▲上海其胜生物制剂有限公司

